БЕЛЕНКОВ
Ю.Н. ОГАНОВ Р.Г.
«РУКОВОДСТВО
ПО АМБУЛАТОРНО-ПОЛИКЛИНИЧЕСКОЙ КАРДИОЛОГИИ»
2007
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ КАРДИОЛОГИЧЕСКОГО БОЛЬНОГО
Общее исследование сердечно-сосудистой системы состоит из следующих этапов: сбора анамнеза, физикального обследования, рутинных инструментальных исследований (ЭКГ, рентгенография грудной клетки), неинвазивных специальных исследований (ЭхоКГ, радиоизотопное исследование, КТ и МРТ), инвазивных исследований (прежде всего катетеризация сердца).
В амбулаторных условиях проводят первые четыре группы исследований, в диагностически сложных ситуациях пациента направляют в специализированный стационар, где прибегают к инвазивным методам.
В 50-80% случаев постановка предварительного, а зачастую и заключительного диагноза возможна на основании оценки анамнеза заболевания и физикального обследования.
АНАМНЕЗ
Обычно беседу начинают с выяснения основных жалоб пациента и сопутствующих симптомов.
Важнейшее значение имеет выявление длительности, частоты возникновения, интенсивности проявлений болезни, провоцирующих и облегчающих факторов.
Одна из основных причин обращения к врачу - боль.
В истории заболевания необходимо отразить характер (острая, тупая и т.д.) боли, локализацию, распространение (иррадиация), длительность (временная или постоянная), условия ослабления болевых ощущений, условия их усиления, сопутствующие симптомы.
Необходимо выяснить не только факты проведения в прошлом каких-либо исследований и установленные диагнозы, но и, по возможности, узнать результаты обследования для более полной оценки состояния пациента и разработки плана диагностических мероприятий.
Обязательным является скрупулёзное выяснение, какие лекарственные средства, биологически активные добавки принимает пациент, в каких дозах.
Информация о сопутствующих состояниях и заболеваниях может дать важные «ключи» к диагностике сердечно-сосудистой патологии.
Следует узнать, не было ли в детстве у пациента проявлений ревматизма (хорея Сиденхэма в виде непроизвольных подёргиваний мышц лица и верхних конечностей, «летучие» суставные боли или просто частые ангины) или врождённых заболеваний сердца (цианоз, плохая переносимость физических нагрузок).
Среди заболеваний, нередко сопровождающихся поражением сердца и крупных сосудов, можно назвать злокачественные новообразования с метастазами, болезни щитовидной железы, сахарный диабет, аутоиммунные заболевания (ревматоидный артрит, анкилозирующий спондилит, системная красная волчанка), поражения почек с артериальной гипертензией (хронический гломерулонефрит), заболевания органов дыхания (хроническая обструктивная болезнь лёгких с хроническим лёгочным сердцем).
Семейный анамнез помогает выявить наследственную предрасположенность к развитию сердечно-сосудистых заболеваний.
Выясняют возраст и состояние здоровья родственников трёх степеней родства.
Среди распространённых заболеваний, имеющих наследственный генез или характеризующихся наследственной предрасположенностью, выделяют гиперлипидемию, сахарный диабет, артериальную гипертензию, эпилепсию, бронхиальную астму, атопию, психические болезни (алкоголизм, депрессия, шизофрения), рак (кишечника, яичников, молочных желёз).
Предиктором неблагоприятного течения сердечно-сосудистых заболеваний является внезапная смерть кого-либо из родственников в молодом и среднем возрасте.
Реже встречаются наследственные синдромы, при которых поражается сердечно-сосудистая система:
- синдром Марфана (высокое сводчатое нёбо, арахнодактилия, высокий рост, практическое отсутствие подкожного жира), можно наблюдать пролапс и регургитацию на уровне митрального клапана, расширение аорты с регургитацией в области аортального клапана и расслоением стенки аорты
- синдром Тернера (низкий рост, «крыловидная» шея, маленький подбородок, широко расставленные соски, вальгусная деформация локтей, Х-образные руки, недоразвитость половой системы) может сочетаться с коарктацией аорты и стенозом лёгочной артерии
- osteogenesis imperfecta (повышенная ломкость костей, голубой оттенок склер, аномалии зубов, прогрессирующее снижение слуха) сочетается с аортальной или митральной регургитацией
- синдром Элерса-Данло (повышенная растяжимость и хрупкость кожи, избыточная подвижность суставов, кифосколиоз) нередко сопровождается пролапсом митрального клапана, дефектом межпредсердной перегородки или тетрадой Фалло.
Отдельный и обязательный пункт в обследовании кардиологического пациента - оценка факторов риска развития ИБС.
Среди неустранимых факторов риска выделяют
возраст (мужчины старше 55 лет, женщины старше 65 лет),
мужской пол,
указание в анамнезе на раннее развитие ИБС (мужчины ранее 55 лет, женщины ранее 65 лет) у ближайших родственников.
К устранимым факторам риска относят
курение,
гиперлипидемию,
сахарный диабет,
артериальную гипертензию,
низкую физическую активность,
ожирение (индекс массы тела больше 30кг/м2).
ОБЪЕКТИВНОЕ ИССЛЕДОВАНИЕ
ОСМОТР
Осмотр пациента должен начинаться с самого первого момента контакта с больным и продолжаться в процессе расспроса и физикального исследования.
Отмечают характерные особенности внешнего вида пациента (общий вид и строение тела, осмотр кожных покровов, лица, конечностей, грудной клетки и живота), цвет кожных покровов.
Во время общего осмотра на основании сочетания характерных признаков можно заподозрить наличие некоторых заболеваний:
- высокий рост и длинные конечности
могут свидетельствовать о наличии наследственного заболевания, при котором поражается сердечно-сосудистая система (синдромы Марфана, Клайнфелтера, гомоцистинурия)
- высокий рост в сочетании с утолщением конечностей и костей черепа и грубыми чертами лица
характерен для акромегалии (одновременно могут присутствовать артериальная гипертензия, кардиомиопатия, нарушения проводимости)
- патологическое ожирение и сонливость
характерны для синдрома обструктивного апноэ во сне (сочетается с лёгочно-артериальной гипертензией, хроническим лёгочным сердцем, повышенным риском внезапной сердечной смерти)
- центральное ожирение туловища, тонкие конечности, лунообразное лицо, кожные стрии фиолетового цвета
типичны для синдрома или болезни Кушинга (часто сопровождается артериальной гипертензией)
- неестественно прямая спина вследствие ограничения подвижности позвоночника, шейно-грудной кифоз («поза просителя»)
характерны для анкилозирующего спондилита (иногда сочетается с недостаточностью аортального клапана и полной поперечной блокадой сердца)
- выраженный поясничный лордоз, походка вразвалку, псевдогипертрофия мышц голени
характерны для больных с мышечной дистрофией Дюшенна (может сочетаться с гипертрофической кардиомиопатией и псевдоинфарктными ЭКГ)
- экзофтальм, фиксированная ретракция верхнего века, тремор
характерны для гипертиреоза (в сочетании с наджелудочковыми тахиаритмиями, недостаточностью кровообращения с высоким сердечным выбросом)
- сухие и ломкие волосы, выпадение латеральных участков бровей, отёки век, апатичное лицо, утолщение кожи
характерны для гипотиреоза (перикардит, ИБС)
- дифференцированный цианоз (пальцы рук имеют обычную окраску, а пальцы ног цианотичны), утолщение концевых фаланг пальцев
характерны для врождённых пороков сердца со сбросом крови справа налево (незаращение артериального протока) или коарктации аорты.
При осмотре кожных покровов можно выявить следующие изменения:
- бледность может быть признаком сердечной недостаточности вследствие уменьшения сердечного выброса, кожа при этом обычно холодная, при анемиях также можно наблюдать бледность, однако кожа при этом тёплая на ощупь, что отражает увеличение сердечного выброса
- покраснение кожи - признак вазодилатации, который наблюдается при многих состояниях (гипертиреоз, заболевания печени, повышение температуры тела), однако особую настороженность должны вызывать внезапные приливы крови с возможным отёком мягких тканей лица на фоне красновато-пурпурной окраски различных оттенков. Такие проявления свидетельствуют о карциноидном синдроме (чаще при опухолях кишечника) и могут сочетаться с трикуспидальным или лёгочным стенозом
- цианоз (синюшное окрашивание кожи) может быть центральным и периферическим.
При центральном цианозе, который носит диффузный характер, следует думать о тяжёлых врождённых пороках сердца, массивной тромбоэмболии лёгочной артерии.
Причинами периферического цианоза в области ногтевых лож, кончика носа, щёк, мочек ушей служат вазоконстрикция и замедление кровотока вследствие выраженной сердечной недостаточности.
Участки кожи с периферическим цианозом обычно холодные на ощупь.
Комбинацию признаков центрального и периферического цианоза наблюдают при декомпенсированном лёгочном сердце с плохим прогнозом
- грязновато-бронзовый цвет кожи наблюдают при гемохроматозе (заболевание нередко осложняется сахарным диабетом и кардиомиопатией рестриктивного типа).
При осмотре головы и лица обращают на себя внимание следующие характерные особенности:
- тревожное выражение лица с испариной или гримасой боли может быть признаком жизнеугрожаюшего состояния (инфаркт миокарда, расслаивающая аневризма аорты, тромбоэмболия лёгочной артерии)
- цианотичный румянец щек facies mitralis и цианоз губ встречаются при митральном стенозе или лёгочно-артериальной гипертензии
- при полицитемии, которая нередко приводит к развитию сосудистых тромбозов и артериальной гипертензии, может наблюдаться кирпично-красное окрашивание лица
- кивательные движения головы синхронно сердечным сокращениям (симптом Мюссе) наблюдаются при выраженной аортальной регургитации
- косая или глубокая диагональная складка на мочке уха (складка Франка, линия Хортона) свидетельствует об атеросклеротическом поражении коронарных артерий
- ксантелазмы (желтоватые выступающие пятна на коже век) свидетельствуют о гиперхолестеринемии лишь у лиц младше 50лет
- «лицо эльфа» (маленький подбородок, неправильно сформированные зубы, приоткрытый рот, широко расставленные глаза, отвисшие щёки) встречается при тяжёлом врождённом стенозе клапана лёгочной артерии
- дуга роговицы (широкий ободок, начинающийся снизу и расположенный так, что между дугой и склерой видна полоска пигментированной радужки) свидетельствует о гиперхолестеринемии
- уплотнение и натяжение кожи вокруг рта, рассеянные телеангиоэктазии, участки гипо- или гиперпигментации, характерны для системной склеродермии (сочетается с лёгочной гипертензией, перикардитом, миокардитом)
При осмотре конечностей можно встретить следующие изменения:
- изменения концевых фаланг пальцев по типу «барабанных палочек». Чтобы продемонстрировать их наличие, просят больного сложить вместе 2 ногтевые пластинки одноимённых пальцев рук. Заметное в норме пространство между ними в виде ромбика при симптоме «барабанных палочек» исчезает. Среди основных причин этого симптома - заболевания лёгких (рак лёгкого, хронические гнойные инфекции, фиброзирующий альвеолит, пневмокониозы), болезни сердца (врождённые пороки со сбросом крови справа налево, подострый эндокардит), другие заболевания (цирроз печени, неспецифический язвенный колит, болезнь Крона, целиакия)
- узелки Ослера (болезненные образования размером с горошину, расположенные на коже кончиков пальцев, ладоней и подошв) и пятна Джейнуэя (безболезненные эритематозно-геморрагические поражения ладоней и подошв) наблюдаются при подостром эндокардите (у небольшой части пациентов)
- отёки нижних конечностей нередко развиваются при застойной сердечной недостаточности. Для их выявления следует плотно прижать кожу к прилежащей кости (например, в области передней поверхности большеберцовой кости) тремя слегка расставленными пальцами на 10с, а затем провести пальцем по месту сжатия. Кожная ямка, образовавшаяся на месте сжатия и разглаживающаяся дольше 40с, свидетельствует о наличии отёков сердечной этиологии. Среди основных причин двусторонних отёков нижних конечностей выделяют хроническую сердечную недостаточность, гипоальбуминемию, хроническую венозную недостаточность, предменструальный синдром, идиопатические отёки. Врача амбулаторного звена должно насторожить внезапное развитие одностороннего отёка нижней конечности, сопровождающееся болезненностью при пальпации, что может свидетельствовать о тромбозе глубоких вен.
Осмотр грудной клетки и живота помогает выявить следующие нарушения:
- воронкообразная грудная клетка («грудь сапожника») нередко встречается при различных генетических нарушениях (синдром Марфана) и может сочетаться с аневризмой аорты или лёгочной артерии, миксоматозным перерождением митрального и аортального клапанов с регургитацией, дефектом межжелудочковой перегородки
- тяжёлый кифосколиоз в течение длительного времени приводит к развитию хронического лёгочного сердца
- выбухания грудной стенки в области сердца характерны для дефектов межпредсердной и межжелудочковой перегородок
- пульсирующий видимый верхушечный толчок свидетельствует о гипертрофии левого желудочка, хотя и может встречаться у молодых людей с тонкой грудной стенкой
- видимая пульсация в III межрёберном промежутке слева или II межрёберном промежутке справа указывает соответственно на расширение лёгочной артерии или аорты
- асцит характерен для правожелудочковой или бивентрикулярной сердечной недостаточности.
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
Пальпацию артериального пульса проводят для оценки числа и ритма сердечных сокращений, общего периферического сопротивления, эластичности артерий.
Частоту и ритм сердечных сокращений определяют при пальпации лучевой артерии, оценку свойств пульса (наполнение, напряжение, контур) проводят при пальпации плечевой или сонной артерии.
В норме ощущают одну волну с быстрым подъёмом.
Выделяют несколько вариантов патологически изменённого пульса:
- пульс с замедленным подъёмом и уменьшенной амплитудой наблюдают при аортальном стенозе
- быстрый пульс с повышенным наполнением («скачущий») характерен для аортальной недостаточности, коарктации аорты, гиперкинетического типа кровообращения
- быстрый отрывистый пульс без увеличения амплитуды наблюдают при митральной недостаточности, дефекте межжелудочковой перегородки
- бисферический пульс (раздвоение вершины пульсовой волны) встречают при сочетании выраженной аортальной недостаточности с умеренным стенозом устья аорты или при ГКМП
- дефицит пульса - разница пульса, выявляемая при одновременном определении ЧСС во время аускультации сердца и частоты пульса при пальпации лучевой артерии, признак, характерный для фибрилляции предсердий.
К пальпации пульса на артериях стопы прибегают для выявления заболеваний периферических артерий. Обычно пальпируют артерию тыла стопы (на передней поверхности стопы латеральнее сухожилия длинного разгибателя большого пальца стопы) и заднюю большеберцовую артерию (позади медиальной лодыжки).
По результатам осмотра вен шеи оценивают работу правых отделов сердца. Мышцы шеи больного должны быть полностью расслаблены, голова повёрнута в правую сторону и находится под углом 30-45°. Расширение внутренней яремной вены регистрируют при правожелудочковой сердечной недостаточности, констриктивном перикардите, сдавлении верхней полой вены. Характерную картину наблюдают при недостаточности трикуспидального клапана: увеличение второй положительной волны венозного пульса, которая следует почти одновременно с пульсацией сонной артерии и не исчезает при натяжении кожи шеи.
Верхушечный толчок пальпируют ладонью руки, наложенной на грудную клетку слева от грудины основанием к ней. Положение верхушечного толчка - наиболее левая и нижняя точка зоны, где ощущают пульсацию сердца. В норме верхушечный толчок находится в V или VI межреберье слева по срединно-ключичной линии. При гипертрофии левого желудочка ЛЖ продолжительность и сила верхушечного толчка увеличены, при сочетании гипертрофии ЛЖ с дилатацией верхушечный толчок смещён влево и книзу, при митральном стенозе выявляют «стукающий» верхушечный толчок, при гипертрофической кардиомиопатии верхушечный толчок становится двойным.
Парастернальная или эпигастральная пульсация при пальпации передней грудной стенки свидетельствует о гипертрофии правого желудочка.
АУСКУЛЬТАЦИЯ СЕРДЦА
Аускультация сердца - важнейшая часть физикальной диагностики. Во время аускультации оценивают тоны сердца и выявляют сердечные шумы.
Оценка громкости и характеристика тонов сердца.
Первый тон S1(I) (от английского sound) лучше оценивать на верхушке сердца:
- S1(I) усилен при гиперкинетическом состоянии кровообращения (лихорадка, физические нагрузки), митральном стенозе
- S1(I) ослаблен при снижении сердечного выброса (сердечная недостаточность), тахикардии, недостаточности митрального клапана.
Второй тон S2(II) громче слышен на основании сердца.
- расщепление (удлинение) S2(II) выслушивают в норме на вдохе во II-III межреберье слева от грудины. Если расщепление сохраняется и на выдохе, то можно думать о полной блокаде правой ножки пучка Гиса или стенозе клапана лёгочной артерии. Парадоксальное расщепление (только на выдохе) наблюдают при полной блокаде левой ножки пучка Гиса или стенозе устья аорты
- усиление аортального компонента S2(II) отмечают при артериальной гипертензии и дилатации корня аорты
- усиление лёгочного компонента S2(II) отмечают при лёгочной гипертензии.
Третий тон S3 выслушивают в норме у детей, после 30лет его наличие указывает на ЛЖ недостаточность или перегрузку объёмом. Он более отчётливо выслушивается на верхушке, если больной лежит на левом боку.
Четвёртый тон S4 отражает сокращение предсердий при нарушенной функции ЛЖ и встречается при аортальном стенозе, артериальной гипертензии, гипертрофической кардиомиопатии.
Щелчок открытия митрального клапана - громкий, щёлкающий и высокочастотный протодиастолический добавочный тон, возникающий в результате открытия стенозированного митрального клапана. Он слышен у левой границы грудины в нижней части, усиливается при сильном надавливании мембраной стетоскопа на грудную клетку. Щелчок открытия в отсутствие кальцификации клапана выявляется у 75% больных и свидетельствует о лёгкой форме заболевания.
Оценка сердечных шумов.
Сердечные шумы, которые выслушиваются между I и II тоном, называются систолическими. Существует 2 вида систолических шумов - шумы изгнания и шумы недостаточности (регургитации). Шумы изгнания слышны в ранней или средней фазе систолы, шумы недостаточности слышны на протяжении всей систолы и переходят в S2(II).
Шумы, выслушиваемые между II и I тонами, называются диастолическими.
Постоянный шум продолжается без всякого перерыва в течение всего сердечного цикла, наиболее частая причина такого шума - открытый аортальный проток.
Одной из важнейших задач кардиолога является дифференциация функциональных шумов от органических. Для этого необходимо полноценное исследование сердечно-сосудистой системы.
Чтобы облегчить разделение шумов на функциональные и органические, применяют следующие правила (Mangione S., 2001):
- о шумах судят, как о людях, по компании, в которой они находятся - при наличии дополнительных тонов сердца и патологических изменений на ЭКГ больше вероятность того, что шум патологический; ослабленный или отсутствующий II тон - свидетельство изменения подвижности полулунных клапанов в результате их поражения
- патологическими являются все диастолические шумы, все пансистолические и позднесистолические шумы, все непрерывные шумы.
Аускультативная картина наиболее распространённых пороков сердца приведена в табл. 1.
Таблица 1. Аускультативная картина пороков сердца.
|
|
Характеристика шума и точки
выслушивания |
Иррадиация |
Приемы, для усиления шума |
|
Недостаточность трикуспидального клапана |
Систолический шум дующий в нижней части левого края грудины |
В нижнюю часть правого края грудины, эпигастрий |
Положение лежа, положение на корточках, вдох, изометрическая нагрузка |
|
Стеноз легочной артерии |
Систолический шум в верхней части левого края грудины |
В левую ключицу. под левую лопатку |
Нет |
|
Недостаточность митрального клапана |
Пансистолический шум дующий на верхушке сердца |
В левую подмышечную область |
Положение лежа, положение на корточках, выдох, динамическая нагрузка, изометрическая нагрузка |
|
Недостаточность аортального клапана |
Ранний диастолический шум дующий в III-IV межреберье слева от грудины, часто поздний диастолический шум Флинта на верхушке сердца |
На верхушку сердца |
Положение на корточках, наклон вперед, изометрическая нагрузка |
|
Стеноз аортального клапана |
Систолический шум грубый в верхней части правого края грудины |
На сонные артерии, верхушку сердца |
Положение на корточках, динамическая нагрузка |
|
Стеноз митрального клапана |
Диастолический шум с пресистолическим усилением на верхушке сердца |
Нет |
Динамическая нагрузка, изометрическая нагрузка |
|
Дефект межжелудочковой перегородки |
Пансистолический шум грубый, громкий во II-III межреберье по левому краю грудины |
В прекардиальную область |
Положение на корточках, физическая нагрузка |
Для выявления и распознавания шумов сердца применяют динамическую аускультацию (использование различных приёмов для акцентуации тех или иных шумов):
- дыхательные манёвры. Вдох усиливает все шумы и тоны, происходящие из правых отделов сердца, поэтому шумы при пороках трикуспидального и лёгочного клапанов выслушиваются на глубоком вдохе. Шумы и тоны сердца, происходящие из левых отделов сердца, наоборот, выслушиваются на выдохе. Проба Вальсальвы. Пациента просят выдохнуть и натужиться, аускультацию проводят непосредственно во время натуживания и сразу после него. При выполнении пробы объём ЛЖ уменьшается, а шумы пролапса митрального клапана, а также шумы, связанные с гипертрофической кардиомиопатией, усиливаются.
- изменение положения тела. В положении на корточках усиливаются шумы аортальной и митральной недостаточности, ослабевают шумы митрального пролапса и гипертрофической кардиомиопатии.
Показания к проведению и интерпретация результатов основных инструментальных исследований приведены в соответствующих разделах.
СИНДРОМЫ
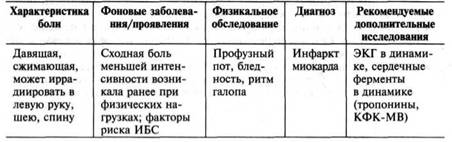
БОЛЬ В ГРУДНОЙ КЛЕТКЕ
Основные причины болей в сердце:
- сердечные
инфаркт миокарда*
стабильная стенокардия
нестабильная стенокардия
перикардит*
расслаивающая аневризма аорты*
синдром фиксированного сердечного выброса (аортальный стеноз)
- лёгочные
ТЭЛА*
плеврит
пневмоторакс*
пневмония
опухоль лёгкого
- желудочно-кишечные
рефлюкс-эзофагит
спазм пищевода
разрыв пищевода*
грыжа пищеводного отверстия диафрагмы
язвенная болезнь
панкреатит
жёлчная колика
- заболевания грудной стенки
костохондрит
перелом ребра
- корешковые боли
шейный остеохондроз
межрёберная невралгия
опоясывающий герпес
- психогения
- тревожные расстройства
- депрессивные расстройства.
*состоянии, требующие немедленной госпитализации пациента.
Характеристика болей при других наиболее распространённых причинах.
При стенокардии характерно:
- связь боли с физической нагрузкой, при прекращении нагрузки боль исчезает
- боль может провоцироваться обильной едой, пребыванием на холоде или другими факторами, увеличивающими частоту сердечных сокращений
- локализация - при просьбе показать место боли пациент демонстрирует классический симптом Ливайна (кулак или ладонь кладётся поверх грудины или поперёк передней грудной стенки)
- длительность 2-5мин
- характер давящий или сжимающий (однако следует помнить, что боли любого характера могут оказаться ангинозными)
- иррадиация в руку (чаще вдоль медиальной стороны предплечья вниз к мизинцу), шею или нижнюю челюсть
- боль купируется нитроглицерином.
Инфаркт миокарда. Боль имеет ту же локализацию, что и возникавшие ранее у данного пациента приступы стабильной стенокардии, или располагается ниже, но занимает большую площадь. Боли сопровождаются повышенным потоотделением, предобморочным состоянием, иногда тошнотой или рвотой. Иногда восприятие боли снижено, пациент может лишь чувствовать необычную слабость.
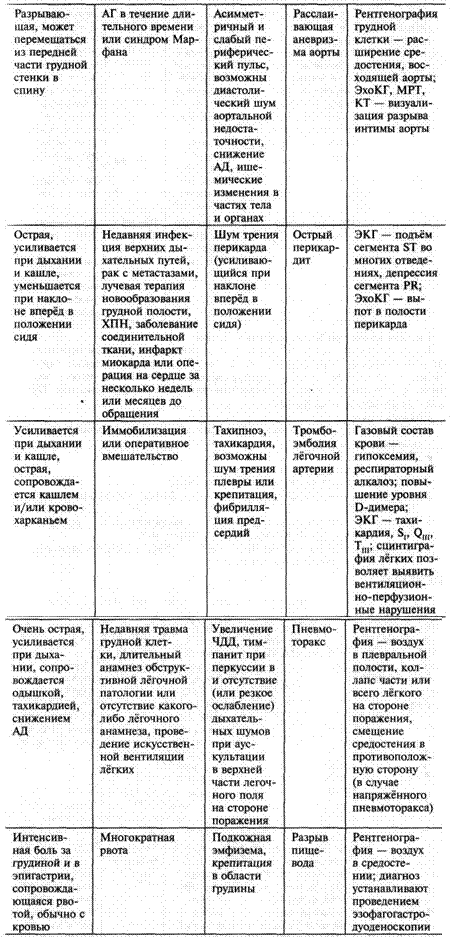
Перикардит. Боли усиливаются в горизонтальном положении или на вдохе, при поднимании ног, глотании или разгибании шеи, ослабевают при наклоне вперёд. Боли могут иррадиировать по ходу диафрагмального нерва в левую часть шеи, левые лопатку и плечо.
Расслаивающая аневризма аорты. Наибольшая интенсивность боли отмечается в момент её появления. Боль может иррадиировать в живот, ноги, перемещаться в спину. Боль носит разрывающий или раздирающий характер, нередко пульсирует синхронно с сердечными сокращениями. Иногда фоном для развития расслаивающей аневризмы служит болезнь Марфана.
Поражения клапанов сердца (аортальный стеноз) или гипертрофическая кардиомиопатия. Могут наблюдаться типичные стенокардитические боли вследствие обструкции выносящего тракта левого желудочка и увеличения миокардиального напряжения. При аускультации обычно выслушивают продолжительный систолический шум на основании сердца. При аортальном стенозе шум обычно распространяется на сосуды шеи, сопровождается ослаблением и замедлением нарастания пульсовой волны на сонных артериях и резким ослаблением или отсутствием II тона во втором межреберье справа от грудины.
Плеврит. Боль усиливается при глубоком дыхании и кашле, может сопровождаться кашлем и повышением температуры тела в связи с лёгочной инфекцией.
Тромбоэмболия лёгочной артерии. Выраженная боль в центре грудной клетки или при глубоком дыхании в боковых отделах, связана с остро возникшей одышкой. Пациент испытывает беспокойство, отмечает потливость. Следует помнить факторы риска ТЭЛА: длительный период соблюдения строгого постельного режима, иммобилизация конечности, хирургическая операция.
Пневмоторакс. Боль связана с остро возникшей одышкой, локализована в боковых отделах грудной клетки. Заболевание развивается спонтанно или на фоне бронхиальной астмы, эмфиземы лёгких, туберкулёза, муковисцидоза, саркоидоза, тупой или проникающей травмы грудной клетки.
Пневмония. Характерны боли, связанные с дыханием, одышка, лихорадка с ознобом, кашель, сухой или с мокротой.
Заболевания грудной стенки. Воспаление грудинно-рёберных сочленений (костохондрит, синдром Титце) - нередкое заболевание. Боль обычно умеренной интенсивности, больной может точно указать пальцем место болезненности, которое чаще всего находится на уровне 2-3 рёберно-грудинного сочленения. Боль длится от нескольких секунд до нескольких часов, не связана с движениями. Отмечают местную болезненность при надавливании на соответствующие участки грудной клетки. Боли уменьшаются на фоне приёма салицилатов.
Корешковые боли. При грыже межпозвоночного диска в шейном отделе боль может иррадиировать по ходу лучевого нерва. Боли усиливаются во время ходьбы, при движениях руками или головой.
Рефлюкс-эзофагит или спазм пищевода. Боли при спазме пищевода могут имитировать стенокардию и иррадиировать из верхней части эпигастрия в загрудинную область, верхнюю часть грудной клетки, верхние конечности. Приём нитроглицерина приносит быстрое облегчение, как при стенокардии. Диагностике в данном случае помогает, если удаётся доказать отсутствие стенокардии напряжения и выявить связь с приёмом пищи. Боль при рефлюкс-эзофагите длится от нескольких минут до нескольких часов, редко бывает очень сильной, обычно не связана с профузным потоотделением или одышкой, часто сопровождается изжогой. Боль усиливается в положении лёжа на спине или при наклоне, уменьшается при приёме антацидов или после горячего питья, в положении сидя.
Боли психогенного характера локализуются в области верхушки сердца и бывают двух типов: острыми кратковременными, «прокалывающими», не позволяющими сделать вдох или длительными ноющими, иногда почти постоянными, не связанными с физической нагрузкой.
Кардиолог должен уметь прежде всего выделить и провести дифференциальную диагностику потенциально жизнеугрожающих заболеваний.
Таблица 2. Дифференциальная диагностика опасных для жизни заболеваний, проявляющихся болью в грудной клетке
ТАКТИКА ВРАЧА ПРИ БОЛЯХ В ГРУДНОЙ КЛЕТКЕ
После исключения угрожающих жизни заболеваний (объём необходимых диагностических мероприятий см. выше) и тщательной оценки характера болевого синдрома, а также сопутствующих заболеваний может возникнуть необходимость в проведении дополнительных исследований. Проводят следующие исследования.
Обязательные:
- общий анализ крови (при пневмонии или инфаркте миокарда может повышаться СОЭ)
- ЭКГ
- рентгенография грудной клетки.
В зависимости от предполагаемого диагноза:
- для исключения сердечной патологии 24-часовое мониторирование ЭКГ, эхоКГ
- при подозрении на наличие патологии позвоночника рентгенография шейного и грудного отделов позвоночника
- при подозрении на заболевание ЖКТ эзофагогастродуоденоскопия, амбулаторная рН-метрия пищевода.
ЛЕЧЕНИЕ
Следует особо отметить, что универсального средства для устранения боли в грудной клетке нет.
План лечения зависит от причины боли. В неотложных ситуациях исход напрямую зависит от оперативности в начале лечебных мероприятий и их адекватности.
При связи болей в грудной клетке с едой до выяснения причины допустимо применение антацидов.
При первичной фибромиалгии (миофасциальном болевом синдроме) можно применять нестероидные противовоспалительные препараты (НПВС), но они, как правило, оказываются малоэффективными, антидепрессанты, а также местное введение анестетиков в болевые точки, например, 1-2 мл 1% раствора лидокаина, можно вместе с 40 мг гидрокортизона. Находят точки максимальной болезненности (уплотнения), вводят тонкой иглой раствор анестетика в центр уплотнения, а затем производят его обкалывание. Эффект нестойкий.
ОБУЧЕНИЕ БОЛЬНЫХ
Больных с ИБС следует знакомить с проявлениями острого коронарного синдрома, чтобы они своевременно обращались за квалифицированной медицинской помощью. Больные гастроэзофагеальной рефлюксной болезнью должны быть ознакомлены с особенностями режима (дробное питание, не ложиться после еды, исключение курения, спиртных напитков, кофе, острых блюд, борьба с ожирением и пр.).
ПРОГНОЗ
Прогноз во многом зависит от причины болезни. Наиболее благоприятный прогноз у лиц с функциональными расстройствами (смертельный исход исключён). Серьёзный прогноз при органических поражениях, особенно сопровождающихся неотложными состояниями (смертность при остром коронарном синдроме составляет 5-15% в течение первого года).
ОДЫШКА
В случае неотложной ситуации при наличии одышки у больного, в первую очередь, необходимо исключить инородное тело в дыхательных путях и анафилаксию. При проведении первичного осмотра нужно также диагностировать спонтанный пневмоторакс, отёк лёгких и бронхообструктивный синдром.
Наиболее вероятные причины одышки:
- бронхиальная астма
- сердечная недостаточность
- ХОБЛ
- ожирение.
Заболевания сердечно-сосудистой системы, сопровождающиеся астмой:
- острая сердечная недостаточность (при инфаркте миокарда)
- ТЭЛА
- расслаивающая аневризма аорты
- миокардиты, кардиомиопатия
- тампонада сердца.
Инфекции, сопровождающиеся астмой:
- пневмония
- острый эпиглотит (у детей).
Болезни органов дыхания, сопровождающиеся астмой:
- обструкция верхних дыхательных путей инородным телом
- пневмоторакс
- ателектаз лёгкого.
Нервные болезни, сопровождающиеся астмой:
- синдром Гийена-Барре
- полиомиелит.
По длительности и характеру возникновения выделяют несколько разновидностей одышки.
Остро возникшая одышка:
- инородное тело в дыхательных путях. Могут быть слышны сухие хрипы на вдохе
- анафилаксия. Одышка развивается остро после парентерального введения лекарственных средств (ЛС), вакцинации, ужаления или укуса насекомого. Характерны сухие хрипы на выдохе (бронхообструктивный синдром)
- спонтанный пневмоторакс. Появление одышки часто сопровождается болью. Дыхание ослаблено. Заболевание чаще всего возникает у курильщиков и больных ХОБЛ
- ТЭЛА. Одышка появляется внезапно, часто сопровождается болью в груди и кашлем. Массивная ТЭЛА вызывает шок и гипоксию. Аускультативная картина разнообразна, дыхательные шумы могут быть нормальными, возможно появление сухих или влажных хрипов
- острый отёк лёгких. Обычно можно выслушать застойные влажные хрипы. При кашле выделяется пенистая мокрота. Набухают шейные вены. У больного в анамнезе обычно есть указание на сердечную недостаточность
- инфаркт или ишемия миокарда, расслаивающая аневризма аорты. Ведущий симптом - боль в груди
- аритмии. Одышка нередко появляется во время приступов фибрилляции предсердий или других суправентрикулярных тахикардии
- отравление угарным газом
- гипервентиляционный синдром или панические расстройства. Обычно страдают лица молодого возраста. Больной испытывает чувство нехватки воздуха, парестезии в руках и головокружение. При аускультации лёгких изменений не находят. Такое состояние часто связано с пребыванием в душном помещении, в закрытом пространстве (в транспорте, лифте и т.п.).
Одышка, продолжающаяся от одного дня до нескольких недель:
- обострение бронхиальной астмы или ХОБЛ. Выслушиваются сухие хрипы на выдохе. Причиной обострения часто выступает инфекция дыхательных путей (ОРВИ, синусит., фарингит, бронхит)
- ателектазы. Могут возникать при раке лёгкого или пневмонии, часто наблюдаются при инородных телах, длительно находящихся в дыхательных путях
- аллергический альвеолит («лёгкое фермера» и др.). Лихорадка и одышка возникают после работы с сеном, зерном, комбикормами или другим органическим субстратом. При аускультации можно выслушать крепитацию
- плевральный выпот. Дыхание в базальные отделы лёгких не проводится, соответственно при перкуссии выявляют притупление
- ТЭЛА. Характерно развитие заболевания при наличии тромбоза глубоких вен нижних конечностей и таза. Иногда возникает в молодом возрасте (например, при использовании пероральных контрацептивов, антифосфолипидном синдроме). При осмотре одышка и тахикардия.
Одышка, развивающаяся в течение нескольких месяцев или лет:
- хроническая сердечная недостаточность по левожелудочковому типу
- обструктивные заболевания лёгких (бронхиальная астма, ХОБЛ)
- заболевания, приводящие к фиброзу лёгких (фиброзирующий и другие альвеолиты, саркоидоз)
- врождённые и приобретённые тяжёлые деформации грудной клетки (анкилозирующий спондилит, кифосколиоз)
- ожирение
- нейромышечные заболевания (рассеянный склероз, боковой амиотрофический склероз)
- анемии.
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
Больного осматривают раздетым до пояса. Обращают внимание на состояние сознания, наличие цианоза, деформации пальцев в виде «барабанных палочек», одышку в покое, участие в дыхании вспомогательных мышц, западение или выбухание межрёберных промежутков, деформацию рёбер и грудины. При гипоксии, а также при тиреотоксикозе наблюдают тремор. Обращают внимание на набухание шейных вен, наличие отёков, изменение вен нижних конечностей. Важна оценка психического статуса: гипервентиляционный синдром сопровождается полуобморочным состоянием, сердцебиением, зевотой, парестезиями в руках и ногах, ощущением невозможности сделать глубокий вдох. Аускультация более информативна, когда больной дышит открытым ртом (при этом лучше слышны побочные шумы). Пальпируя живот, обращают внимание на увеличение печени. Всегда необходимо проводить пальпацию щитовидной железы.
ЛАБОРАТОРНЫЕ И ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Обязательные исследования:
- ЭКГ
- рентгенография органов грудной клетки (возможны признаки пневмоторакса, ателектаза, пневмонии)
- исследование функции внешнего дыхания (возможны нарушения по обструктивному или рестриктивному типу)
- пульс-оксиметрия (определение степени насыщения гемоглобина кислородом)
- общий анализ крови (гемоглобин).
Дополнительные исследования (выполняются выборочно, в зависимости от ситуации):
- определение D-димера (при подозрении на ТЭЛА)
- ЭхоКГ (выявление клапанных пороков, жидкости в полости перикарда, аневризмы, кардиомиопатии)
- фибробронхоскопия (при подозрении на наличие инородного тела или опухоли бронха)
- трансбронхиальная биопсия (подозрение на экзогенный фиброзирующий альвеолит, саркоидоз, периферический рак лёгкого и пр.)
- трийодтиронин (Т3), тироксин (Т4), тиреотропный гормон (ТТГ) (при обнаружении экзофтальма, гиперплазии щитовидной железы).
ДИФФЕРЕНЦИАЛЬНО-ДИАГНОСТИЧЕСКИЕ МЕРОПРИЯТИЯ
Первый этап. Неотложные мероприятия по диагностике и лечению угрожающих жизни состояний см. выше.
Второй этап. Проводят дифференциальную диагностику одышки при сердечно-сосудистых заболеваниях и болезнях органов дыхания как наиболее частых и опасных причинах развития одышки (табл. 3).
Таблица 3. Сравнительная характеристика одышки при болезнях органов дыхания и ССС

Инструментальные исследования. Во всех случаях выполняют рентгенографию органов грудной клетки и определение функции внешнего дыхания, ЭКГ, общий анализ крови. Далее с учётом предварительно собранных анамнестических и физикальных данных возможно построение следующих диагностических концепций.
Экспираторная одышка приступообразного характера, аллергия в анамнезе, обструктивные нарушения функции внешнего дыхания, положительная проба с бронходилататорами, отсутствие грубых изменений на рентгенограмме органов грудной клетки - бронхиальная астма.
Экспираторная одышка при физической нагрузке, курение, обструктивные прогрессирующие нарушения функции внешнего дыхания, нечёткое улучшение показателей при пробе с бронхолитиком - ХОБЛ.
Инспираторная одышка, интоксикационный и лихорадочный синдромы, инфильтративные изменения на рентгенограмме органов грудной клетки - пневмония.
Инспираторная одышка, мелкоочаговые инфильтративные изменения в лёгких требуют дополнительного диагностического поиска. В распознавании экзогенного аллергического альвеолита важно исследование диффузионной способности лёгких (повышена). Для диагностики туберкулёза имеют значение рентгенография грудной клетки, бактериологическое исследование мокроты, туберкулиновые пробы. Для верификации саркоидоза проводят трансбронхиальную биопсию.
Следует иметь в виду, что среди причин пневмосклероза - многие ЛС (циклофосфан, метотрексат, амиодарон, сульфасалазин, пеницилламин, нитрофурантоин, препараты золота).
Инспираторная одышка, выявление сердечных шумов при аускультации свидетельствуют о необходимости проведения эхоКГ (клапанные пороки, зоны дис- и гипокинезии при ИБС, уменьшение фракции выброса).
Третий этап. Если к этому моменту не удалось обнаружить патологию ССС или лёгких, следует иметь в виду другие причины.
Одышку можно связать с анемией, если уровень гемоглобина ниже 80г/л; в противном случае следует искать другую причину.
Одышка у больных сахарным диабетом может быть обусловлена не только сопутствующей сердечно-сосудистой патологией, но и кетоацидозом. Важен контроль сахара в крови, ацетона в моче.
Одышка, быстрая утомляемость, раздражительность, похудание могут быть следствием тиреотоксикоза. Требуется определение концентрации Т3 и Т4 (повышены), ТТГ (снижена).
Одышка при психических нарушениях сопряжена с тревожностью. Одышку иногда удаётся спровоцировать пробой с гипервентиляцией за 15-30с.
СИНКОПАЛЬНЫЕ СОСТОЯНИЯ (ОБМОРОК)
Обморок - внезапная непродолжительная потеря сознания. Термин «синкопе» часто используют как синоним термина «обморок». В основе обморока всегда лежит кратковременное снижение или прекращение мозгового кровотока.
Неврологические причины:
- вазовагальный обморок (простой обморок) наблюдают наиболее часто. Возникает при переходе в вертикальное положение, боли, испуге и других неприятных эмоциях, а также при виде крови, при тошноте и рвоте, мочеиспускании, кашле. Ранние проявления (предобморочный период): беспокойство, слабость, зевота, бледность, потливость, потемнение в глазах. Первая помощь - перевод в горизонтальное положение с поднятыми ногами. Необходимо контролировать пульс и дыхание. При вагусном обмороке пульс замедленный и слабый, поэтому подобный обморок легко можно спутать с асистолией. Кожа влажная и бледная. Сознание восстанавливается быстро и полностью. С приходом в сознание больной испуган
- ишемия в вертебробазилярном бассейне - обмороки развиваются без предвестников, для послеобморочного состояния характерны головные боли, боли в шее, преходящая неврологическая симптоматика. На основании клинической картины можно ориентировочно определить поражённую артерию: при нарушении кровотока по сонной артерии может отмечаться кратковременный амавроз и/или гемипарез на стороне поражения; синкопе от сдавления вертебральных артерий или каротидное синкопальное состояние развивается при резком запрокидывании головы; при стенозировании подключичной артерии обморок возникает вследствие синдрома обкрадывания при работе рукой на стороне поражения
- большие эпилептические припадки характеризуются сочетанием потери сознания и судорог с предшествующей зрительной, обонятельной, вкусовой или чувствительной аурой, а также с угнетением сознания после приступа. Малые эпилептические припадки чаще развиваются внезапно, протекают с кратковременной потерей сознания, нередко с сохранённым мышечным тонусом
Во многих случаях дифференциальная диагностика пароксизмальных клинических проявлений может потребовать направления в соответствующие специализированные отделения: к неврологу (эпилепсия, ТИА); к ЛОР-врачу (головокружение вестибулярного происхождения); к психиатру (тяжёлые панические атаки).
Кардиогенные обмороки.
Важно выяснить причину, так как без точного диагноза и этиотропной терапии прогноз может быть неблагоприятным. Основные причины - аритмии и заболевания, сопровождающиеся сопротивлением сердечному выбросу.
Наиболее частые причины:
- желудочковая тахикардия
- АВ-блокада
- синдром WPW
- пароксизмальная суправентрикулярная тахикардия
- ФП может вызывать обмороки у больных пожилого возраста
- особое значение придают желудочковой тахикардии типа «пируэт» (torsade depointes), возникающей при удлинённом интервале Q-T. К моменту обследования пароксизмы часто купируются, и больного можно посчитать невротизированной личностью, легко падающей в обморок, хотя он подвергается риску внезапной сердечной смерти. Синдром удлинённого интервала Q-Т может быть врождённым или возникать вследствие лекарственной терапии (см. ниже)
- существует правило - обморок, возникший во время физической нагрузки, связан с патологией сердца. Примерами могут служить стеноз устья аорты и гипертрофическая обструктивная кардиомиопатия. Если при аортальном стенозе возникают обмороки, это означает, что порок угрожает жизни больного и необходима экстренная операция
- для шаровидного тромба левого предсердия характерно развитие обмороков в момент изменения положения тела (когда больной встаёт или садится). Перед развитием обморока появляются одышка и цианоз верхней половины туловища
- другие причины - ТЭЛА, тампонада сердца, миксома левого предсердия, раздражение каротидного синуса.
Обмороки вследствие приёма ЛС:
- чаще того провоцирует обмороки нитроглицерин. Им злоупотребляют при разных видах «острых приступов» и даже в предобморочном состоянии
- хинидин, соталол, амиодарон (в обычных дозах) и производные фенотиазина (в больших дозировках), применяемые для монотерапии у больных с поражением проводящей системы или врождённым удлинением интервала Q-T. Указанные препараты удлиняют интервал Q-T, что может принести к тахикардии типа «пируэт» и развитию обморока
- б-адреноблокаторы могут вызывать брадикардию или АВ-блокаду у больных с предшествующим поражением проводящей системы сердца
- диурпики, фенотиазины, леводопа, избыточные дозы антигипертензивных препаратов, вазодилататоров и комбинации этих препаратов вызывают ортостатическую артериальную гипотензию.
Гиповолемия:
- острое желудочное кровотечение может проявляться низким АД и обмороком
- избыточные дозы диуретиков. Их комбинация с ингибиторами АПФ и другими вазодилататорами также снижает АД. Одновременно у больного может быть поражение миокарда с низкой фракцией выброса
- потеря жидкости при потоотделении, рвоте и диарее.
Нарушеня обмена в-в:
- гипогликемия - частая причина потери сознания
- сепсис может проявляться низким АД и обмороком
- низкое АД может возникать при болезни Аддисона
- автономная диабетическая невропатия проявляется ортостатической гипотензией без обычного увеличения чсс.
Ортостатический коллапс:
- длительный постельный режим
- лихорадка и дегидратация различного происхождения
- лекарства: диуретики, вазодилататоры, нитраты, фенотиазины и т.д.
Обмороки неясной этиологии:
- психогенные, необходимо наличие других психических симптомов
- при единичных эпизодах потери сознания после проведения рутинных исследований причину обморока часто определить не удаётся. В таких случаях причиной, вероятно, выступают вазовагальные нарушения, и если функции сердца не нарушены, прогноз благоприятен.
ДИАГНОСТИЧЕСКИЕ «КЛЮЧИ»
- опасные признаки - боль в грудной клетке, одышка, пароксизмальная тахикардия более 160 в минуту, брадикардия менее 40 в минуту, артериальная гипотензия, сохраняющаяся в горизонтальном положении тела, головная боль и другие неврологические признаки
- история развития заболевания важна при дифференцировании обмороков кардиогенного и неврогенного происхождения
- обмороки у молодых здоровых людей обычно доброкачественные, особенно если они возникают под воздействием неприятных ситуаций или эмоций. Обмороки во время или после физической нагрузки опасны, даже у молодых людей. У лиц, «подверженных обморокам», нередко обнаруживают наследственный синдром удлинённого интервала Q-Т и гипертрофическую обструктивную кардиомиопатию
- чем старше пациент, тем больше вероятность серьёзного заболевания в основе обморочных состояний
- обследование необходимо направить на выявление патологии сердца. Есть правило - «первый обморок у мужчины старше 55 лет может быть последним в его жизни»
- в анамнезе может быть упоминание об ощущении «перебоев» в сердце, предшествующем обмороку. Если продолжительность этих эпизодов меньше 5 с, они служат предвестниками обморока, связанного с тяжёлой патологией сердца
- аура и судороги характерны для эпилепсии. Однако мышечные подёргивания и кратковременные судороги могут возникать вследствие временной ишемии головного мозга, обусловленной патологией сердца
- обмороки во время физической нагрузки или вскоре после неё - классический признак обмороков кардиогенного происхождения (стеноз устья аорты, желудочковая тахикардия, ишемия)
- обмороки при заболеваниях сердца следует расценивать как серьёзные, если они не связаны с ортостатической гипотензией вследствие лекарственной терапии или длительного постельного режима
- приступы, развившиеся ночью в положении лёжа, дают основание заподозрить эпилепсию
- при повторных приступах нередко необходимо углублённое обследование.
КЛИНИЧЕСКАЯ ОЦЕНКА
- АД и чсс. Измерение АД после перехода в вертикальное положение позволяет выявить ортостатическую гипотензию
- в диагностике желудочно-кишечного кровотечения помогает пальцевое ректальное исследование.
НАИБОЛЕЕ ВАЖНЫЕ ДИАГНОСТИЧЕСКИЕ МЕРОПРИЯТИЯ
- тщательный сбор анамнеза заболевания и объективное обследование в большинстве случаев позволяют выявить причину заболевания
- общий анализ крови (уровень гемоглобина, гематокрита)
- рентгенография органов грудной клетки. Показана в большинстве случаев. Чаще всего специфических изменений не находят (например, при бронхиальной астме, ТЭЛА, ларинготрахеите, бронхите, гипервентиляционном синдроме, анемии)
- ЭКГ, при подозрении на аритмическую природу состояния - суточное мониторирование ЭКГ. При наличии изменений на ЭКГ - МВ-фракция КФК, тропонин Т сыворотки крови
- глюкоза крови
- при частых кардиоингибиторных или смешанных вазовагальных синкопе, резистентных к лекарственной терапии, следует рассмотреть вопрос об имплантации кардиостимулятора.
ОРТОСТАТИЧЕСКИЕ СИНКОПЕ
Чаще всего применяют флудрокортизон (0,1-1мг/сут) в сочетании с увеличением количества натрия хлорида в суточном рационе (необходим контроль АД). Следует помнить, что длительная терапия минералокортикоидами плохо переносится и её эффективность с течением времени постепенно снижается (необходимо увеличение дозировки). При неэффективности флудрокортизона или его плохой переносимости назначают мидодрин (2,5-10мг 3 раза в день).
СИНОКАРОТИДНЫЕ СИНКОПЕ
При наличии выраженной вазодепрессорной реакции в пробе с массажем каротидного синуса возможно применение вазоконстрикторных препаратов (например, мидодрина), хотя в целом лекарственная терапия малоэффективна. При выраженной кардиоингибиторной реакции рассматривают вопрос об имплантации кардиостимулятора.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
При простом вазовагальном обмороке необходимости в стационарном обследовании и лечении нет.
Госпитализация показана в следующих случаях:
- синкопе на фоне умеренной или выраженной ортостатической гипотензии
- синкопе, возникающие при физической нагрузке или после неё
- при подозрении на кардиологические или неврологические заболевания
- частые синкопе
- возраст пациента старше 70лет.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Хирургическое лечение необходимо при подключичном синдроме обкрадывания (ангиопластика, каротидно-подключичное шунтирование, устранение сдавления сосуда извне).
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ
Активное наблюдение при вазовагальных синкопе необходимо при рецидивирующих обмороках и в случае, если пациент получает активную лекарственную терапию (контроль эффективности терапии и побочных эффектов). При единичном вазовагальном обмороке необходимости в активном наблюдении за пациентом нет.
ОБУЧЕНИЕ ПАЦИЕНТ
Пациента с вазовагальными и ортостатическими синкопе следует обучить приёмам, которые позволяют предотвращать развитие обморока.
За 10-15мин до воздействия факторов, которые провоцируют обморок, рекомендуют выпить большое количество жидкости (0,5л).
При появлении первых продромальных симптомов обморока рекомендуют как можно быстрее принять горизонтальное положение тела.
- симптом Хоманса: боль в голени при быстром пассивном тыльном сгибании стопы
- симптом Ловенберга: боль при сдавлении голени манжетой аппарата для измерения АД при нагнетании давления в манжете до 80-100мм.рт.ст., в то время как сдавление здоровой голени до 150-180мм рт.ст. не вызывает неприятных ощущений.
ЛАБОРАТОРНОЕ ИССЛЕДОВАНИЕ
Уровень D-димера при тромбозе глубоких вен, осложнённом ТЭЛА, может превышать 500мкг/мл. Это повышение даёт основание для назначения антикоагулянтной терапии.
ИНСТРУМЕНТАЛЬНОЕ ИССЛЕДОВАНИЕ
- дуплексное ультразвуковое ангиосканирование с использованием цветного допплеровского картирования - метод выбора в диагностике тромбоза ниже уровня паховой связки. Основной признак тромбоза - обнаружение эхопозитивных тромботических масс в просвете сосуда
- если УЗИ не выявило тромбов, его повторяют с интервалом в 2-3дня или проводят венографию.
Подозрение на тромбоз глубоких вен голени служит показанием для экстренной госпитализации, поскольку это заболевание нередко осложняется ТЭЛА.
НЕОТЛОЖНОЕ ЛЕЧЕНИЕ
Режим постельный.
Антикоагулянты:
- низкомолекулярные гепарины: эноксапарин натрий по 1мг/г п/к каждые 12ч до начала действия непрямых антикоагулянтов, лабораторного контроля не требуется
- нефракционированный гепарин: стартовое введение болюсом 80ЕД/кг, затем по 18ЕД/кг/ч, контроль за АЧТВ, уровнем тромбоцитов
- варфарин по 5 мг/сут, контроль MHO (целевой уровень - 2-3). Терапию непрямыми антикоагулянтами начинают одновременно с гепарином, продолжают в течение 6 мес после первого тромбоза и пожизненно после второго.
Оперативное лечение (тромбэктомия) проводят по специальным показаниям (синяя болевая флегмазия).
КЛАССИФИКАЦИЯ
Односторонние отеки нижних конечностей:
- тромбоз глубоких вен
- сдавление вен кистой Бейкера
- потеря тонуса вен в парализованной конечности.
Двусторонние отёки:
- хроническая сердечная недостаточность
- хроническая венозная недостаточность
- ХПН
- лёгочная гипертензия (при ХОБЛ, обструктивном апноэ во сне, митральном стенозе и пр.)
- гипоальбуминемия
- идиопатические отеки.
КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА
Клинически выраженным отёкам соответствуют прибавка массы тела на несколько килограммов и олигурия. Начальные отёки на ногах и пояснице выявляются при пальпации (характерные «ямки» отмечаются при увеличении массы тела не менее чем на 10-15%). Вначале отёки появляются на нижних конечностях.
При хронической сердечной недостаточности отёки появляются чаще к концу дня, особенно при длительном пребывании больного в вертикальном положении. Также возможны затруднения при обувании, особенно в вечернее время, или при надевании кольца на палец руки.
При болезнях почек небольшие отёки появляются прежде всего на лице(в области век) и обычно утром.
Отёки у пожилых людей при длительном пребывании в вертикальном положении при отсутствии сердечной и почечной патологии не имеют большого клинического значения (как и отёки у женщин в жаркое время года).
При нарушении лимфатического оттока отёки локализуются на тыльной стороне стопы, не оставляют «ямок», не исчезают к утру или после придания конечности возвышенного положения.
ЭТИОЛОГИЯ ОТЕКОВ:
- хроническая сердечная недостаточность
- патология почек, сопровождающаяся нефротическим или остронефритическим синдромом
- повышенное венозное давление: недостаточность венозных клапанов, варикозное расширение, сдавление вен извне, тромбоз вен
- гипопротеинемия - недостаточное потребление белка (голодание, неправильное питание), нарушения пищеварения (экзокринная недостаточность поджелудочной железы), недостаточное усвоение белков (резекция значительной части тонкой кишки, поражение стенки тонкой кишки, целиакия и пр.), нарушение синтеза альбуминов (тяжёлые поражения печени), нефротический синдром, потеря белка через кишечник (экссудативные энтеропатии)
- нарушение лимфатического оттока - слоновость при рецидивирующей роже, лимфостаз с отёками верхней конечности при одностороннем удалении подмышечных и грудных лимфатических узлов по поводу рака молочной железы, обструкция лимфатических путей филяриями (филяриатоз), травматический лимфостаз, посттромботическая лимфедема, сочетающая венозную и лимфатическую обструкцию
- аллергические реакции (например, отёк Квинке)
- гипотиреоз - плотный отёк подкожной клетчатки (микседема, или слизистый отёк), обусловленный инфильтрацией мукополисахаридами
- повышение гидростатического давления на фоне приёма некоторых ЛС (например, нифедипина).
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Алгоритм диагностики предполагает первоочередную диагностику неотложных причин отёка.
Первый этап: скорость образования отёка (острый или хронический).
Второй этап. Двусторонним или односторонним является острый отёк? Если отёк односторонний, следует исключить тромбоз глубоких вен голени (подробнее см. выше, в разделе Неотложные мероприятия по диагностике и лечению).
Третий этап. Если отёк хронический односторонний, следует выяснить, оставляет ли он «ямку». Не оставляют «ямку» только лимфатические отёки, они локализуются, как правило, на тыльной стороне стоп, не исчезают в приподнятом положении конечностей. Уровень обструкции визуализируется с помощью лимфографии. Подозрение на лимфостаз служит показанием к консультации ангиохирурга.
Четвёртый этап. Если отёк хронический, односторонний и оставляет «ямку», вероятен отёк венозного происхождения. Проводят физикальное обследование. Выявляют варикозно-изменённые вены. Характерные изменения кожи: индурация, дерматит, язвы. Потеря мышечного тонуса и снижение рефлексов в парализованной конечности сопровождаются снижением тонуса сосудов. Пальпация подколенной ямки позволяет выявить кисту Бейкера как причину компрессии венозных стволов и веностаза. Инструментальные исследования:
- ультразвуковая допплерография для визуализации состояния клапанного аппарата вен, аномального сброса венозной крови
- УЗИ коленного сустава при подозрении на кисту Бейкера.
Пятый этап. При хронических двусторонних отёках возможны хроническая сердечная недостаточность, хроническая венозная недостаточность, лёгочная гипертензия, ХПН, портальная гипертензия, побочное действие ЛС.
АНАМНЕЗ
Исключение приёма ЛС с венодилатирующим эффектом, прежде всего нифедипина.
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Измерение АД: повышение может быть связано с нарушением почечной функции. Желтуха, «барабанные палочки», телеангиэктазии, гинекомастия - симптомы цирроза печени. Хрипы в лёгких при аускультации - проявление бронхообструктивного синдрома, протекающего с лёгочной гипертензией. Цианоз, шумы в сердце могут указывать на хроническую сердечную недостаточность как причину отёков.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
- общий анализ мочи для диагностики степени протеинурии, при положительном результате определяют суточную протеинурию для выявления нефротического синдрома
- сывороточный креатинин - повышен при нарушении функции почек
- сывороточный альбумин - снижен при синдроме печёночно-клеточной недостаточности (одновременно со снижением протромбина), нефротическом синдроме (одновременно с протеинурией).
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
- рентгенография органов грудной клетки: изменение контуров сердца при хронической сердечной недостаточности; плевральный экссудат (при тяжёлой сердечной недостаточности, уремии, выраженной портальной гипертензии)
- ЭКГ: признаки гипертрофии правого предсердия, правого желудочка при лёгочной гипертензии
- эхоКГ: признаки лёгочной гипертензии, признаки систолической или диастолической дисфункции при хронической сердечной недостаточности
- полисомнография показана для верификации обструктивного апноэ при выявлении признаков лёгочно-артериальной гипертензии.
ЛЕЧЕНИЕ
НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Диета: ограничение соли и жидкости.
Режим: исключить длительную ходьбу, длительное стояние, длительное нахождение в сидячем положении.
Полезно время от времени придавать нижним конечностям возвышенное положение. Компрессионный трикотаж при венозной недостаточности.
МЕДИКАМЕНТОЗНАЯ ТЕРАПИЯ
Патогенетическая терапия зависит от причины отёков. Симптоматическая терапия мочегонными средствами показана при выраженных отёках. При идиопатических отёках нельзя применять салуретики (показан спиронолактон).
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Тромбэктомия при тромбозе глубоких вен голени, осложнённой белой флегмазией.
При варикозном расширении вен нижних конечностей показаниями к оперативному лечению являются развитие недостаточности клапанного аппарата большой или малой подкожной вены, возникновение выраженных расстройств кровообращения в нижних конечностях и присоединение трофических нарушений (признаки прогрессирующего течения).
Резекционно-пластические операции и реконструктивные микрохирургические операции на лимфатических сосудах и узлах.
ПРОФИЛАКТИКА
Профилактика тромбоза глубоких вен нижних конечностей:
- ранняя активизация после операции
- использование эластичных чулок, сдавливающих поверхностные вены ног и увеличивающих кровоток в глубоких венах
- периодическая компрессия голени при помощи пневматической манжеты увеличивает скорость кровотока в нижних конечностях и помогает предотвратить стаз крови
- веноконстрикторы (дигидроэрготамин, диосмин+гесперидин) также увеличивают скорость кровотока по глубоким венам
- гепарин, назначаемый в профилактических дозах до и после операции по 2500-5000ЕД п/к каждые 6-12 ч, эффективно предупреждает тромбоз глубоких вен.
Вторичная профилактика (т.е. предотвращение прогрессирования) хронической сердечной недостаточности, ХПН, портальной гипертензии, лёгочной гипертензии.
ПРОГНОЗ
Около 20% нелеченых проксимальных (т.е. выше голени) глубоких флеботромбозов приводит к ТЭЛА, 10-20% из них заканчивается летально. При агрессивной антикоагулянтной терапии смертность снижается в 5-10 раз. Прогноз при ХПН, хронической сердечной недостаточности, лёгочной гипертензии, протекающих с отёками, соответствует стандартному прогнозу при этих заболеваниях.
МЕТОДЫ ДИАГНОСТИКИ В АМБУЛАТОРНОЙ КАРДИОЛОГИИ
ФУНКЦИОНАЛЬНЫЕ ПРОБЫ С ДОЗИРОВАННОЙ ФИЗИЧЕСКОЙ НАГРУЗКОЙ
ОБЩИЕ ПОЛОЖЕНИЯ
В состоянии покоя у пациентов с поражением коронарного русла сердечно-сосудистая система может длительное время находиться в состоянии компенсации без клинических признаков её нарушений. Именно поэтому электрокардиограмма, зарегистрированная в 12 стандартных отведениях в покое, может не обнаруживать признаков коронарной недостаточности тех или иных отделов миокарда, что не позволяет исключить наличие у пациента гемодинамически значимого атеросклеротического поражения венечных артерий сердца. В связи с этим в кардиологической практике стали широко применять нагрузочные пробы (стресс-тесты) с изотонической нагрузкой, которые позволяют оценить функциональный резерв и состояние сердечно-сосудистой системы при выполнении различных видов деятельности. В настоящее время в кардиологии наиболее широкое распространение получили стресс-тесты с дозированной физической нагрузкой, т.е. нагрузкой, мощность которой может быть изменена в соответствии с определёнными задачами исследования. Их проводят на велоэргометре или бегущей дорожке (тредмил) (табл. 4).
Таблица 4. Сравнительная характеристика оценки функционального статуса при использовании велоэргометра и тредмила.
велоэргометр тредмил
Измерение мощности нагрузки - +
Помехи и артефакты меньше больше
Безопасность исследования выше ниже
Степень тренированности мышц ног ниже выше
Затруднения у больных с ожирением меньше больше
Физиологичность ниже выше
Более подходит для исследования больных здоровых лиц
Проведение нагрузочных тестов показано только в том случае, если ожидают, что результаты окажут влияние на тактику ведения пациента.
Безусловные показания к назначению теста с физической нагрузкой:
- диагностика обструктивной коронарной болезни сердца - для определения степени риска развития клинических исходов ИБС, оценки функционального класса стенокардии и уточнения прогноза заболевания у пациентов с подозрением на наличие ИБС
- оценка состояния пациентов с установленным диагнозом коронарной болезни сердца при значительном изменении клинической картины заболевания
- оценка прогноза у пациентов, перенесших инфаркт миокарда, определение допустимой физической нагрузки и адекватности проводимой антиангинальной терапии
- клиническая оценка состояния пациентов, перенесших операцию реваскуляризации, в случае возобновления симптоматики
- необходимость установки параметров работы частотно-адаптивного электрокардиостимулятора.
Относительные показания:
- клиническая оценка состояния пациентов с вазоспастической стенокардией
- клиническая оценка состояния пациентов, перенесших операцию реваскуляризации после инфаркта миокарда
- определение функционального статуса у пациентов с умеренным поражением клапанного аппарата сердца и ХСН
- необходимость определения тактики ведения лиц без явной симптоматики коронарной болезни сердца, но с высокой степенью риска её развития, которые предполагают выполнять интенсивные физические нагрузки, а также тех, чья профессиональная деятельность связана с обеспечением безопасности для окружающих
- оценка симптомов (например, нарушений сердечного ритма или синкопальных состояний), возникающих во время или после физической нагрузки
- стратификация риска у пациентов с ИБС перед хирургическим вмешательством
- стратификация риска у пациентов с гипертрофической кардиомиопатией
- дифференциальный диагноз болевого синдрома в грудной клетке.
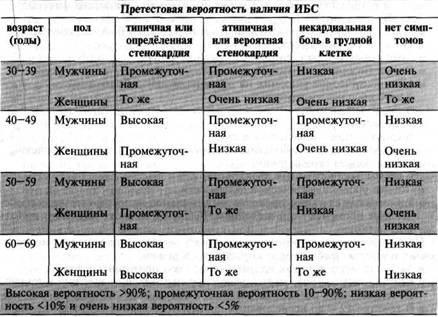
При назначении нагрузочного теста с целью диагностики ИБС и интерпретации его результатов следует учитывать претестовую (априорную) вероятность наличия данного заболевания у пациента.
Прогностическая ценность результата любого диагностического теста зависит от априорной вероятности заболевания у данного пациента, при этом наибольшая эффективность диагностического теста наблюдается в том случае, когда эта претестовая вероятность находится в промежуточных пределах. Данные о претестовой вероятности наличия ИБС представлены в табл. 5.
Таблица 5. Претестовая вероятность наличия ИБС, рассчитанная в зависимости от пола, возраста и клинической симптоматики.
Абсолютные противопоказания к проведению нагрузочных проб:
- инфаркт миокарда (первые 48 ч)
- нестабильная стенокардия в случаях, когда состояние пациента не стабилизировано, проведение нагрузочных тестов при нестабильной стенокардии для стратификации риска возможно не ранее, чем через 6 ч после стабилизации состояния
- неконтролируемые нарушения сердечного ритма, сопровождающиеся клинической симптоматикой или гемодинамическими расстройствами
- тяжёлый аортальный стеноз с клиническими проявлениями
- тяжёлая сердечная недостаточность
- тромбоэмболия лёгочной артерии или инфаркт лёгкого
- острый миокардит или перикардит
- расслоение аорты.
Относительные противопоказания:
- документированный стеноз ствола левой коронарной артерии
- умеренно выраженный стеноз клапанов сердца
- электролитные нарушения
- тяжёлая артериальная гипертония (более 200 и 110мм рт.ст.)
- тахиаритмии или брадиаритмии
- гипертрофическая кардиомиопатия с обструкцией выносящего тракта левого желудочка
- психические или физические нарушения, препятствующие адекватному выполнению физической нагрузки (в том числе выраженное ожирение)
- атриовентрикулярная блокада высокой степени.
МЕТОДИКА ПРОВЕДЕНИЯ НАГРУЗОЧНЫХ ПРОБ
Перед проведением нагрузочного теста необходимо оценить состояние пациента и обратить особое внимание на наличие следующих факторов:
- жалобы, тип, характер, продолжительность и иррадиация болевых ощущений
- анамнез, указания на наличие стенокардии, артериальной гипертонии, сахарного диабета, ожирения, хронических заболеваний лёгких, неврологических заболеваний, включая когнитивные расстройства, физических ограничений, приём лекарственных препаратов
- общий уровень физической активности
- ЧСС и АД
- ЭКГ в покое.
Необходимо заранее объяснить пациенту методику проведения исследования и внести необходимые коррективы в режим. За 3ч до исследования пациент не должен принимать пищу. Если пациент курит, то ему следует воздержаться от курения в течение не менее 3ч до исследования. В течение 12ч до исследования пациенту не рекомендуют выполнение непривычной или тяжёлой физической нагрузки. За 48ч до исследования следует отменить б-адреноблокаторы (кроме тех случаев, когда цель исследования заключается в оценке эффективности антиангинальной терапии) и другие пролонгированные антиангинальные препараты. Рекомендуют принести с собой список принимаемых лекарственных препаратов. Необходимо взять с собой лёгкую удобную одежду и спортивную обувь, а также полотенце.
При проведении пробы с дозированной физической нагрузкой преследуют две основные цели:
определение толерантности пациента к физической нагрузке и выявление клинических и электрокардиографических признаков ишемии миокарда, обусловленных коронарной недостаточностью с целью диагностики ишемической болезни сердца.
Во время проведения теста с физической нагрузкой мониторируют три главных параметра:
- клиническая реакция испытуемого на физическую нагрузку (т.е. появление одышки, головокружения, боли в грудной клетке, развитие типичного приступа стенокардии, а также нарушение состояния по шкале Борга)
- гемодинамический ответ (т.е. частота сердечных сокращений, артериальное давление, двойное произведение, пиковая физическая нагрузка)
- изменения ЭКГ во время проведения пробы с физической нагрузкой и в течение фазы восстановления.
При наличии следующих исходных изменений на ЭКГ интерпретация результатов электрокардиографической пробы с физической нагрузкой практически невозможна, и в этих случаях показано проведение альтернативных тестов:
- полная блокада левой ножки пучка Гиса
- синдром WPW
- выраженная гипертрофия левого желудочка
- депрессия сегмента ST >1мм
- лечение дигоксином
- ЭКС-навязанный желудочковый ритм.
Для стресс-тестов вне зависимости от способа дозирования нагрузки существуют общие принципы:
- равномерность нагрузки - нагрузка от ступени к ступени не должна дозироваться хаотично, а равномерно возрастать, чтобы обеспечить должную адаптацию сердечно-сосудистой системы на каждой ступени, что позволит провести точную диагностику
- фиксированная длительность каждой ступени - во всём мире принята длительность ступени нагрузки, равная 3мин
- начинать пробу нужно с минимальной нагрузки - для ВЭМ это величина, равная 20-40Вт, а для тредмилэргометрии - 1,8-2,0МЕТ(1 метаболический эквивалент МЕТ = 1,2 кал/мин или 3,5-4,0мл потреблённого кислорода в минуту на 1кг массы тела).
Наиболее распространённый протокол пробы с физической нагрузкой с применением тредмила (протокол Брюса) представлен в табл. 6.
Таблица 6. Протокол Брюса

В табл. 7 приведены величины максимальной ЧСС в зависимости от пола и возраста, по достижении которых следует прекратить пробу с нагрузкой у здоровых людей.
Таблица 7. Максимальная ЧСС в зависимости от пола и возраста

Расчет максимальной ЧСС можно произвести по формуле:
чсс MAX=220-возраст (в годах) для мужчин
чсс MAX=210-возраст (в годах) для женщин
У больных с установленным диагнозом ишемической болезни сердца часто ограничиваются достижением так называемой субмаксимальной ЧСС, составляющей 75-85% от максимальной, так как дальнейшее увеличение нагрузки опасно из-за возможности возникновения осложнений.
Есть критерии адекватной нагрузочной пробы:
- достижение 4 ступени (13МЕТ)
- достижение двойного произведения 20 000 и более
- достижение 85% от максимальной чсс.
Нормальная электрокардиографическая картина:
- увеличение амплитуды зубцов Р
- уменьшение амплитуды зубцов R
- снижение точки j
- остроугольная косовосходящая депрессия сегмента ST
- уменьшение интервала Q-T
- уменьшение амплитуды зубца Т.
Абсолютные показания к прекращению пробы:
- снижение систолического АД >10мм рт.ст. ниже исходного уровня, несмотря на увеличение рабочей нагрузки (при наличии других признаков ишемии миокарда)
- возникновение приступа стенокардии умеренной или большой интенсивности
- появление церебральной симптоматики (атаксия, головокружение, синкопе)
- признаки гипоперфузии (цианоз или бледность)
- отказ больного от дальнейшего проведения пробы
- технические проблемы.
Относительные показания к прекращению пробы:
- снижение систолического АД >10мм рт.ст. ниже исходного уровня, несмотря на увеличение рабочей нагрузки (при отсутствии других признаков ишемии миокарда)
- усиление боли в грудной клетке
- появление резкой общей слабости
- возникновение выраженной одышки
- появление боли в икрах или перемежающейся хромоты
- подъем АД >250 и 115мм рт.ст.
Абсолютными электрокардиографическими критериями прекращения нагрузочной пробы служат:
- устойчивая желудочковая тахикардия
- подъём сегмента ST >lмм в отведениях без диагностически значимых зубцов Q (кроме отведений V1 или aVR)
Относительные показания к прекращению нагрузочной пробы:
- изменение комплекса QRS и сегмента ST в виде выраженной горизонтальной или косонисходящей ST >2мм или значительного изменения электрической оси сердца
- нарушения сердечного ритма (кроме устойчивой желудочковой тахикардии), включая многофокусную желудочковую экстрасистолию, триплеты желудочковой экстрасистолии, наджелудочковую тахикардию, АВ-блокаду и брадиаритмии
- появление блокады ножки пучка Гиса или замедление внутрисердечной проводимости, по морфологии не отличимых от желудочковой тахикардии.
ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ НАГРУЗОЧНЫХ ПРОБ
При интерпретации результатов теста необходимо учитывать всю полученную в ходе проведения исследования информацию:
- электрокардиографические данные
максимальная депрессия сегмента ST
максимальная элевация сегмента ST
тип депрессии сегмента ST (косонисходящая, горизонтальная, косовосходящая)
количество отведений, в которых регистрировали изменения
продолжительность изменений сегмента ST в восстановительном периоде
индекс ST/чсс
индуцированные нагрузкой желудочковые нарушения ритма
продолжительность нагрузки до появления изменений сегмента ST
- гемодинамические данные
максимальная достигнутая чсс
максимальное систолическое АД
максимальное двойное произведение
общая продолжительность нагрузки
гемодинамическая реакция на нагрузку
хронотропная недостаточность
- клинические данные
индуцированная нагрузкой стенокардия
лимитирующие выполнение нагрузки клинические проявления
продолжительность времени нагрузки до возникновения приступа стенокардии.
СТАНДАРТИЗАЦИЯ НАГРУЗОЧНЫХ ПРОБ
В качестве показателей, выбранных для стандартизации и сравнения результатов нагрузочных проб, выбраны следующие:
- потребление кислорода при нагрузке (в МЕТ)
- пороговая мощность нагрузки (Вт)
- пороговое двойное произведение = систолическое АД х чсс х 102
Заключение по протоколу электрокардиографической функциональной пробы с физической нагрузкой включает в себя следующие положения:
- интерпретация исходной ЭКГ
- клинические проявления, наблюдавшиеся в ходе выполнения нагрузки и в восстановительном периоде
- причина прекращения нагрузки
- оценка мощности нагрузки в МЕТ
- динамика АД
- наличие и частота нарушений сердечного ритма
- изменения на ЭКГ (тип и локализация) в течение теста.
Примеры. Заключение - проба положительная, проба отрицательная, проба сомнительная, проба неинформативная. Достигнутая нагрузка – максимальная, субмаксимальная. Толерантность к нагрузке - высокая, средняя, низкая.
ОЦЕНКА КОРОНАРНОЙ НЕДОСТАТОЧНОСТИ
Суммарно нагрузочную пробу оценивают по четырём критериям: положительная, отрицательная, сомнительная и недиагностическая.
Положительной пробу считают, если во время проведения исследования возникли ЭКГ-признаки ишемии миокарда. При появлении признаков ишемии миокарда без приступа стенокардии (ангинозные боли) указывают на безболевую ишемию миокарда.
Отрицательной пробу считают на основании отсутствия критериев ишемии при условии достижения необходимого уровня нагрузки (субмаксимальная чсс или нагрузка, соответствующая 10МЕТ и более).
Сомнительной пробу считают в том случае, если у пациента возник приступ стенокардии, но ишемических изменений на ЭКГ не выявлено, отклонения сегмента ST не достигают 1мм, выявляют нарушения сердечного ритма, отмечают снижение систолического АД более 10мм рт.ст.
Пробу считают неинформативной в тех случаях, когда пациенту не удалось достигнуть необходимого уровня нагрузки (субмаксимальная чсс или нагрузка менее 7 МЕТ), при этом ишемические изменения на ЭКГ отсутствуют.
Изменения сегмента ST служат наиболее надежными электрокардиографическими признаками ишемии миокарда.
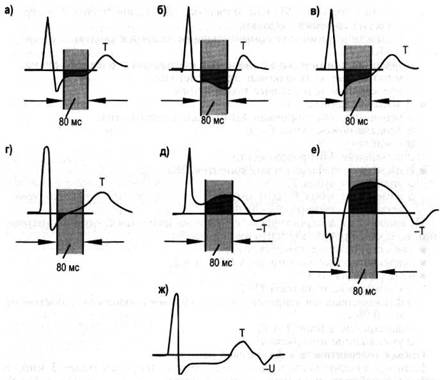
Положительной считают пробу, при которой у пациента появляется горизонтальная или косонисходящая депрессия сегмента ST не менее 1мм ниже изолинии через 80 мс после точки у (рис. 1). При выявлении таких изменений чувствительность метода составляет 68%, специфичность - 77%, предсказующее значение положительного результата 70-80%.
Рис. 1. Варианты изменения сегмента ST при нагрузочных пробах:
а) горизонтальное снижение (депрессия) сегмента RS-T
б) косонисходящее снижение
в) медленное косовосходящее снижение
г) быстрое косовосходящее снижение
д), е) ишемический подъём сегмента RS-T
ж) горизонтальное (ишемическое) снижение сегмента RS-Т в сочетании с отрицательным зубцом U.
Электрокардиографические изменения во время проведения нагрузочной пробы, указывающие на высокую вероятность наличия коронарной болезни сердца:
- раннее появление ишемических изменений (в течение 6мин нагрузки)
- стойкая депрессия сегмента ST в течение 6 и более минут в восстановительном периоде
- депрессия сегмента ST в пяти и более отведениях.
Клинические проявления во время проведения нагрузочной пробы, указывающие на наличие ишемии миокарда:
- индуцированная физической нагрузкой артериальная гипотония
- индуцированный физической нагрузкой приступ стенокардии или его эквивалент
- появление третьего S3 или четвертого S4 тонов сердца или сердечного шума во время нагрузки.
Недиагностическими или сомнительными являются следующие изменения на ЭКГ:
- появление клинически не значимых нарушений сердечного ритма - монотонные желудочковые экстрасистолы, предсердные или узловые тахиаритмии
- появление блокад - первичная или вторичная АВ-блокада I типа, блокада ножек пучка Гиса, гемиблок, изменения АВ-проводимости
- изменение морфологии компонентов ЭКГ - уплощение зубца Т, изменения зубца Р <0,01мм, депрессия сегмента ST <0,1мм.
Не имеющими диагностического значения являются следующие изменения во время проведения нагрузочной пробы:
- слабость, одышка, покраснение
- неадекватно быстрый прирост чсс и АД
- изменения на ЭКГ - уменьшение интервала Q-Т, функциональная депрессия точки j <0,2мм продолжительностью менее 0,06с, заострение зубцов Т и Р, уменьшение интервала P-R.
ОЦЕНКА ТОЛЕРАНТНОСТИ К ФИЗИЧЕСКОЙ НАГРУЗКЕ
Если продолжительность последней ступени нагрузки менее 3мин, то работоспособность рассчитывают по формуле:
W = wHa4+(Wnocji-wHa4)t/3,
где W - общая работоспособность; WHa4 - мощность предыдущей ступени нагрузки; Wnocji - мощность последней ступени нагрузки; t - время работы на последней ступени.
Для перенесших инфаркт миокарда и больных ИБС толерантность к физической нагрузке оценивают как «высокую», если W >100Вт; «среднюю» при равной 50-100Вт; «низкую», если <50Вт.
Функциональный класс ИБС определяется толерантностью к физической нагрузке.
При положительной пробе необходимо определить функциональный класс ИБС (табл. 9).
Таблица 9. Функциональные классы

ОЦЕНКА ПРОГНОЗА
На основании результатов нагрузочной пробы возможно выявление пациентов с высоким риском развития сердечно-сосудистых осложнений и коронарной смерти.
Пациентам с ИБС на основании индексов риска рекомендуют определение прогноза (табл. 10).
Таблица 10. Определение прогноза на основании результатов нагрузочной пробы
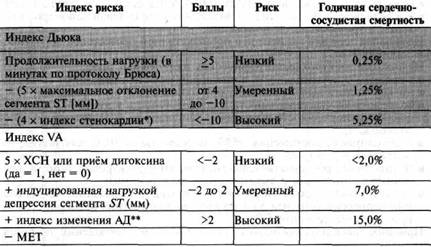
*Индекс стенокардии:
нет стенокардии = 0
стенокардия, не лимитирующая проведение исследования = 1
стенокардия, лимитирующая проведение исследования = 2
**Изменение индекса систолического АД:
увеличение >40мм рт.ст. = 0
увеличение 31-40мм рт.ст. = 1
увеличение 21-30мм рт.ст. = 2
увеличение 11-20мм рт.ст. = 3
увеличение 10мм рт.ст. = 4
снижение ниже исходного уровня = 5.
СТРАТИФИКАЦИЯ РИСКА БОЛЬНЫХ С ОСТРЫМ КОРОНАРНЫМ СИНДРОМОМ
После стабилизации состояния на фоне медикаментозного лечения необходимо провести стратификацию риска для определения прогноза и показаний к катетеризации сердца.
Низкий риск. Пациенты с отрицательным тропониновым тестом и низким риском по данным нагрузочного теста (отсутствие депрессии сегмента SТ >1мм в 3 и более отведениях при мощности нагрузки более 90Вт для мужчин и 70Вт для женщин, т.е. II ступень по протоколу Брюса) при отсутствии симптоматики могут быть выписаны под наблюдение по месту жительства.
Высокий риск. Пациентам с повышенным уровнем тропонина (тропонин Т >0,1мкг/л) или высоким риском по данным нагрузочного теста (появление депрессии сегмента ST >1мм в 3 и более отведениях при достижении мощности нагрузки 90Вт для мужчин и 70Вт для женщин, т.е. II ступень по протоколу Брюса) рекомендовано незамедлительное проведение коронароангиографии до выписки из стационара.
У пациентов, не относящихся к группам высокого и низкого риска, тактика в отношении коронароангиографии и сроков её проведения определяется индивидуально.
ПРЕИМУЩЕСТВА И НЕДОСТАТКИ ПРОБ С ФИЗИЧЕСКОЙ НАГРУЗКОЙ
Преимущества электрокардиографических нагрузочных проб:
- относительная простота проведения
- невысокая стоимость
- одновременная оценка функционального статуса
- безопасность (риск смерти 0,005-0,01%, риск остановки сердца 0,02%)
- высокая чувствительность при поражении ствола левой коронарной артерии и трёхсосудистом поражении
- bдеальный тест для пациентов с промежуточной претестовой вероятностью наличия ИБС.
Недостатки электрокардиографических нагрузочных проб:
- в среднем чувствительность и специфичность не превышают 70%
- низкая частота выявления ИБС при однососудистом поражении
- более низкая чувствительность и специфичность у женщин
- более высокая чувствительность и низкая специфичность у пациентов пожилого возраста
- необходимость достижения >85% максимальной чсс для получения надёжных результатов
- технические проблемы (артефакты, смещение электродов, помехи, связанные с движением и дыхательными экскурсиями)
- невозможность локализации окклюзирующего поражения на основании депрессии сегмента ST (топическая диагностика возможна только при элевации сегмента ST).
Причины ложноположительных результатов при проведении нагрузочных проб:
- гипертрофия левого желудочка
- исходные изменения сегмента SТ или зубца Т
- обструкция выносящего тракта левого желудочка
- гипервентиляция
- нарушения внутрижелудочковой проводимости
- электролитные нарушения
- спазм коронарных сосудов
- применение трициклических антидепрессантов.
Распространённые заблуждения относительно проведения проб с физической нагрузкой:
- отрицательная проба указывает на отсутствие ИБС (чувствительность метода не превышает 70%, таким образом, треть пациентов имеют лож- неотрицательные результаты)
- пробу проводят пациентам с известной ИБС, особенно пациентам с постинфарктным кардиосклерозом (целесообразно проведение пробы только для определения прогноза и оценки эффективности терапии)
- пробу проводят пациентам без клинической симптоматики (диагностическая ценность пробы у этой категории лиц очень низкая).
При наличии показаний к проведению нагрузочных проб следует выбирать адекватный метод исследования.
Сравнительная характеристика различных функциональных методов исследования представлена в табл. 11.


ЭХОКАРДИОГРАФИЯ
Эхокардиография эхоКГ - метод исследования структуры и функции сердца, основанный на регистрации ультразвуковых сигналов.
Достоинства метода - неинвазивность, безопасность, доступность, большая информативность, быстрота проведения и получения результатов. К недостаткам относят невозможность качественного обследования при плохой визуализации: ожирение, особенности скелета, эмфизема лёгких и прочее. Эхокардиография, как и любой другой метод функциональной диагностики, требует от врача-клинициста рационального объединения результатов эхокардиографического исследования с клиническими и другими данными.
ФИЗИЧЕСКИЕ ПРИНЦИПЫ ЭХОКАРДИОГРАФИИ
В основе метода лежит регистрация отражённых ультразвуковых волн, что происходит при прохождении их через границу раздела сред с различными акустическими свойствами.
В эхокардиографии используют ультразвуковые импульсы длительностью около 1микросекунды. Составляющий основу эхоКГ датчика пьезоэлектрический элемент работает в режиме генерации менее 1% времени, остальное время - в режиме приёма. Интенсивность принятых эхо-сигналов может быть графически представлена на экране эхокардиографа (осциллоскопа) в различных режимах.
А-модальный режим (А амплитуда). По одной оси координат представлены электрические импульсы различной амплитуды, а по другой откладывают расстояние от датчика до исследуемых структур. Недостаток режима - А-модальное изображение не содержит временной осикоординат и не может поэтому регистрировать движение.
В-модальный режим (В brightness, яркость). Интенсивность принятых эхо-сигналов представлена не в виде амплитуды, а в виде яркости свечения точки.
М-модальный режим (М motion, движение). Режим развёртки яркости структур сердца по времени, в котором одна из двух пространственных координат заменена временной. Главный недостаток -одномерность.
Режим двумерного изображения - развитие В-режима. На экране сечение сердца представлено множеством точек, соответствующих В-модальным эхокардиограммам при различных направлениях ультразвукового луча.
Существует несколько модификаций приборов эхоКГ, в которых используют следующие типы датчиков:
- механический датчик обладает более высокой разрешающей способностью, но имеет больший размер и менее долговечен
- электронный датчик (датчик с электронно-фазовой решёткой) лучше приспособлен для проведения допплеровских методик
- современный анулярный датчик (с циркулярным расположением пьезоэлектрических элементов) сочетает в себе свойства механического датчика и датчика с электронно-фазовой решёткой.
ТРАНСТОРАКАЛЬНАЯ ЭХОКАРДИОГРАФИЯ
Трансторакальная эхокардиография - исторически первый и до сих пор самый распространённый (по причине доступности и информативности) тип ультразвукового исследования сердца. Ультразвуковой датчик прижимают к грудной клетке обследуемого.
ЭТАПЫ ЭХОКГ ИССЛЕДОВАНИЯ И СТАНДАРТНЫЕ ЭХОКГ ПОЗИЦИИ
Приставив ультразвуковой датчик к грудной клетке, можно получить множество различных изображений сердца на экране эхокардиографа. Они будут разниться в зависимости от положения датчика, конституции больного, навыка исследователя. Из всевозможных изображений (сечений) выделяют несколько, которые называют «стандартными позициями». При этом главенствует не положение датчика, а изображение и взаимное положение структур сердца на экране.
Обследуемый находится в положении лежа на спине, часто для улучшения визуализации его просят лечь на левый бок.
Любое трансторакальное эхокардиографическое обследование обязательно включает в себе следующие позиции (которые проводят, как правило, в порядке упоминания ниже):
- парастернальный доступ - 1 этап
А. Режим двумерного изображения. Датчик устанавливают слева от грудины в III, IV или V межреберье и, в зависимости от поворота датчика, получают на экране парастернальную позицию по длинной оси левого желудочка. На экране должны визуализироваться: митральный клапан, аортальный клапан, полость левого желудочка, аорта, левое предсердие, межжелудочковая перегородка, задняя стенка левого желудочка, правый желудочек.
Б. Из позиции парастернальной длинной оси левого желудочка, как правило, проводят М-модальное исследование, в котором создаются наилучшие условия для многих измерений. Стандартными срезами (позициями) М-модального исследования при этом являются:
М-модальное исследование аортального клапана и левого предсердия,
М-модальное исследование правого желудочка, митрального клапана и левого желудочка,
М-модальное исследование полости левого желудочка.
Таким образом, правильно получив из парастернального доступа позицию по длинной оси левого желудочка, исследователь получает многоплановую (в том числе количественную) информацию о левых отделах сердца, аорте и, в меньшей степени, правом желудочке.
- парастернальный доступ - 2 этап
А. Режим двумерного изображения. Датчик находится там же, где была получена позиция по длинной оси левого желудочка, но поворачивается на 90°. Изменяя угол наклона датчика по отношению к грудной клетке обследуемого, на экран последовательно выводят: парастернальную позицию по короткой оси на уровне аортального клапана. В центре экрана находят три створки аортального клапана, вверху выносящий тракт правого желудочка, справа и внизу ствол лёгочной артерии и клапан лёгочной артерии.
Парастернальная позиция по короткой оси на уровне митрального клапана. В центре изображения находится округлой формы левый желудочек и хорошо визуализируются передняя (выше) и задняя (ниже) створки митрального клапана.
Парастернальная позиция по короткой оси левого желудочка на уровне папиллярных мышц. Большую (центральную) часть изображения на экране занимает округлая полость левого желудочка, в котором видны две папиллярные мышцы.
Б. Режим одномерного изображения (М-модальное исследование) может быть проведен и при этом угле поворота датчика, если по каким-либо причинам оно не было проведено ранее. Из соответствующих позиций по короткой оси левого желудочка могут быть получены все те же самые стандартные срезы (позиции) М-модального исследования, что и при исследовании по длинной оси левого желудочка.
- апикальный доступ
А. Режим двумерного изображения. Исследователь пальпаторно определяет верхушечный толчок и устанавливает над ним датчик эхокардиографа. Последовательно поворачивая датчик из апикального доступа, получают следующие позиции: апикальная четырёхкамерная позиция позволяет одновременно визуализировать оба желудочка, оба предсердия, оба атриовентрикулярных клапана, межжелудочковую и межпредсердную перегородки, апикальная пятикамерная позиция позволяет отобразить на экране все выше перечисленные структуры, и дополнительно в центре изображения видны аортальный клапан и часть восходящего отдела аорты, апикальная двухкамерная позиция преимущественно визуализирует левый желудочек и левое предсердие, а также структуры митрального клапана.
Другие разнообразные доступы и позиции изображения сердца не входят в обязательное эхокардиографическое исследование и их проводят по показаниям.
ДОППЛЕР-ЭХОКАРДИОГРАФИЯ
Допплер-эхокардиография (допплер-эхоКГ) - неинвазивный метод оценки параметров кровотока в крупных сосудах и сердце.
Эффект Допплера заключается в изменении длины волны (частоты), наблюдаемой при движении источника волн относительно их приёмника. Первоначально применялись аппараты, генерирующие непрерывную волну и позволяющие дать оценку кровотоку и измерить его скорость неселективно (например, в аорте). Позднее появились приборы, использующие импульсную волну, при помощи которой стало возможно исследовать кровоток более селективно, например кровоток через клапаны.
При наличии того или иного клапанного стеноза, скорость соответствующего чресклапанного кровотока возрастает, а характер его меняется из ламинарного на турбулентный.
Импульсную допплер-эхоКГ используют для быстрого выявления турбулентных потоков. Её недостаток - невозможность измерения высоких потоковых скоростей.
Непрерывноволновая допплер-эхоКГ позволяет измерять высокие потоковые скорости, но на протяжении всей длины луча, что может затруднять локализацию стеноза.
Цветная допплер-ЭхоКГ основана на принципе различной окраски потоков, направленных к датчику и от датчика. Это наиболее оптимальная методика для выявления (очень быстрого) клапанной регургитации.
Тканевая допплер-ЭхоКГ. Данной методике будет посвящен отдельный раздел.
ТКАНЕВАЯ (МИОКАРДИАЛЬНАЯ) ДОППЛЕР-ЭХОКАРДИОГРАФИЯ
Как указывалось выше, эффект Допплера основан на изменении частоты ультразвукового сигнала при отражении от движущихся объектов. Традиционно такими объектами служили эритроциты, соответственно основной сферой применения допплер-эхоКГ было исследование кровотока в полостях сердца и сосудах. Очевидно, что в сердце есть множество движущихся структур и при отражении ультразвукового сигнала от этих объектов его частота также изменяется. В течение многих лет производители оснащали эхоКГ-аппараты специальными фильтрами, позволяющими исключить из допплеровского спектра низкочастотные сигналы, отражённые от структур сердца и усиливающие высокочастотный сигнал от форменных элементов. В новых моделях ультразвуковых приборов производители стремятся выделить и высокочастотные и низкочастотные сигналы.
Методику тканевой миокардиальной допплер-эхоКГ проводят как в импульсном режиме, так и в режиме двух- или одномерного (М-модального) цветного допплеровского картирования.
Поскольку тканевая миокардиальная допплер-эхоКГ позволяет измерять амплитуду и скорость движения различных участков миокарда и сердечных структур, метод может дать ценную информацию о состоянии глобальной и региональной систолической и диастолической функции миокарда левого желудочка. При помощи тканевой миокардиальной допплер-эхоКГ можно также анализировать функцию правого желудочка, проводить дифференциальную диагностику между констриктивным перикардитом и рестриктивной кардиомиопатией, рассчитывать давление в полостях сердца и лёгочной артерии, диагностировать отторжение сердечного трансплантата. Возможны и многие другие перспективы развития метода.
ЧРЕСПИЩЕВОДНАЯ ЭХОКАРДИОГРАФИЯ
Проведению трансторакальной эхоКГ могут мешать акустические препятствия (эмфизема лёгких, особенности конституции и прочее), чего не наблюдают, если ультразвуковой датчик введён в пищевод на уровне левого предсердия и нисходящего отдела аорты, поэтому чреспищеводная эхоКГ всё более широко входит в клиническую практику.
Разумеется, чреспищеводная ЭхоКГ не так легко выполнима технически и представляет собой полуинвазивную процедуру. Поэтому чреспищеводной эхоКГ должно предшествовать, по возможности, тщательное трансторакальное исследование.
Чреспищеводное ЭхоКГ исследование проводят в следующих позициях (сечениях):
- поперечная короткая ось на уровне основания сердца, при которой визуализируются створки аортального клапана, часть восходящей аорты, верхняя полая вена, часть ствола лёгочной артерии, ушко левогопредсердия, лёгочные вены и проксимальные сегменты коронарных артерий
- выносящий тракт левого желудочка по длиной оси, в этом положении датчика дополнительно видны на экране митральный клапан и левое предсердие
- четырёхкамерная позиция позволяет одновременно получить изображения обоих желудочков, обоих предсердий, обоих атриовентрикулярных клапанов, межпредсердную и межжелудочковую перегородки
- короткая ось левого желудочка, из этой позиции оценивают локальную и глобальную сократимость левого желудочка
- нисходящий отдел аорты.
Наибольшие преимущества чреспищеводная эхоКГ имеет в диагностике опухолей и тромбов в предсердиях, патологии протезированных клапанов, инфекционного эндокардита, болезней аорты, для интраоперационного мониторинга и в ряде других случаях.
СТРЕСС-ЭХОКАРДИОГРАФИЯ
Региональные нарушения сокращения и особенно расслабления стенки левого желудочка при ишемической болезни сердца возникают значительно раньше, чем электрокардиографические и клинические признаки ишемии, поэтому применение эхокардиографии в сочетании с записью ЭКГ существенно повышает чувствительность и специфичность нагрузочных тестов. Особенно это заметно у больных с гипертрофией миокарда, блокадой левой ножки пучка Гиса и при приёме некоторых лекарственных препаратов, когда интерпретация изменений ЭКГ существенно затруднена.
Принцип стресс-эхоКГ основан на появлении зон с нарушенным характером движения стенки желудочка на высоте нагрузки (механической, фармакологической и др.). Так, если в норме в ответ на нагрузку отмечают равномерное увеличение амплитуды движения всех стенок сердца, то при наличии ИБС снижение регионального субэндокардиального кровотока приводит к метаболическим и, как следствие, механическим аномалиям. Это могут быть снижение амплитуды систолического движения эндокардиальной поверхности стенки левого желудочка (гипокинезия), отсутствие систолического движения стенки (акинезия) или появление парадоксального систолического выбухания стенки (дискинезия).
Провоцирующими факторами при стресс-эхоКГ являются:
- динамическая физическая нагрузка, пробу можно проводить с использованием тредмила. При этом исследование выполняют в положении пациента лёжа до нагрузки и в этом же положении сразу после нагрузки (локальные изменения сократимости устойчиво сохраняются в течение 90-120сек после прекращения нагрузки). Обычный протокол при использовании тредмила предусматривает исследование на левом боку с получением 4- и 2-камерного изображения сердца по длинной оси с верхушки сердца, а также нескольких поперечных сечений левого желудочка из обычной точки (парастернальный доступ).
Использование велоэргометрии в положении пациента сидя или лёжа позволяет проводить исследование в исходном состоянии, на высоте нагрузки и в период восстановления. Необходимо отметить, что исследование при велоэргометрии более сложно, чем при использовании тредмила, особенно у пожилых пациентов и больных с плохим ультразвуковым «окном». При использовании велоэргометрии, как правило, удаётся получить только 4- или 2-камерное изображение по длинной оси с верхушки либо поперечное сечение левого желудочка из субкостального доступа
- фармакологические препараты: проба с дипиридамолом основана на его свойстве вызывать синдром «обкрадывания» участков миокарда, кровоснабжающихся стенозированными коронарными артериями, проба с добутамином выявляет ишемизированные участки миокарда из-за положительного инотропного действия препарата на миокард, вследствие чего повышается потребность в кислороде
- чреспищеводная электростимуляция сердца: двумерная эхоКГ в сочетании с чреспищеводной стимуляцией служит одним из самых точных неинвазивных методов диагностики ИБС. Эту пробу можно проводить у пациентов с невозможностью выполнения физической нагрузки и она не вызывает побочных эффектов лекарственных препаратов.
ТРЕХМЕРНАЯ ЭХОКАРДИОГРАФИЯ
С начала 90-х годов прошлого столетия появилась возможность получения трёхмерных ультразвуковых изображений сердца. Это были компьютерные реконструкции различных двухмерных эхокардиографических срезов в фиксированные фазы сердечного цикла (в систолу или диастолу). Первые трёхкамерные изображения сердца были статичными.
В конце 2002 года появилась новая эхоКГ технология, получившая название «4D-эxoKГ» или «real-time 3D-эxoKГ». Её основой стало восстановление трёхмерных картин не только в ключевые, но и в промежуточные фазы сердечного цикла (5-16 за цикл). Эта технология также не оказалась безупречной: чтобы получить искомое изображение требуется время для формирования необходимого набора сечений и компьютерной обработки данных, при исследовании могут быть помехи от нарушений ритма сердца и дыхательных движений, что требует чреспищеводного доступа для сканирования.
В том же 2002 году вышел серийный вариант прибора эхоКГ с датчиком принципиально новой технологии. Включая 3000 активных элементов и 150 микропроцессоров, датчик позволяет формировать ультразвуковые лучи и селективно принимать сигналы по всем направлениям лоцируемого объёма. Стало возможным непрерывное обновление изображения за короткий интервал времени и, таким образом, получение многоплановых и объёмных изображений сердца с минимальной потерей качества. Данная модель обеспечивает выполнение всего цикла исследования в реальном режиме времени, в результате чего на экране визуализируется «живое» трёхмерное изображение. За данной технологией закрепился термин «живая» трёхмерная эхокардиография. В большинстве случаев «живая» трёхмерная эхоКГ лишь подтверждает (детализируя) данные стандартного эхоКГ обследования, но в ряде трудных случаев это может быть единственный неинвазивный метод диагностики, позволяющий получить полную информацию о размерах дефекта межпредсердной или межжелудочковой перегородки, клапанной и другой патологии сердца.
ЭХОКАРДИОГРАФИЯ ОТДЕЛЬНЫХ СТУКТУР СЕРДЦА
ЛЕВЫЙ ЖЕЛУДОЧЕК
Как правило, для исследования анатомии и функции левого желудочка ЛЖ необходимо и достаточно проведения при стандартной трансторакальной эхоКГ следующих исследований: М-модального, двумерного и допплеровского. Наиболее важные параметры: систолическая и диастолическая функция ЛЖ, объём, толщина стенок, нарушения локальной сократимости.
- систолическая функция левого желудочка. Её параметром служит фракция выброса — отношение ударного объёма левого желудочка к его конечно-диастолическому объёму. С помощью М-модального эхоКГ исследования (парастернальныйдоступ) фракцию выброса левого желудочка рассчитывают по формуле Тейхольца (Teichholz L.E., 1976). При этом измерению подлежит лишь небольшая часть левого желудочка у его основания, не учитывается его длина, а при ишемической болезни сердца, когда имеются участки нарушенной локальные сократимости, эта формула может быть совсем не точной. Количественная двумерная эхоКГ (апикальный доступ) — гораздо более точный метод оценки фракции выброса ЛЖ. После выбора стереометрической модели ЛЖ, производят вычисление объёмов ЛЖ, основанное на планиметрических измерениях по тому или иному алгоритму. Как правило, используют алгоритм Симпсона (Simpson J.S., 1989), который также называют методом дисков.
- объёмы и диаметры левого желудочка рассчитывают в тех же режимах и доступах, что и сократительную функцию ЛЖ
- ударный объём ЛЖ — разница между конечно-диастолическим и конечно-систолическимобъёмом
- толщину стенок левого желудочка в большинстве случаев измеряют с помощью М-модальной и двумерной эхоКГ, проводимой из парастернального доступа
- диастолическую функцию левого желудочка определяют при исследовании трансмитрального кровотока в импульсном допплеровском режиме. Допплеровский контрольный объём устанавливают над местом смыкания створок митрального клапана и определяют соотношение следующих параметров трансмитрального кровотока: максимальной скорости раннего диастолического наполнения и предсердной систолы
- локальная сократимость ЛЖ нарушена, как правило, при ишемической болезни сердца. Изучают при двумерном эхоКГ исследовании из различных позиций: парастернальная позиция длинной оси ЛЖ, короткая ось на уровне митрального клапана и папиллярных мышц, апикальная двух- и четырёхкамерная позиции.
При проведении научных исследований обычно определяют гораздо большее количество показателей, тем более что современные приборы рассчитывают многие параметры автоматически. К ним относят: степень систолического укорочения переднезаднего размера левого желудочка (примерно соответствует половинной величине фракции выброса ЛЖ), скорость циркулярного укорочения волокон миокарда, масса миокарда левого желудочка.
МИТРАЛЬНЫЙ КЛАПАН
Митральный клапан изучают из левого парастернального по длинной и короткой оси и апикального доступов. В норме створки митрального клапана тонкие, подвижные, открыты в диастолу и закрыты в систолу. Как правило, удаётся визуализировать хорды и папиллярные мышцы.
М-эхоКГ изображение митрального клапана имеет буквенное обозначение. В целом кривая движения передней митральной створки напоминает букву «М». Максимальное открытие передней створки в фазе быстрого наполнения левого желудочка обозначают буквой «Е», окончание этой фазы «F» (прикрытие в середине диастолы вследствие замедления скорости кровотока), а открытие створки во время систолы предсердий «А». Интервал «C—D» соответствует систоле левого желудочка и закрытию митрального клапана. Эхо-грамма задней митральной створки представляется зеркальным отражением движения передней створки, но у неё меньшая амплитуда движения.
АОРТАЛЬНЫЙ КЛАПАН И АОРТА
Аортальный клапан исследуют из левого парастернального доступа по длинной и короткой оси, апикального (пятикамерная позиция) и субкостального доступов. В продольном сечении визуализируются две аортальные створки: правая коронарная и некоронарная, которые изображаются в виде двух параллельно движущихся линий. Во время систолы две указанные створки раскрываются в виде «коробочки». Три створки доступны визуализации из парастернального доступа по короткой оси на уровне аортального клапана.
Восходящая аорта визуализируется из парастернального доступа по длинной оси. Дуга аорты и часть нисходящей аорты доступны изучению из супрастернального доступа. Оптимальным методом подробного исследования аорты служит чреспищеводная эхоКГ.
Параметры трансаортального потока измеряют с помощью импульсной и непрерывной допплер-эхоКГ.
ТРИКУСПИДАЛЬНЫЙ КЛАПАН И ПРАВЫЙ ЖЕЛУДОЧЕК
Трикуспидальный клапан удаётся качественно лоцировать значительно реже, чем митральный. Легче это сделать при дилатации правого желудочка.
Изображение трикуспидального клапана можно получить из апикального, парастернального и субкостального доступов. Септальная и передняя створки визуализируются из апикального доступа, задняя из парастернального (приносящий тракт правого желудочка), одновременно три створки из парастернального доступа по короткой оси. В этих же позициях изучают правый желудочек.
В норме сворки трикуспидального клапана тонкие, подвижные, дискордантные. Как правило, удаётся визуализировать модератный тяж (линейная поперечная структура в полости правого желудочка), из которого частично берёт начало передняя папиллярная мышца.
ЛЁГОЧНАЯ АРТЕРИЯ И КЛАПАН ЛЁГОЧНОЙ АРТЕРИИ
Лёгочная артерия визуализируется из левого парастернального доступа по длинной оси и по короткой на уровне сосудов. В норме створки клапана лёгочной артерии определяются в её просвете в виде двух тонких линейных эхо-сигналов. С помошью одномерной эхоКГ обычно удаётся визуализировать левую створку клапана лёгочной артерии, кривая движения которой имеет буквенное обозначение. Волна «А» соответствует систоле правого предсердия, «В» — положению клапана перед началом систолы правого желудочка, «С» — началу систолы правого желудочка, интервал «E—F» отражает диастолическое движение закрытого клапана. Значительно реже одновременно регистрируют две створки клапана лёгочной артерии.
Нормы размеров структур сердца при эхоКГ исследовании.
ПРОТОКОЛ ЭХОКГ ИССЛЕДОВАНИЯ
До настоящего времени практически в каждом лечебном учреждении нашей страны имеется своя форма протокола эхоКГ исследования. К сожалению, часто встречаются и различные нормы размеров структур сердца.
В большинстве случаев, как бы ни выглядел протокол, его заполняют по мере проведения этапов исследования (в начале раздела Трансторакальная эхоКГ, см. Этапы эхоКГ исследования и стандартные эхокардиографические позиции).
Примерные нормы размеров структур сердца приведены в табл. 12.
Таблица 12
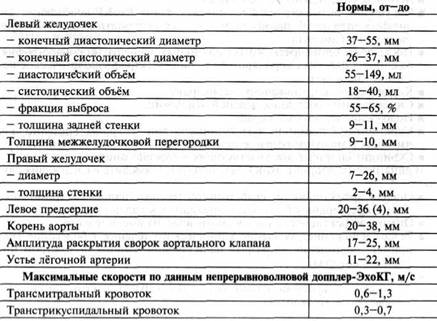

ПОКАЗАНИЯ К ЭХОКГ ИССЛЕДОВАНИЮ
Международные рекомендации классифицируют показания к проведению эхоКГ у больных с различными заболеваниями сердечно-сосудистой системы и лиц из групп риска их развития с позиции доказательной медицины в зависимости от количества, уровня и результатов проведённых клинических исследований. В рамках настоящих рекомендаций, показания к обязательному первичному проведению эхоКГ исследования следующие:
- врождённые пороки сердца
- приобретённые пороки сердца
- инфекционный эндокардит
- острый коронарный синдром
- ишемическая болезнь сердца, кроме острого коронарного синдрома, когда эхоКГ необходима для дифференциального диагноза и/или её результаты окажут влияние на ведение пациента
- сердечная недостаточность
- планируемое кардиохирургическое вмешательство
- тромбоэмболия лёгочной артерии
- лёгочная гипертензия неуточнённая
- нарушения ритма сердца в тех случаях, когда эхоКГ необходима для дифференциальной диагностики и/или её результаты окажут влияние на ведение пациента
- после проведения чрескожных инвазивных процедур (коронарография, баллонная пластика коронарных артерий, электрофизиологическое исследование и др.)
- кардиомиопатия, миокардит, перикардит
- синкопальные состояния неясной этиологии
- подозрение на опухоль сердца
- скрининг у ближайших родственников лиц, умерших внезапно или имевших в молодом возрасте признаки сердечной недостаточности
- скрининг спортсменов, участвующих в соревнованиях.
В динамике (повторно) эхоКГ рекомендуют проводить в следующих случаях:
- оценка эффективности лекарственной терапии (например, тромб ушка левого предсердия у больных, готовящихся к кардиоверсии)
- оценка эффективности кардиохирургических вмешательств
- резкое изменение/ухудшение клинического течения заболевания (например, подозрение на разрыв папиллярной мышцы при остром инфаркте миокарда).
- необходимость мониторинга размеров и функции левого желудочка (сердечная недостаточность, диффузный миокардит)
- необходимость мониторинга степени выраженности клапанного стеноза, градиента систолического давления (аортальный стеноз, гипертрофическая кардиомиопатия), лёгочной гипертензии (например, гемодинамически значимый дефект межжелудочковой или межпредсердной перегородки, тяжёлая лёгочная гипертензия и др.)
- скрининг детей лиц, умерших внезапно или имевших в молодом возрасте признаки сердечной недостаточности (ежегодно в течение всего пубертатного периода).
СУТОЧНОЕ МОНИТОРИРОВАНИЕ АРТЕРИАЛЬНОГО ДАВЛЕНИЯ
Суточное мониторирование артериального давления СМАД — методика, используемая для исследования вариабельности АД, влияния поведенческих факторов на АД и изучения эффективности антигипертензивной терапии. Метод также используют для получения величин АД в «домашних» условиях.
МЕТОДИКА
Важнейшие условие для корректного суточного мониторирования АД в амбулаторных условиях — выполнение ряда методических требований, включающих выбор адекватного метода определения АД и соответствующего прибора, обеспечивающего достаточную точность измерения, применение современных методов обработки полученной информации.
МЕТОД ИЗМЕРЕНИЯ АД
В настоящее время подавляющее количество приборов для СМАД основано на осциллометрическом или аускультативном (по Короткову) методе измерения АД (табл. 13).
Таблица 13. Сравнительная характеристика осциллометрического или аускультативного методов измерения АД


КОНТРОЛЬНЫЕ (ВЕРИФИЦИРУЮЩИЕ) ИССЛЕДОВАНИЯ
Контрольные измерения проводят в положении сидя, давление в манжете измеряют ртутным или аттестованным стрелочным манометрами. Рекомендуют не менее четырёх последовательных измерений с интервалом не менее 2мин (после окончания предыдущего). По последним трём измерениям рассчитывают средние приборные и контрольные значения АД. При их отличии более 5мм рт.ст. для ДАД и 10мм рт.ст. для САД необходимо проверить, правильно ли наложены манжеты и ориентированы микрофоны (при аускультативном методе). Если добиться лучшего согласия невозможно, рекомендуют переместить манжету на другую руку или применить прибор с другим методом определения АД.
ПОКАЗАНИЯ
Определённые показания:
- подозрение на «гипертонию белого халата»
- подозрение на амбулаторную (скрытую) АГ
- подозрение на ночную АГ
- определение степени ночного снижения АД
- рефрактерная АГ
- АГ при беременности.
Возможные показания:
- пожилой возраст
- подбор антигипертензивной терапии
- сахарный диабет I типа
- оценка симптомов ортостатической гипотензии.
ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ
При анализе суточного профиля АД, полученного за сутки, используют три основных группы показателей (индексов): средние значения, суточный ритм и вариабельность АД (табл. 14).
Таблица 14. Стандартные показатели, получаемые при СМАД
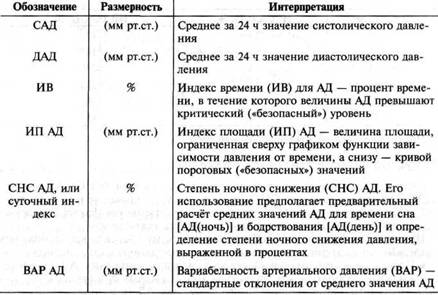
НОРМАЛЬНЫЕ ПАРАМЕТРЫ СМАД
Таблица 15. Средние величины суточного профиля АД (САД/ДАД)

Примечание. День=бодрствование, ночь=сон.
Таблица 16. Нормативные значения индекса времени гипертонии

Таблица 17. Нормативные значения индекса времени гипертонии для разных возрастных групп

Примечание. День=бодрствование, ночь=сон.
СУТОЧНЫЙ РИТМ АРТЕРИАЛЬНОГО ДАВЛЕНИЯ
Оптимальной признают степень ночного снижения СНС АД на 10-22%. При этом сниженная СНС, проявления устойчивых ночных подъёмов АД, а также повышенная СНС потенциально опасны как факторы повреждения органов-мишеней, сердечно-сосудистых «катастроф».
На основании данных о СНС применяют схему классификации больных (отдельно по критериям систолического и диастолического давления):
- нормальная (оптимальная) степень ночного снижения АД (в англоязычной литературе «дипперы») 10%<СНСАД<20% (рис. 2)
- недостаточная степень ночного снижения АД (в англоязычной литературе «нондипперы») 0<СНСАД<10% (рис. 3).
Рис. 2. Суточный профиль АД - диппер.
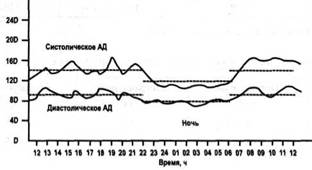
Рис 3. Суточный профиль АД - нондиппер.
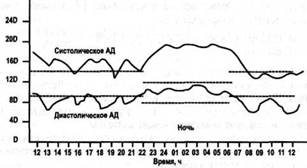
Снижение СНС ниже оптимального диапазона наблюдают у ряда пациентов с первичной АГ (в том числе при атеросклеротическом поражении сонных артерий), оно характерно также для синдрома злокачественного течения гипертонии, хронической почечной недостаточности, вазоренальной гипертонии, синдрома Кушинга, его наблюдают после трансплантации сердца и почек, при застойной сердечной недостаточности, эклампсии, диабетической и уремической нейропатии, при распространённом атеросклерозе у пожилых людей.
Отметим, что степень ночного снижения АД чрезвычайно чувствительна к качеству сна, режиму дня и типу активности в дневное время, относительно плохо воспроизводится при повторных наблюдениях. Учитывая эти обстоятельства, большинство исследователей склонны проводить контрольные повторные мониторирования для подтверждения отклонений суточного профиля АД по данному признаку, обнаруженных при разовом мониторировании.
ВАРИАБЕЛЬНОСТЬ АД
В качестве временных нормативов вариабельности ВАР или STD для пациентов с мягкой и умеренной формами АГ сформированы критические значения:
для САД 15/15мм рт.ст. (день/ночь)
для ДАД 14/12мм рт.ст. (день/ночь).
Пациента относят к группе повышенной вариабельности при превышении хотя бы одного из четырёх критических значений.
Следует отметить, что в группе гипертоников с повышенной вариабельностью САД частота сердечно-сосудистых осложнений выше на 60-70% (1372 пациента, время наблюдения до 8,5 года).
ИСТОЧНИК
Practice guidelines of the European Society of Hypertension for clinic, ambulatory and self blood pressure measurement // J. Hypertens. 2005. Vol. 23. P. 697-670.
ХОЛТЕРОВСКОЕ МОНИТОРИРОВАНИЕ ЭКГ
Холтеровское мониторирование ХМ — непрерывная регистрация ЭКГ с помощью портативного устройства, которое больной носит на себе. После исследования портативное устройство снимают с пациента, электрокардиограмму переносят в стационарное устройство (компьютер) и подвергают анализу накопленную информацию.
МЕТОДИКА И ТЕХНИЧЕСКИЕ АСПЕКТЫ ХОЛТЕРОВСКОГО МОНИТОРИРОВАНИЯ ЭКГ
Современная холтеровская мониторная система — комплекс, состоящий из двух частей: переносного записывающего устройства и стационарного дешифратора. Дешифратор — это компьютер, снабжённый специальным программным обеспечением для анализа длительной записи ЭКГ.
НАЛОЖЕНИЕ ЭЛЕКТРОДОВ И ПОДКЛЮЧЕНИЕ КАБЕЛЕЙ
Электроды накладывают на обезжиренную, желательно скарифицированную кожу в местах наименьшей подвижности. Избегают свободного натяжения и перемещения кабелей.
НАЛОЖЕНИЕ ЭЛЕКТРОДОВ И СИСТЕМА ОТВЕДЕНИЙ
При холтеровском мониторировании используют систему отведений, отличную от стандартной, поэтому запись, зарегистрированная в отведениях при холтеровском мониторировании, отражает электрокардиографическую кривую только в 2 или 3 грудных отведениях (табл. 18). Наиболее частый вариант расположения электродов при 2-канальной записи — из 4 электродов и одного нейтрального, которые формируют два отведения: одно — М(модифицированное)V5, второе — MaVF.
Таблица 18. Корреляция между отведениями холтеровского мониторирования и ЭКГ в 12 стандартных отведениях

ДЛИТЕЛЬНОСТЬ ЗАПИСИ
Длительность холтеровского мониторирования зависит от задачи исследования. При скрининговых обследованиях на угрожающие жизни экстрасистолы достаточно 12ч наблюдения. При наличии синкопальных или полуобморочных состояний для поиска их причин необходимо дольше наблюдать ЭКГ — 24ч и более. Для обнаружения динамики ST достаточно суток.
ДНЕВНИК ПАЦИЕНТА
При холтеровском мониторировании ЭКГ рекомендовано вести дневник, в котором пациент отмечает самочувствие, жалобы, вид активной деятельности, физические нагрузки, приём лекарственных препаратов, время бодрствования и сна.
ЗАДАЧИ ХОЛТЕРОВСКОГО МОНИТОРИРОВАНИЯ
Основные задачи:
- выявление, подсчёт и врачебная оценка нарушений ритма сердца за весь исследуемый промежуток времени
- поиск участков ЭКГ, на которых происходят диагностически значимые смещения сегмента ST (депрессия или подъём).
Дополнительные задачи:
- анализ вариабельности ритма сердца ВРС
- анализ длительности интервалов Q—Т
- анализ поздних потенциалов желудочков.
ПОКАЗАНИЯ ХОЛТЕРОВСКОГО МОНИТОРИРОВАНИЯ
- наличие клинических проявлений, которые могут быть связаны с нарушениями сердечного ритма - жалобы на обморочные и полуобморочные состояния, головокружения неясной природы, сердцебиение, перебои в работе сердца, установленный синдром длительного Q—T, сердцебиение у больных с установленным диагнозом предвозбуждения
- поиск угрожающих жизни нарушений ритма у пациентов без клинических проявлений, относящихся, тем не менее, к группе высокого риска внезапной аритмической смерти - постинфарктные больные с систолической дисфункцией левого желудочка (фракция выброса левого желудочка <40%), пациенты с хронической сердечной недостаточностью, пациенты с дилатационной кардиомиопатией ДКМП или гипертрофической кардиомиопатией ГКМП, пациенты с артериальной гипертонией, с гипертрофией ЛЖ, пациенты с клапанными пороками сердца, пациенты перед кардиохирургическими операциями, пациенты с водно-электролитными расстройствами
- оценка эффективности терапии - оценка антиаритмичекого лечения, оценка проаритмического действия антиаритмических препаратов, оценка .адекватности контроля ЧСС при постоянной форме мерцательной аритмии, оценка работы постоянного электрокардиостимулятора, оценка антиангинальной терапии
- диагностика ишемии миокарда - подозрение на вариантную стенокардию, диагностика бессимптомной ишемии миокарда, наличие болевого синдрома в грудной клетке у пациентов, неспособных выполнить нагрузочную пробу, диагностика «немой» ишемии при наличии положительной вэлоэргометрической ВЭМ пробы
- оценка прогноза заболевания — анализ вариабельности ритма сердца ВРС у постинфарктных больных с систолической дисфункцией левого желудочка (фракция выброса левого желудочка <40%), у пациентов с хронической сердечной недостаточностью.
ПРОТИВОПОКАЗАНИЯ К ПРОВЕДЕНИЮ ХОЛТЕРОВСКОГО МОНИТОРИРОВАНИЯ ЭКГ
- нет, кроме отказа пациента от процедуры.
АНАЛИЗ И ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ ХОЛТЕРОВСКОГО МОНИТОРИРОВАНИЯ
Стандартный протокол-заключение по результатам холтеровского мониторирования содержит следующие положения:
- характеристику синусового ритма
- сведения о нарушениях сердечного ритма и проводимости
- сведения об изменениях реполяризации и их взаимосвязи с симптоматикой (по данным дневника, который пациент должен вести во время исследования)
- сведения о динамике сегмента ST.
В зависимости от целей исследования протокол может включать сведения о работе имплантированного электрокардиостимулятора ЭКС, ВРС или интервала Q—T.
АНАЛИЗ СИНУСОВОГО РИТМА ПО ДАННЫМ ХОЛТЕРОВСКОГО МОНИТОРИРОВАНИЯ
Таблица 19. Нормы частоты синусового ритма по данным холтеровского мониторирования ЭКГ.
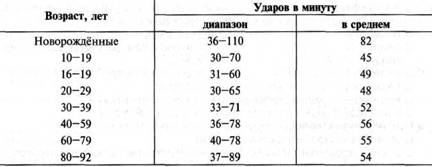
ДИАГНОСТИКА СИНКОПАЛЬНЫХ СОСТОЯНИЙ
Большая вероятность аритмогенной причины эпизодов потери сознания возникает при регистрации следующих нарушений ритма сердца:
- СА-блокада и отказ синусового узла с паузой R—R, превышающей 3с
- АВ-блокада III степени или II степени типа Мобитц II
- желудочковая тахикардия или фибрилляция предсердий с частотой желудочкового ответа >180
- устойчивая желудочковая тахикардия.
ВЫЯВЛЕНИЕ УГРОЖАЮЩИХ ЖИЗНИ НАРУШЕНИЙ СЕРДЕЧНОГО РИТМА
К «угрожающим жизни» нарушениям сердечного ритма относят следующие аритмии:
- пароксизмы желудочковой тахикардии с постепенным учащением ритма, переходящие в трепетание желудочков (особенно эпизоды двунаправленно-веретенообразной желудочковой тахикардии)
- желудочковая тахикардия «уязвимого периода», начинающаяся с ранней желудочковой экстрасистолы
- ранние типа R на Т, групповые и политопные желудочковые экстрасистолы ЖЭ (градации III-V но классификации Лауна и Вольфа), табл. 20
- остро возникшее нарушение внутрижелудочковой проводимости
- пароксизмы фибрилляции и трепетания предсердий у пациентов с синдромом Вольфа—Паркинсона-Уайта
- короткие, спонтанно прекращающиеся эпизоды фибрилляции или асистолии желудочков.
 Таблица
20. Градации тяжести желудочковой эктопической активности (Лаун, Вольф, 1971).
Таблица
20. Градации тяжести желудочковой эктопической активности (Лаун, Вольф, 1971).
ОЦЕНКА ЭФФЕКТИВНОСТИ АНТИАРИТМИЧЕСКОЙ ТЕРАПИИ
В качестве критериев эффективности антиаритмической терапии используют следующие результаты холтеровского мониторирования:
- уменьшение общего числа экстрасистол на 50-75% и более
- уменьшение числа парных и ранних экстрасистол на 90% и более
- полное исчезновение эпизодов желудочковой тахикардии
- сокращение числа морфологических типов экстрасистолических комплексов до 1—2.
ВЫЯВЛЕНИЕ ПРОАРИТМИЧЕСКОГО ЭФФЕКТА АНТИАРИТМИЧЕСКИХ ПРЕПАРАТОВ
Критерии проаритмического эффекта — следующие результаты холтеровского мониторирования:
- не менее чем 4-кратное увеличение общего количества экстрасистол за сутки
- не менее чем 10-кратное увеличение количества парных экстрасистол и эпизодов неустойчивой желудочковой тахикардии
- появление эпизодов устойчивой желудочковой тахикардии, которые не регистрировались ранее.
ВЫЯВЛЕНИЕ ИШЕМИИ МИОКАРДА
Критерии ишемии миокарда при холтеровском мониторировании — депрессия или подъём сегмента ST ишемического типа на 1мм и более при длительности отклонения сегмента ST от изолинии не менее 1мин и времени между отдельными эпизодами не менее 1мин (правило «1x1x1») при наличии корреляции с болевым эпизодом. При отсутствии клинической симптоматики об ишемическом происхождении динамики сегмента ST можно говорить при его отклонении от изолинии не менее 2мм.
АНАЛИЗ И ИНТЕРПРЕТАЦИЯ ВАРИАБЕЛЬНОСТИ РИТМА СЕРДЦА
Вариабельность ритма сердца заключается в колебаниях интервала между последовательными ударами сердца, а также колебаниях между последовательными частотами сердечных сокращений. Термин «вариабельность ритма сердца» стал общепринятым термином при описании изменений как частоты сердцебиений, так и интервалов R—R. ВРС отражает баланс между активностью симпатического и парасимпатического отделов вегетативной нервной системы и может служить показателем степени риска сердечной смерти, в том числе внезапной.
Анализ ВРС при ХС чаще всего проводят во временной и частотной (спектральной) областях. В табл. 21 и 22 приведены временные и спектральныe характеристики ВРС.
Таблица 21. Временные характеристики ВРС
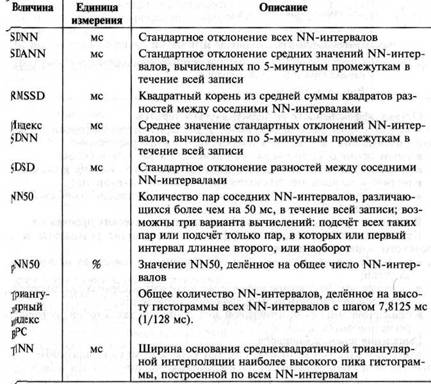
 Таблица
22. Частотные (спектральные) параметры для суточных записей
Таблица
22. Частотные (спектральные) параметры для суточных записей
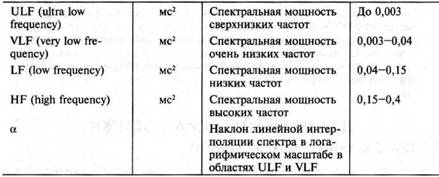
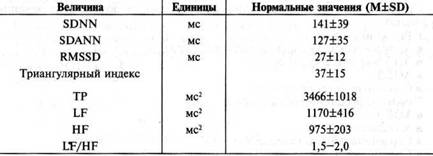 Нормативные
значения ВРС приведены в табл. 23.
Нормативные
значения ВРС приведены в табл. 23.
Таблица 23. Нормативные значения ВРС
ИНТЕРПРЕТАЦИЯ ПРОГНОСТИЧЕСКОЙ ЗНАЧИМОСТИ ПОНИЖЕННОЙ ВРС ПОСЛЕ ИНФАРКТА МИОКАРДА
Сниженная ВРС — независимый от других известных факторов риска показатель смертности и аритмических осложнений. Для оценки прогноза следует оценивать параметры ВРС во времени.
Группа высокого риска может быть определена по SDNN <70мс или треугольному индексу меньше 15.
Для увеличения прогностической значимости ВРС можно сочетать с другими факторами риска.
ВРС следует оценивать не ранее чем через неделю после инфаркта.
ВРС следует оценивать у всех больных с хронической сердечной недостаточностью ХСН. Группу пациентов с высоким риском общей смертности характеризует значение SDNN <50мс. Группу пациентов с высоким риском внезапной смерти характеризует значение LF <20мс2. Для увеличения прогностической значимости ВРС можно сочетать с другими факторами риска.
ДРУГИЕ МЕТОДЫ ДИАГНОСТИКИ
ПРОБА С 6-МИНУТНОЙ ХОДЬБОЙ
В рутинной практике и при отсутствии специального оборудования для оценки толерантности к физической нагрузке и объективизации функционального статуса больных с умеренно выраженными и тяжёлыми заболеваниями сердца и лёгких, ХСН можно использовать тест ходьбы в течение 6мин, соответствующий субмаксимальной нагрузке.
Показания к проведению пробы с 6-минутной ходьбой:
- сравнительная оценка функционального статуса до и после лечения (2 теста) - резекция лёгких, хирургическое уменьшение объёма лёгких, лёгочная реабилитация, ХОБЛ, сердечная недостаточность
- оценка функционального статуса (1 тест) – ХОБЛ, муковисцидоз, сердечная недостаточность, сосудистая недостаточность нижних конечностей, пожилой возраст
- оценка прогноза в отношении развития осложнений и смертность - сердечная недостаточность, ХОБЛ
- первичная лёгочная гипертензия.
УСЛОВИЯ ПРОВЕДЕНИЯ ТЕСТА
Необходимое оборудование: часы с секундной стрелкой, сантиметр/рулетка, сфигмоманометр, пульсоксиметр (при возможности).
При проведении 6-минутной шаговой пробы больному ставится задача пройти как можно большую дистанцию за 6мин, после чего пройденное расстояние регистрируется. Пациентов инструктируют о целях теста. Им предлагают ходить по измеренному (30м) и размеченному через 1м коридору в своём собственном темпе, стараясь пройти максимальное расстояние в течение 6мин. При этом пациентам разрешено останавливаться и отдыхать во время теста, однако они должны возобновлять ходьбу, когда сочтут это возможным. Во время ходьбы разрешают подбадривать пациентов фразами: «Все идёт хорошо», «Продолжайте в том же темпе». Перед началом и в конце теста оценивают одышку по шкале Борга (табл. 24), пульс и, при возможности, насыщение кислородом крови (при наличии пульсоксиметра). В целях безопасности в ближайшей доступности от места проведения пробы должен находиться источник кислорода и дефибриллятор. В каждом конце коридора рекомендуют установить кресло для отдыха.
Абсолютные противопоказания к проведению пробы:
- нестабильная стенокардия или инфаркт миокарда в течение предыдущего месяца
- заболевания опорно-двигательного аппарата, препятствующие выполнению пробы.
Относительные противопоказания к проведению пробы:
- исходная чсс <50 или >120
- систолическое АД >180мм рт.ст., диастолическое АД >120мм рт.ст.
Критерии немедленного прекращения пробы:
- боль в грудной клетке
- невыносимая одышка
- судороги в ногах
- нарушение устойчивости, головокружение
- резкая бледность
- снижение насыщения крови кислородом до 86%.
Дистанцию, пройденную в течение 6мин (6MJVD), измеряют в метрах и сравнивают с должным показателем 6MWD(i). 6MWD(i) вычисляют по нижеприведённым формулам, которые учитывают возраст в годах, массу тела в килограммах, рост в сантиметрах, индекс массы тела ИМТ.
Для мужчин
6MWD(i) = 7,57 х рост — 5,02 х возраст — 1,76 х масса — 309
или
6MWD(i) = 1140 - 5,61 х ИМТ - 6,94 х возраст.
Для женщин
6MWD(i) = 2,11 х рост — 2,29 х масса — 5,78 х возраст + 667
или
6MWD(i) = 1017 - 6,24 х ИМТ - 5,83 х возраст.
ПРЕИМУЩЕСТВА ПРОБЫ С 6-МИНУТНОЙ ХОДЬБОЙ
Проба с 6-минутной ходьбой проста в выполнении, не требует сложного оборудования и может проводиться как в стационарных, так и в амбулаторных условиях. Тест позволяет оценить уровень повседневной активности больных, а его результаты хорошо коррелируют с показателями качества жизни и могут быть использованы в качестве дополнительных критериев оценки эффективности лечения и реабилитации больных.
НЕДОСТАТКИ ПРОБЫ С 6-МИНУТНОЙ ХОДЬБОЙ
Результаты проведения пробы с 6-минутной ходьбой в значительной мере определяются субъективными факторами, основным из которых служит характер мотивации пациента.
Таблица 24. Шкала Борга
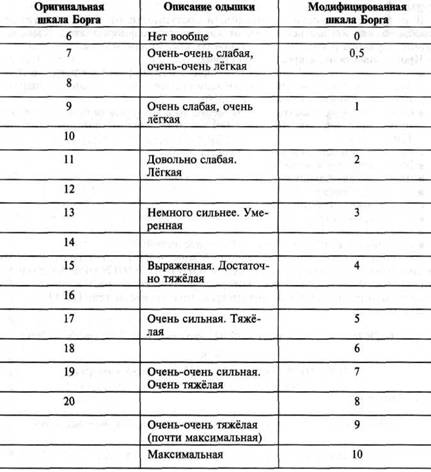
РАДИОИЗОТОПНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Радиоизотопные методы:
- оценка кровоснабжения миокарда на уровне микроциркуляции — перфузионная сцинтиграфия миокарда
- оценка кровоснабжения и сократительной способности миокарда — синхронизированная томосцинтиграфия с перфузионными агентами
- оценка сократительной способности миокарда — радионуклидная вентрикулография по первому прохождению, равновесная вентрикулография, томовентрикулография
- оценка метаболизма миокарда — позитронная эмиссионная томография, томосцинтиграфия с мечеными жирными кислотами
- перфузионная сцинтиграфия миокарда — метод, предназначенный для выявления областей относительного или абсолютного снижения кровотока вследствие ишемии или рубцового повреждения миокарда. Метод основан на способности вводимого внутривенно радиофармпрепарата РФП распределяться в неповреждённых кардиомиоцитах пропорционально коронарному кровотоку. Области нарушенного кровоснабжения визуализируются, как области сниженной концентрации РФП, или дефекты перфузии.
Варианты перфузионной сцинтиграфии миокарда:
- планарная перфузионная сцинтиграфия миокарда
- однофотонная эмиссионная компьютерная томография миокарда.
Таблица 25. Основные перфузионные агенты.
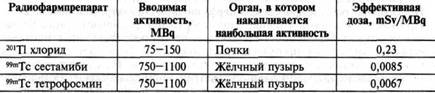
Показания к проведению перфузионной сцинтиграфии миокарда:
- диагностика коронарной болезни сердца (включая дифференциальную диагностику болевого синдрома в грудной клетке) чувствительность метода составляет 84%, специфичность 77%:
оценка наличия, коронарной болезни сердца - промежуточная или высокая претестовая вероятность наличия ИБС у пациентов с исходными изменениями на ЭКГ, промежуточная или высокая претестовая вероятность наличия ИБС у пациентов женского пола, неспособных достичь субмаксимальной чсс или страдающих сахарным диабетом, промежуточная претестовая вероятность наличия ИБС у пациентов с впервые выявленной сердечной недостаточностью
оценка локализации поражения (бассейн коронарной артерии) и распространённости поражения (количество бассейнов коронарных артерий)
оценка гемодинамического влияния стенотического поражения на региональную перфузию
оценка жизнеспособности миокарда: дифференцирование между ишемическими и рубцовыми изменениями, прогнозирование эффекта в отношении улучшения сократительной функции после реваскуляризации
- оценка и стратификация риска и определение прогноза:
после инфаркта миокарда перед большими внесердечными хирургическими вмешательствами у больных с высоким риском развития коронарных осложнений, оценка риска у лиц без клинических проявлений ИБС, имеющих умеренный и высокий риск развития ИБС и относящихся к профессиям высокого риска (например, пилоты)
- оценка раннего и долговременного эффекта лечения: реваскуляризации у больных с рецидивом клинической симптоматики, медикаментозной терапии, диеты и мероприятий по изменению образа жизни
- диагностированная или подозреваемая застойная сердечная недостаточность: дифференциальная диагностика между ишемической и неишемической кардиомиопатией, оценка функции левого желудочка (исходно и в динамике) при необходимости назначения препаратов, заведомо обладающих кардиотоксическим действием (например, доксорубицин).
Противопоказания к проведению перфузионной сцинтиграфии миокарда:
- беременность и кормление грудью
Остальные противопоказания зависят от протокола исследования и включают стандартные противопоказания к проведению нагрузочных проб. Не следует забывать, что при проведении перфузионной сцинтиграфии существуют технические ограничения по весу пациента (в зависимости от фирмы-производителя гамма-камеры верхний предел массы тела колеблется от 120 до 180кг).
МЕТОДИКА ПРОВЕДЕНИЯ ПЕРФУЗИОННОЙ СЦИНТИГРАФИИ МИОКАРДА
В зависимости от задач исследования перфузионную сцинтиграфию миокарда выполняют по различным протоколам в один или два дня:
покой — нагрузка, нагрузка – покой, нагрузка — перераспределение, покой — перераспределение, повторное введение.
В зависимости от задач исследования и возможностей пациента, проводят пробу либо с физической нагрузкой, либо с фармакологической.
Проба с физической нагрузкой:
- субмаксимальная (достижение субмаксимальной частоты сердечных сокращений)
- до появления симптомов ухудшения коронарного кровоснабжения
- максимальная.
Проба с фармакологической нагрузкой:
- вазодилататоры – аденозин, дипиридамол
- ино-, хронотропные агенты – добутамин, добутамин + атропин.
Определение дальнейшей тактики ведения пациентов в зависимости от результатов перфузионной сцинтиграфии миокарда представлено в табл. 26.
Таблица 26. Определение тактики ведения пациента на основании результатов перфузионной сцинтиграфии миокарда.
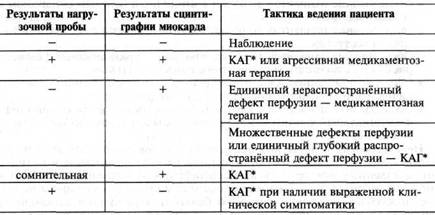
* КАГ — коронароангиография
МУЛЬТИСПИРАЛЬНАЯ КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ И ЭЛЕКТРОННО-ЛУЧЕВАЯ ТОМОГРАФИЯ
Мультспиральная компьютерная томография МСКТ и электронно-лучевая томография ЭЛТ в кардиологической практике применяются для неинвазивной визуализации коронарных артерий.
Области применения МСКТ и ЭЛТ:
- диагностика коронарного атеросклероза на основании выявления и количественной оценки кальциноза стенки коронарных артерий
- неинвазивная коронароангиография
- неинвазивная шунтография (артериальные и венозные шунты)
- оценка анатомии и функции камер сердца при врождённых и приобретённых заболеваниях сердца
- компьютерная томография-ангиография (КТ-ангиография) аорты, лёгочной артерии, периферических артерий и вен
- неинвазивная оценка коронарного атеросклероза.
Методы быстрой компьютерной томографии МСКТ и ЭЛТ при условии синхронизации с ЭКГ позволяют выявлять и количественно оценивать наличие кальция в стенках коронарных артерий и, тем самым, оценивать наличие и тяжесть коронарного атеросклероза.
ПОКАЗАНИЯ К ОПРЕДЕЛЕНИЮ КОРОНАРНОГО КАЛЬЦИНОЗА
- определение степени кальциноза коронарных артерий показано тем пациентам, у которых результаты данного исследования могут оказать влияние на дальнейшую тактику их ведения
- скрининговое обследование лиц из группы умеренного риска с отсутствием клинических проявлений ИБС (мужчины в возрасте 35-65лет и женщины в возрасте 45—70лет) с целью раннего выявления коронарного атеросклероза
- обследование пациентов до 65лет с атипичным болевым синдромом в грудной клетке
- обследование пациентов до 65лет с сомнительными результатами нагрузочных тестов
- обследование пациентов до 65лет с наличием традиционных факторов риска при отсутствии установленного диагноза ИБС
- обследование пациентов с отягощенным семейным анамнезом по наличию ранних осложнений коронарного атеросклероза
- обследование пациентов с кардиомиопатией неясной этиологии (дифференциальный диагноз между ишемической и неишемической кардиомиопатией).
Нецелесообразно проводить исследование коронарного кальция у пациентов молодого возраста без отягощенной наследственности или наличия множественных факторов риска (кальцификацию коронарных артерий в молодом возрасте встречают редко, поэтому отсутствие кальциноза не может исключить наличие коронарной болезни), у пациентов преклонного возраста (результаты исследования редко влияют на тактику лечения) и у лиц с подтверждённым диагнозом ИБС.
ПРОТИВОПОКАЗАНИЯ К ПРОВЕДЕНИЮ МСКТ И ЭЛТ
Абсолютных противопоказаний к проведению исследования нет.
Относительные противопоказания:
- беременность
- наличие факторов, делающих по какой-либо причине невозможным сохранение неподвижности во время исследования и задержку дыхания в течение 15—30с
- избыточная масса тела, превышающая максимально допустимую нагрузку на стол томографа для данной модели.
При проведении контрастной КТ-ангиографии дополнительными противопоказаниями служат:
- гиперчувствительность к контрастному препарату
- почечная недостаточность (сывороточный креатинин более 1,5мг/дл)
- застойная сердечная недостаточность
- анамнестические указания на тромбоэмболические осложнения
- множественная миелома
- гипертиреоз
- феохромоцитома
- фибрилляция предсердий.
Эффективная доза при проведении ЭЛТ составляет 1,0—1,3мЭв (при КТ-ангиографии 1,5—2,0мЭв), при проведении МСКТ 1,5—6,2мЭв (при КТ-ангиографии 6,7-13,0мЭв).
ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ
Программное обеспечение томографа позволяет определять как площадь, так и плотность кальцифицированных участков стенки коронарной артерии. Согласно стандартизованной количественной системе измерений коронарного кальциноза, основанной на коэффициенте рентгеновского поглощения и площади кальцинатов, количество коронарного кальция выражается в безразмерных единицах индекса обызвествления (кальцификации) коронарных артерий (кальциевый индекс, индекс Агатстона, КИ).
Таблица 27. Стратификация риска сердечно-сосудистых осложнений в зависимости от выраженности коронарного кальциноза
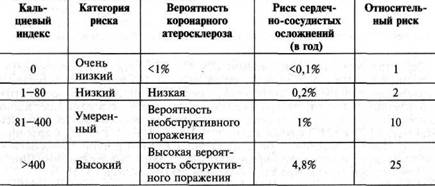
Пациентам с КИ выше 400 рекомендуют проведение дальнейшего обследования (нагрузочное тестирование) для стратификации риска и определения тактики лечения.
КОРОНАРНАЯ КТ-АНГИОГРАФИЯ
Коронарную КТ-ангиографию используют для уточнения показаний к проведению инвазивной коронарной ангиографии у пациентов с низкой вероятностью хирургического вмешательства на коронарных сосудах и для неинвазивной оценки проходимости шунтов после операции коронарного шунтирования.
ПРОФИЛАКТИКА СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ
Сердечно-сосудистые заболевания ССЗ — основная причина преждевременной смерти в большинстве стран Европы. По данным Федеральной службы государственной статистики, смертность от сердечно-сосудистых заболеваний в России на протяжении последнего десятилетия постоянно растёт. Число новых случаев сердечно-сосудистых заболеваний увеличилось за 4года на 27% (2483 случая в 2000г. и 3146 случаев в 2004г.). Сердечно-сосудистые заболевания — одна из главных причин потери трудоспособности. Они же в основном определяют и рост затрат на здравоохранение.
Почему необходима стратегия активной профилактики ССЗ? Причиной сердечно-сосудистых заболеваний в основном выступает атеросклероз. Поражение сосудов много лет прогрессирует скрыто и к моменту появления клиники оказывается на поздней стадии. Острые сосудистые катастрофы, такие, как инфаркт миокарда, инсульт и кардиальная смерть, почти всегда внезапны, причём помощь при их развитии оказать либо не удаётся, либо лечебные мероприятия дают лишь паллиативный эффект. Генез ССЗ тесно связан со стилем жизни человека и во многом определяется модифицируемыми факторами риска. Устранение факторов риска снижает смертность и заболеваемость в популяции больных с сердечно-сосудистой патологией.
ЦЕЛИ ПРОФИЛАКТИКИ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ
Цель профилактики ССЗ — снижение частоты новых или повторных случаев коронарной болезни сердца, ишемического инсульта и атеросклероза периферических артерий. Первичная и вторичная профилактика сердечно-сосудистых заболеваний Современные представления о патогенезе атеросклероза и его осложнений размывают традиционное разделение профилактики на первичную и вторичную. В категорию высокого риска развития сосудистых катастроф входят как больные с клиническими проявлениями, так и лица без симптоматики, но обладающие набором факторов риска ССЗ. При одинаковой выраженности атеросклеротического процесса у тех и других разница состоит лишь в том, успели появиться симптомы или нет. Категории пациентов, в первую очередь нуждающихся в профилактике Основные усилия в профилактике должны быть направлены на предотвращение ССЗ у представителей группы высокого риска. В эту группу входят:
- больные, страдающие ишемической болезнью сердца, осложнениями атеросклероза периферических артерий, цереброваскулярной болезнью
- пациенты без клинических проявлений, но имеющие высокий суммарный риск ССЗ атеросклеротического генеза (риск смертельного исхода от ССЗ в течение 10 лет >5%)
- пациенты с сахарным диабетом обоих типов.
К указанной группе относят также лиц с одним из двух перечисленных ниже факторов риска:
- уровень общего холестерина >8,0ммоль/л или холестерина ЛПНП>6,0ммоль/л
- АД >180/110ммрт.ст.
При этих состояниях опасность развития ССЗ повышается, независимо от других факторов риска.
В оценке сердечно-сосудистого риска нуждаются также близкие родственники больных с сердечно-сосудистой патологией, развившейся в молодом возрасте, и всех представителей группы высокого риска.
ОЦЕНКА СУММАРНОГО РИСКА У ЛИЦ, НЕ ИМЕЮЩИХ СИМПТОМОВ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ
С целью оценки суммарного риска ССЗ у человека, не имеющего соответствующей симптоматики, предложено несколько моделей. В России рекомендуют использовать шкалу SCORE (Systematic COronary Risk Evaluation), разработанную экспертами Европейского общества кардиологов (см. форзац). Шкала позволяет оценить вероятность смерти от ССЗ в течение 10лет. В ней учитывают следующие факторы риска: пол, возраст, курение, систолическое АД и общий холестерин (инструкция по использованию шкалы — см. форзац). К категории высокого риска относят пациентов, имеющих общий риск >5%.
ДОПОЛНИТЕЛЬНЫЕ МЕТОДЫ ВЫЯВЛЕНИЯ ПАЦИЕНТОВ ВЫСОКОГО РИСКА
В дополнение к оценке суммарного риска по шкале SCORE у пациентов, не имеющих соответствующей симптоматики, применяют ряд инструментальных методик регистрации факторов, определяющих неблагоприятный прогноз. ЭКГ и эхокардиография позволяют выявить гипертрофию левого желудочка. Толщина комплекса интима-медиа сонных артерий, которую измеряют с помощью ультразвука, позволяет оценить степень тяжести атеросклеротического поражения артерий. Кальциноз коронарных артерий, выявляемый при мультиспиральной или электронно-лучевой компьютерной томографии (см. раздел Диагностика), также относят к показателям выраженности атеросклероза.
ТАКТИКА СНИЖЕНИЯ СЕРДЕЧНО-СОСУДИСТОГО РИСКА
Эффективные меры по изменению образа жизни. Мероприятия по изменению образа жизни одинаково необходимы как лицам, входящим в группу высокого риска, но без клиники ССЗ, так и больным с ССЗ. Чтобы повысить эффективность этих мероприятий, необходимо следовать определённым рекомендациям.
Будьте союзниками с пациентом в достижении поставленных целей.
Добивайтесь выполнения рекомендаций по изменению стиля жизни.
Пациент должен осознавать взаимосвязь между стилем жизни и заболеванием.
Помогите пациенту преодолеть барьеры, мешающие устранению факторов риска.
Разработайте индивидуальный план по изменению стиля жизни.
Используйте различные подходы для формирования мотивации у пациента изменить стиль жизни.
Контролируйте процесс устранения факторов риска, регулярно контактируя с пациентом.
При необходимости привлекайте других специалистов.
ОТКАЗ ОТ КУРЕНИЯ
Всем курильщикам необходим отказ от этой зависимости.
Помощь пациенту должна включать следующие элементы:
- постоянно проводите работу по выявлению курильщиков
- определите степень зависимости человека от курения и его желания бросить курить
- настоятельно рекомендуйте всем курильщикам бросить курить
- тактика отказа от курения может включать поведенческие методики, терапию препаратами, содержащими никотин, и другими лекарственными средствами
- составьте для пациента расписание последующих визитов к врачу.
ИЗМЕНЕНИЕ РАЦИОНА ПИТАНИЯ
Диетические рекомендации должны стать составной частью общей программы по снижению сердечно-сосудистого риска. Консультация диетолога показана больным с артериальной гипертензией АГ, сахарным диабетом и гиперхолестеринемией.
Общие рекомендации по диете:
- пища должна быть разнообразной, потребление энергии должно быть скорректировано для поддержания идеальной массы тела
- увеличить потребление овощей и фруктов, продуктов из цельного зерна (включая хлеб), молочных продуктов с пониженным содержанием жира, рыбы и постного мяса
- жирная рыба и омега-3 жирные кислоты обладают особенно выраженными защитными свойствами
- общее потребление жира не должно превышать 30% от общей калорийности
- потребление насыщенных жиров не должно превышать 1/3 от общего количества жиров
- потребление холестерина должно быть менее 300мг/сут
- при соблюдении низкокалорийной диеты насыщенные жиры могут быть частично заменены сложными углеводами, мононенасыщеннымии полиненасыщенными жирами, содержащимися в овощах и морепродуктах
УВЕЛИЧЕНИЕ ФИЗИЧЕСКОЙ АКТИВНОСТИ
Всем пациентам, которые страдают ССЗ, и представителям группы высокого риска рекомендуют увеличение физической активности под контролем врача. Целевой уровень нагрузок — не менее получаса физических упражнений каждый или почти каждый день. Благоприятным, но менее выраженным, эффектом обладает и меньшая нагрузка. Физическая нагрузка здорового человека должна приносить ему приятные эмоции и ощущения, органично вписываться в привычный стиль жизни (30-45мин 4-5раз в неделю при чсс 60-75% от максимальной). Больным, страдающим ССЗ, подбирают физическую нагрузку с учётом результатов нагрузочной пробы.
ИЗБЫТОК МАССЫ ТЕЛА И ОЖИРЕНИЕ
Пациентам с ожирением (индекс массы тела =отношение массы тела к росту в квадрате, >30кг/м2), лицам с небольшим избытком массы тела (индекс массы тела >25кг/м2, но <30кг/м2), а также страдающим абдоминальным ожирением (окружность талии >102см у мужчин и >88см у женщин) настоятельно рекомендуют похудеть. Успех в борьбе с лишним весом во многом зависит от степени мотивации самого человека.
ВОЗДЕЙСТВИЕ НА ДРУГОЕ ФАКТОРЫ РИСКА У ЛИЦ, НЕ СТРАДАЮЩИХ ССЗ, НО ОТНОСЯЩИХСЯ К ГРУППЕ ВЫСОКОГО РИСКА
АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ (см. также раздел Артериальная гипертензия)
Решение вопроса о начале антигипертензивной терапии нужно основывать не только на результатах измерения АД, но и на оценке суммарного риска ССЗ, а также учитывать возможное поражение органов-мишеней. Медикаментозную терапию назначают без промедления, когда систолическое АД составляет 180мм рт.ст. или более, а диастолическое 110мм рт.ст. или более. В данном случае оценку суммарного риска ССЗ во внимание не принимают.
В большинстве случаев пациенты с систолическим АД <140мм рт.ст. и/или диастолическим АД <90мм рт.ст. не нуждаются в назначении антигипертензивной терапии. В то же время у пациентов, имеющих высокий или очень высокий риск сердечно-сосудистых осложнений, и страдающих сахарным диабетом при снижении АД <140 и 90мм рт.ст. достигается дополнительное снижение риска сердечно-сосудистых осложнений. Тактика ведения бессимптомных пациентов, имеющих повышенное АД, представлена на рис. 4.
Рис. 4. Тактика ведения бессимптомных пациентов при наличии повышенного АД. Оцените суммарный риск ССЗ с помощью шкалы SCORE.
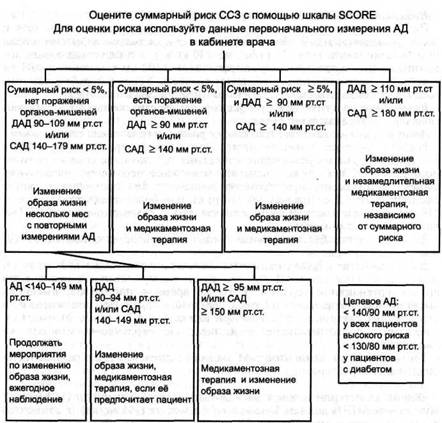
ДИСЛИПИДЕМИЯ
Общий холестерин плазмы должен быть ниже 5,0ммоль/л (190мг/дл).
Холестерин ЛПНП должен быть ниже 3,0ммоль/л (115 мг/дл).
У пациентов с диабетом нужно стремиться к более низким уровням общего холестерина (<4,5ммоль/л, или 175мг/дл) и холестерина ЛПНП (<2,5ммоль/л, или 100мг/дл).
Для триглицеридов и холестерина ЛПВП не разработаны целевые уровни, но эти показатели применяют как маркеры сердечно-сосудистого риска. При уровне холестерина ЛПВП <1,0ммоль/л (40 мг/дл) у мужчин и <1,2ммоль/л (46мг/дл) у женщин, а также уровне триглицеридов >1,7ммоль/л (150мг/дл) риск сердечно-сосудистой патологии повышается.
У лиц с высоким риском ССЗ в отсутствие симптоматики, у которых исходные уровни общего холестерина и холестерина ЛПНП приближаются соответственно к 5,0 и 3,0ммоль/л, дальнейшее снижение риска достигается назначением гиполипидемических препаратов в средних дозах. Цель состоит в достижении уровня общего холестерина <4,5 ммоль/л и холестерина ЛПНП <2,5 ммоль/л.
Тактика ведения пациентов с дислипидемией без клинических проявлений ССЗ представлена на рис. 5.
Первоначально определяют суммарный риск ССЗ. Если риск наступления смертельного исхода от ССЗ в течение 10 лет не превышает 5%, необходимо дать диетические рекомендации, определить уровень физической активности, рекомендовать отказ от курения, чтобы снизить риск до минимального уровня. Повторную оценку риска проводят с интервалом в 5 лет.
Важно! Процедура оценки риска не обязательна для пациентов с семейной гиперхолестеринемией, так как при общем холестерине >8,0ммоль/л (320мг/дл) и холестерине ЛПНП >6,0ммоль/л (240мг/дл) пациенты автоматически попадают в категорию высокого риска сердечной сосудистой патологии.
Если риск наступления смертельного исхода от ССЗ в течение 10 лет превышает 5%, необходимо выполнить анализ липидного профиля и настоятельно рекомендовать пациенту внести существенные изменения в свой стиль жизни, особенно это касается рациона питания. Если в результате общий холестерин и холестерин ЛПНП станет ниже 5,0 и 3,0ммоль/л, соответственно и суммарный риск снизится до уровня <5%, необходимо наблюдение за пациентом с интервалом в 1 год. Если суммарный риск остаётся на уровне, превышающем 5%, с пациентом следует обсудить вопрос о назначении гиполипидемической терапии. Целевые уровни: общий холестерин <4,5ммоль/л, холестерин ЛПНП <2,5ммоль/л.
Рис. 5. Тактика ведения бессимптомных пациентов с дислипидемией.

САХАРНЫЙ ДИАБЕТ
Для предотвращения сердечно-сосудистых осложнений необходим тщательный контроль гликемии. При диабете 1 типа необходимо проводить адекватную терапию инсулином. При диабете 2 типа диетические рекомендации, снижение массы тела и увеличение физической активности нужно обсуждать в первую очередь. Если нет надлежащего контроля гликемии, специалист-эндокринолог назначает медикаментозную терапию. Цели лечения у пациентов с сахарным диабетом 2 типа представлены в табл. 28.
Таблица 28. Цели лечения у пациентов с сахарным диабетом 2 типа

МЕТАБОЛИЧЕСКИЙ СИНДРОМ
Сочетание нескольких факторов риска, объединенное общим патогенетическим звеном — резистентностью тканей к инсулину — принято выделять как метаболический синдром. Современные критерии метаболического синдрома представлены в табл. 29.
Таблица 29. Критерии метаболического синдрома
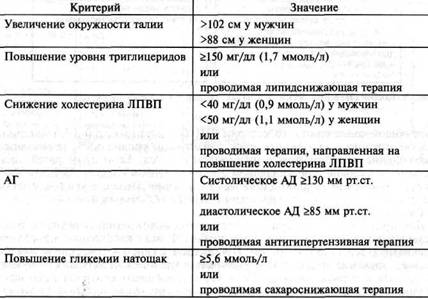
Больных с метаболическим синдромом, как правило, относят к категории высокого сердечно-сосудистого риска. Основа лечения — комплексные мероприятия по изменению стиля жизни, которые положительно влияют на все проявления метаболического синдрома.
ПРОФИЛАКТИЧЕСКАЯ ФАРМАКОТЕРАПИЯ
Ацетилсалициловую кислоту в низких дозах следует назначать всем пациентам с суммарным риском ССЗ 25%, больным сахарным диабетом и хорошо контролируемой АГ.
ДРУГИЕ ФАКТОРЫ РИСКА У ПАЦИЕНТОВ, СТРАДАЮЩИХ СЕРДЕЧНО-СОСУДИСТЫМИ ЗАБОЛЕВАНИЯМИ
КОНТРОЛЬ АРТЕРИАЛЬНОГО ДАВЛЕНИЯ
Целевые уровни АД — для всех пациентов АД <140 и 90мм рт.ст. и для пациентов с диабетом или хроническими заболеваниями почек АД < 130 и 80мм рт.ст.
При уровне АД >140 и 90мм рт.ст. (или АД >130/80мм рт.ст. для пациентов с сахарным диабетом и поражением почек) достижения целевого АД добиваются терапией б-адреноблокаторами и/или ингибиторами АПФ с добавлением антигипертензивных препаратов других классов, таких как блокаторы кальциевых каналов и блокаторы AT-рецепторов.
ТЕРАПИЯ ДИСЛИПИДЕМИИ
У всех пациентов необходимо заранее определять липидный профиль. Забор крови производят натощак. При госпитализации по поводу острого коронарного синдрома (либо другого острого ССЗ) гиполипидемическую терапию начинают в стационаре и продолжают её на поликлиническом этапе. Рекомендуют придерживаться следующих принципов:
- холестерин ЛПНП должен быть ниже 2,5ммоль/л (100мг/дл)
- обосновано дальнейшее снижение холестерина ЛПНП до уровня <1,8ммоль/л (70мг/дл)
- если исходный уровень холестерина ЛПНП >2,5ммоль/л (100мг/дл), показана гиполипидемическая терапия (статины)
- если уровень холестерина ЛПНП на фоне лечения остаётся >2,5ммоль/л (100мг/дл), рекомендована более интенсивная терапия, включая комбинацию препаратов (статин плюс эзетимиб, секвестранты желчных кислот или никотиновая кислота)
- если исходный уровень холестерина ЛПНП от 1,8 до 2,5ммоль/л (70-100мг/дл), обосновано дальнейшее его снижение
- если уровень триглицеридов от 2,26 до 5,64ммолъ/л (200—499мг/дл), разница (общий ХС — ХС ЛПВП) должна быть <3,37ммоль/л (130мг/дл)
- обосновано дальнейшее снижение разницы (общий ХС — ХС ЛПВП)до уровня. <2,5ммоль/л (100мг/дл). Терапевтические возможности для снижения разницы (общий ХС - ХС ЛПВП): более интенсивная терапия, направленная на снижение холестерина ЛПНП, никотиновая кислота или терапия фибратами (после назначения статинов)
- если уровень триглицеридов >5,65ммоль/л (500мг/дл), до назначения статинов необходимо подключить фибраты или ниацин. Цель — уменьшение названной разницы по возможности до уровня <3,37ммоль/л(130мг/дл).
ТЕРАПИЯ САХАРНОГО ДИАБЕТА
Целевой уровень НbА1С <7%, достигается комбинацией мероприятий по изменению образа жизни и медикаментозной терапией. Необходима координация действий терапевта и эндокринолога.
ПРОФИЛАКТИЧЕСКАЯ ФАРМАКОТЕРАПИЯ
Антиагреганты/антикоагулянты
- если нет противопоказаний, всем пациентам необходима терапия низкими дозами ацетилсалициловой кислоты (50-100мг)
- пациентам, перенёсшим коронарное шунтирование, ацетилсалициловая кислота должна быть назначена не позднее 48ч после операции для предупреждения тромбоза венозного шунта. Рекомендуемая доза 100-325мг, длительность терапии в этих дозах минимум 1 год
- клопидогрел в дозе 75мг в комбинации с ацетилсалициловой кислотой пациентам, перенёсшим по поводу острого коронарного синдрома чрескожную коронарную ангиопластику с установкой стента, назначают на срок до 12мес (>1мес для металлического стента, >3мес для стента с покрытием сиролимусом, >6мес для стента с покрытием паклитакселом). После ангиопластики с установкой стента необходима терапия ацетилсалициловой кислотой в высокой дозе (325мг) в течение 1мес для металлического стента, 3мес для стента с покрытием сиролимусом и 6мес для стента с покрытием паклитакселом
- терапия варфарином под контролем международного нормализованного отношения MHO в пределах 2,0—3,0 показана пациентам с пароксизмальной или постоянной формой фибрилляции или трепетания предсердий и пациентам с постинфарктным кардиосклерозом в сочетании с трепетанием предсердий или пристеночным тромбозом левого желудочка
- при назначении варфарина вместе с ацетилсалициловой кислотой и/или клопидогрелом увеличивается риск кровотечений. В связи с этим применение подобных комбинаций требует особой осторожности
- препараты, действующие на ренин-ангиотензин-альдостероновую систему
ИНГИБИТОРЫ АПФ
Терапию ингибиторами АПФ в отсутствие противопоказаний назначают всем больным с фракцией выброса левого желудочка <40% и страдающим АГ, сахарным диабетом и хроническими заболеваниями почек. Возможно их применение всеми пациентами с ССЗ. Ингибиторы АПФ могут быть дополнительно назначены больным с нормальной фракцией выброса левого желудочка, но перенёсшим реваскуляризирующие вмешательства на коронарных артериях.
БЛОКАТОРЫ АНГИОТЕНЗИНОВЫХ РЕЦЕПТОРОВ
Блокаторы AT-рецепторов показаны всем больным в случае непереносимости или недостаточной эффективности ингибиторов АПФ, в том числе больным, страдающим сердечной недостаточностью или постинфарктным кардиосклерозом при фракции выброса левого желудочка <40%. При нарушении систолической функции сердца возможна комбинация блокаторов AT-рецепторов с ингибиторами АПФ.
АНТАГОНИСТЫ АЛЬДОСТЕРОНА
Антагонисты альдостерона назначают пациентам, перенёсшим инфаркт миокарда без нарушения функции почек или гиперкалиемии, уже получающим терапевтические дозы ингибитора АПФ и б-адреноблокатора при фракции выброса левого желудочка <40% или больным с сахарным диабетом и сердечной недостаточностью.
Б-АДРЕНОБЛОКАТОРЫ
Терапию б-адреноблокаторами в отсутствие противопоказаний назначают всем больным, перенёсшим инфаркт миокарда и острый коронарный синдром, страдающим дисфункцией левого желудочка независимо от выраженности сердечной недостаточности. Вопрос о терапии б-адреноблокаторами можно обсудить и в отношении больных с другими ССЗ и сахарным диабетом.
ВАКЦИНАЦИЯ ПРОТИВ ГРИППА
С целью профилактики тяжёлых осложнений всем больным с ССЗ показана вакцинация против гриппа.
ОРГАНИЗАЦИЯ ПРОФИЛАКТИЧЕСКИХ МЕРОПРИЯТИЙ НА ЭТАПЕ ПОЛИКЛИНИКИ
Врачи первичного звена ответственны за выявление бессимптомных, клинически здоровых лиц, имеющих высокий риск ССЗ. Основной инструмент для выявления пациентов высокого риска — шкала SCORE. При суммарном риске смерти от ССЗ в течение 10лет, превышающем 5%, врач первичного звена должен рассмотреть вопрос о медикаментозной терапии, если мероприятия по изменению образа жизни не дают эффекта. Однако принимаемое врачом решение зависит от ряда дополнительных факторов. Значение могут иметь сопутствующие заболевания, ожидаемая продолжительность жизни и т.п.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ. КАК СНИЗИТЬ РИСК СМЕРТИ ОТ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ
Прекратите курить, если Вы курите.
Соблюдайте диету с низким содержанием жира и обогащенную овощами и фруктами.
Ежедневно выполняйте физические нагрузки, по меньшей мере по 30 мин.
Держите под контролем диабет и артериальную гипертонию, если Вы страдаете этими заболеваниями.
Контролируйте свой холестерин, если он повышен.
Регулярно посещайте врача для оценки сердечно-сосудистого риска, лечения имеющихся сердечных заболеваний и снижения риска сердечного приступа и внезапной смерти.
ИСТОЧНИКИ
European
guidelines on cardiovascular disease prevention in clinical practice: third
joint task force of European and other societies on cardiovascular disease
prevention in clinical practice (constituted by representatives of eight
societies and by invited experts) // Eur. J. Cardiovasc. Prev. Rehabil. 2003.
Vol. 10, N 4. P. S1-S10.
JBS 2:
Joint British Societies' guidelines on prevention of cardiovascular disease in
clinical practice // Heart. 2005. Vol. 91, suppl. 5. P. vl-52.
Diagnosis
and management of the metabolic syndrome: an American Heart
Association/National Heart, Lung, and Blood Institute Scientific Statement //
Circulation. 2005. Vol. 112, N 17. P. 2735-2752.
AHA/ACC
guidelines for secondary prevention for patients with coronary and other
atherosclerotic vascular disease: 2006 update endorsed by the National Heart,
Lung, and Blood Institute // J. Am. Coll. Cardiol. 2006. Vol. 47, N 10. P.
2130-2139.
Torpy J.M., Lynm C, Glass R.M. JAMA patient page. Risk factors for heart disease // JAMA. 2003. Vol. 290, N 7. P. 980.
АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ
Артериальная гипертензия — синдром повышения артериального давления АД при гипертонической болезни и симптоматических артериальных гипертензиях. Термин «Гипертоническая болезнь» соответствует употребляемому в других странах понятию «Эссенциальная артериальная гипертензия».
Взаимосвязь между уровнем АД и риском возникновения сердечно-сосудистых заболеваний линейна и не зависит от других факторов риска. Чем выше АД, тем больше вероятность инфаркта миокарда, инсульта, сердечной недостаточности и поражения почек. В связи с этим выделяют оптимальное, нормальное и высокое нормальное АД (табл. 30).
Таблица 30. Определение и классификация уровней АД
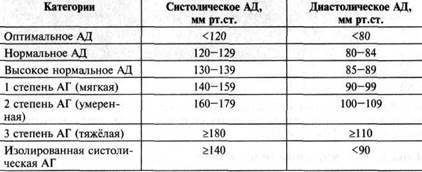
КОДЫ МКБ-10
I10 Эссенциальная (первичная) гипертензия
I11 Гипертензивная болезнь сердца (гипертоническая болезнь с преимущественным поражением сердца)
I12 Гипертензивная (гипертоническая) болезнь с преимущественным поражением почек
I13 Гипертензивная (гипертоническая) болезнь с преимущественным поражением сердца и почек
I15 Вторичная гипертензия
ЭПИДЕМИОЛОГИЯ
Распространённость артериальной гипертензии АГ в Российской Федерации составляет 39,3% среди мужчин и 41,1% среди женщин, при этом должным образом АД контролируют только у 17,5% женщин и 5,7% мужчин.
Систолическое АД неуклонно повышается с возрастом, в то время как диастолическое АД повышается до 60лет у мужчин и до 70лет у женщин, после чего наблюдается тенденция к его снижению.
ПРОФИЛАКТИКА
См. раздел «Профилактика сердечно-сосудистых заболеваний».
СКРИНИНГ
Измерение АД нужно проводить как минимум один раз в 5лет у всех пациентов, обратившихся к врачу по другому поводу или при профилактических осмотрах. При высоком нормальном АД (130-139 и 85-89мм рт.ст.) или указании на повышение АД в прошлом, необходим ежегодный контроль АД.
КЛАССИФИКАЦИЯ
Классификация АГ основана на уровне АД, выделяют 3 степени повышенного АД (см. табл. 30). Отдельно выделяют изолированную систолическую АГ.
СТРАТИФИКАЦИЯ РИСКА
У каждого больного с АГ необходима оценка общего сердечно-сосудистого риска, степень которого зависит от наличия или отсутствия сопутствующих факторов риска, поражения органов-мишеней ПОМ и ассоциированных клинических состояний.
При стратификации, т.е. определении степени общего сердечно-сосудистого риска, пациент может быть отнесён в одну из категорий: категория низкого, умеренного, высокого и очень высокого риска (табл. 31). Эти категории соответствуют 10-летнему риску сердечно-сосудистого заболевания <15, 15—20, 20—30 и >30% соответственно по Фремингемской шкале и 10-летнему риску фатального сердечно-сосудистого события <4, 4—5, 5—8 и >8% соответственно по шкале SCORE (см. раздел «Профилактика сердечно-сосудистых заболеваний»). При переходе из одной категории в другую риск увеличивается в 1,5 раза, поэтому табл. 31 можно использовать для подсчёта относительного риска.
Таблица 31. Стратификация риска при АГ


*САД — систолическое АД.
**ДАД — диастолическое АД
В табл. 32 представлены факторы риска, варианты поражения органов-мишеней и ассоциированные клинические состояния, которые используются для стратификации риска.
Таблица 32. Факторы, влияющие на прогноз

*Данные уровни общего холестерина и холестерина ЛПНП используют для стратификации риска при АГ, нормы для липидов представлены в разделе «Профилактика сердечно-сосудистых заболеваний».
**Референтные показатели и единицы измерения могут отличаться в разных лабораториях.
ПРИМЕРЫ ФОРМУЛИРОВОК ДИАГНОЗА
Гипертоническая болезнь II стадии. Степень АГ 3. Дислипидемия. Гипертрофия левого желудочка. Риск 4 (очень высокий).
Гипертоническая болезнь III стадии. Степень АГ 2. ИБС. Стенокардия напряжения II ФК. Риск 4 (очень высокий).
Гипертоническая болезнь II стадии. Степень АГ 2. Атеросклероз аорты, сонных артерий. Риск 3 (высокий).
Гипертоническая болезнь III стадии. Степень АГ 1. Облитерирующий атеросклероз сосудов нижних конечностей. Перемежающаяся хромота. Риск 4 (очень высокий).
ДИАГНОСТИКА. АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Цели диагностики:
- оценка стабильности и степени повышения АД
- поиск причин симптоматической АГ
- поиск других факторов риска, поражения органов-мишеней и ассоциированных или сопутствующих состояний.
ИЗМЕРЕНИЕ АД
Измерение АД служит основой диагностики и лечения АГ. К сожалению, простые правила измерения часто не соблюдают, что приводит к искажению результатов, неверной диагностике и некорректному назначению терапии.
Проблемы, общие для всех методов измерения АД:
- выбор точного прибора - все приборы для измерения АД должны пройти проверку в соответствии с существующими стандартами. Результаты такой оценки для многих приборов можно посмотреть на сайте www.dableducational.org.
- физиологическая вариабельность АД - АД — весьма изменчивый гемодинамический параметр и зависит от многих факторов, включая эмоции, физические нагрузки, пищу, курение, приём алкоголя, дыхание и др. АД также зависит от возраста, этнической принадлежности и времени суток (ночью АД обычно ниже).
ИЗМЕРЕНИЕ АД В КАБИНЕТЕ ВРАЧА
ПРИБОРЫ ДЛЯ ИЗМЕРЕНИЯ АД ВРАЧОМ
Ртутный сфигмоманометр остаётся эталонным прибором для измерения АД по Короткову и его продолжают использовать в ряде стран, несмотря на токсичность ртути. Анероидный сфигмоманометр, широко распространённый в России, обеспечивает необходимую точность измерения АД только в случае регулярной (не реже 1 раза в 6мес) проверки и калибровки. Альтернатива ртутным и анероидным сфигмоманометрам — профессиональные автоматические приборы для измерения АД, обеспечивающие высокую точность измерения, хранение данных и исключающие ошибки в измерении, связанные с врачом (например, тенденцию к округлению цифр). Ограничивает применение профессиональных автоматических приборов их высокая стоимость.
ПРАВИЛА ИЗМЕРЕНИЯ АД
Дайте пациенту спокойно посидеть в течение нескольких минут.
Используйте сертифицированные приборы.
Проводите по меньшей мере 2 измерения с интервалом 1—2 мин.
Используйте стандартную манжету (12-13 на 35см), при необходимости манжету большого диаметра.
Поместите манжету на уровне сердца.
Спускайте воздух из манжеты медленно (2мм рт.ст. в секунду).
У пожилых больных и пациентов с сахарным диабетом измеряйте также АД в положении стоя.
СУТОЧНОЕ МОНИТОРИРОВАНИЕ АД
Суточное мониторирование АД имеет ряд преимуществ перед традиционным измерением, когда его проводит врач: даёт информацию о профиле АД вне медицинского учреждения в течение суток, позволяет оценить влияние повседневной активности больного на АД, а также выявить пациентов с недостаточным снижением АД ночью.
Когда следует проводить суточное мониторирование АД?
Определённые показания:
- подозрение на «гипертонию белого халата»
- подозрение на амбулаторную (скрытую) АГ
- подозрение на ночную АГ
- определение степени ночного снижения АД
- рефрактерная АГ
- АГ при беременности.
Возможные показания:
- пожилой возраст
- подбор антигипертензивной терапии
- сахарный диабет 1 типа
- оценка симптомов ортостатической гипотонии.
Кому проводить повторное суточное мониторирование АД?
- у пациентов с «гипертонией белого халата» желательно подтверждение диагноза через 3-6мес с помощью повторного суточного мониторирования АД
- при доказанной «гипертонии белого халата» и низком риске суточное мониторирование АД следует проводить каждые 2года
- частота суточного мониторирования АД для контроля антигипертензивной терапии зависит от тяжести АГ и ответа на лечение.
ДОМАШНЕЕ ИЗМЕРЕНИЕ АД
Домашнее измерение (или самостоятельное измерение пациентом) АД даёт дополнительную информацию врачу и может улучшить приверженность к лечению у пациентов с АГ. Домашнее измерение АД нужно проводить с помощью точных приборов (желательно автоматических), врач должен объяснить пациенту процедуру самостоятельного измерения АД и осуществлять регулярный контроль.
ПРАВИЛА ДОМАШНЕГО ИЗМЕРЕНИЯ АД.
Измерение АД следует проводить после нескольких минут отдыха.
Предпочтительно использование приборов с манжетой на плечо (а не на запястье).
Желательно использовать прибор, запоминающий результаты измерений.
В начале лечения или в процессе установления диагноза АГ необходимо проводить два измерения утром и два вечером каждый день в течение недели.
При длительном наблюдении измерения АД нужно проводить в течение недели 1 раз в 3 мес.
Нормы АД отличаются при разных методах измерения (табл. 33).
Таблица 33. Референтные показатели для разных методов измерения АД

ЧТО ТАКОЕ «ГИПЕРТОНИЯ БЕЛОГО ХАЛАТА» (ИЗОЛИРОВАННАЯ ОФИСНАЯ ГИПЕРТОНИЯ)?
При измерении в кабинете врача АД стойко повышено (>140 и 90мм рт.ст.).
Амбулаторное (по данным суточного мониторирования) или домашнее АД в пределах нормы (среднесуточное < 125 и 80мм рт.ст, домашнее< 135 и 85мм рт.ст.).
У пациентов с «гипертонией белого халата» сердечно-сосудистый риск ниже, чем у больных со стойким повышением АД по данным суточного или домашнего измерения. Однако необходимо динамическое наблюдение этой группы пациентов.
ЧТО ТАКОЕ АМБУЛАТОРНАЯ (СКРЫТАЯ) ГИПЕРТОНИЯ?
При измерении в кабинете врача АД в пределах нормы.
Амбулаторное (по данным суточного мониторирования) или домашнее АД стойко повышено.
СБОР АНАМНЕЗА
Выяснить длительность и степень повышения АД в прошлом.
Факторы риска:
- наличие АГ и сердечно-сосудистых заболеваний, дислипидемии, сахарного диабета у близких родственников
- курение
- данные анамнеза, позволяющие предположить вторичную (симптоматическую) АГ - случаи поликистоза почек у близких родственников, болезни почек, инфекции мочевыводящих путей, гематурия, злоупотребление анальгетиками (болезни паренхимы почек), приём препаратов: оральные контрацептивы, карбеноксолон, сосудосуживающие капли в нос, кокаин, амфетамины, глюкокортикоиды, НПВП, эпоэтин альфа, циклоспорин, приступы потливости, головной боли, тревожности, сердцебиении (феохромоцитома). приступы мышечной слабости и судорог (гиперальдостеронизм)
- признаки, позволяющие предположить вторичную (симптоматическую) АГ - внешний вид, характерный для синдрома Кушинга, кожные признаки нейрофиброматоза (феохромоцитома), пальпируемые увеличенные почки (поликистоз), шум в проекции почечных артерий (реноваскулярная АГ), сердечный шум или шум в прекардиальной области (болезни аорты или коарктация аорты), сниженный и замедленный пульс на бедренных артериях и низкое АД при измерении на ногах (коарктация аорты).
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Показания для направления в кардиологический диспансер или консультативно-диагностический центр:
- подозрение на вторичную (симптоматическую) АГ - любые указания в анамнезе или физикальные признаки, позволяющие предположить вторичный характер АГ, молодой возраст (появление АГ до 20лет, необходимость медикаментозной терапии в возрасте до 30лет), повышение креатинина сыворотки, протеинурия или гематурия
- внезапное начало или ухудшение течения АГ
- трудности антигипертензивной терапии - непереносимость нескольких лекарственных препаратов, наличие противопоказаний к назначению нескольких классов препаратов, плохая приверженность к лечению
- особые ситуации - АГ при беременности, подозрение на «гипертонию белого халата».
ЛЕЧЕНИЕ
Решение о назначении антигипертензивной терапии необходимо принимать на основании двух критериев: уровня общего сердечно-сосудистого риска и уровня систолического и диастолического АД.
Показания к назначению медикаментозной терапии представлены в табл. 34; алгоритмы действий при высоком нормальном АД, АГ 1—2 степени и АГ 3 степени представлены на рис. 6.
Таблица 34. Показания к антигипертензивной терапии
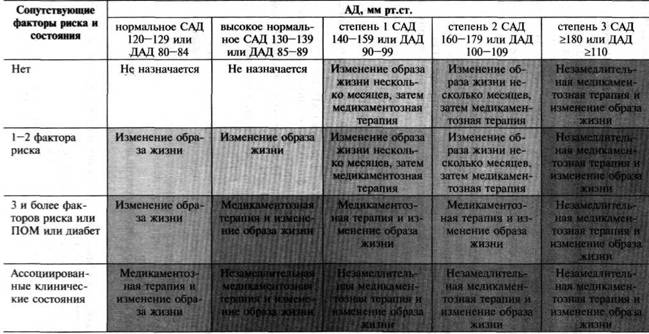
Рис. 6. Алгоритмы действий при высоком нормальном АД, АГ 1—2 степени и АГ 3 степени.
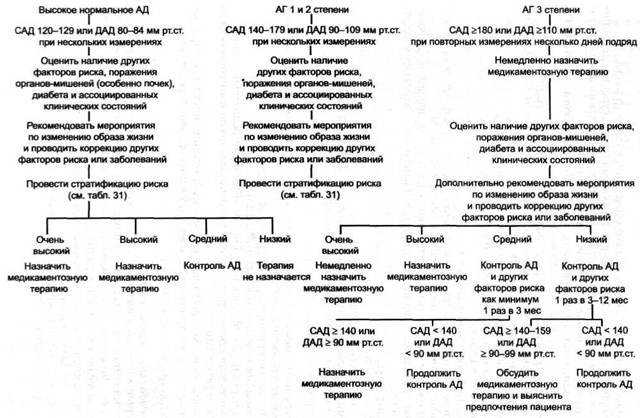
ЦЕЛИ ЛЕЧЕНИЯ
- максимальное снижение общего сердечно-сосудистого риска
- коррекция всех модифицируемых факторов риска (курения, дислипидемии, диабета и др.) и лечение ассоциированных клинических состояний в дополнение к терапии повышенного АД
- снижение как систолического, так и диастолического АД до 140 и 90мм рт.ст. и ниже при хорошей переносимости
- у больных диабетом целевые уровни АД 130 и 80мм рт.ст.
- достижение уровня систолического АД ниже 140мм рт.ст. может быть затруднительным у пожилых пациентов
- терапия, направленная на снижение АД, уменьшает сердечно-сосудистую и общую смертность, частоту инсульта, частоту коронарных событий.
Эти преимущества доказаны у больных систоло-диастолической АГ и у пожилых пациентов с изолированной систолической АГ.
Следующие классы антигипертензивных препаратов продемонстрировали положительное влияние на прогноз в плацебо-контролируемых исследованиях:
- диуретики
- б-блокаторы
- антагонисты кальция
- ингибиторы ангиотензин-превращающего фермента (АПФ)
- блокаторы ангиотензиновых рецепторов.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
- неясность диагноза и необходимость в специальных методах исследования для уточнения формы АГ
- частые гипертонические кризы
- рефрактерная АГ.
ПОКАЗАНИЯ К ЭКСТРЕННОЙ ГОСПИТАЛИЗАЦИИ:
- гипертонический криз, не купирующийся на догоспитальном этапе
- гипертонический криз с выраженными явлениями гипертонической энцефалопатии
- осложнения АГ, требующие интенсивной терапии: инсульт, субарахноидальное кровоизлияние, острые нарушения зрения, отёк лёгких.
НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
МЕРОПРИЯТИЯ ПО ИЗМЕНЕНИЮ ОБРАЗА ЖИЗНИ
Рекомендовать всем пациентам, включая лиц с нормальным и высоким нормальным АД (см. табл. 30) с дополнительными факторами риска, а также больным, требующим медикаментозной терапии.
Цель мероприятий по изменению образа жизни — снижение АД и контроль других факторов риска.
Мероприятия по изменению образа жизни, которые снижают сердечно-сосудистый риск:
- отказ от курения
- снижение веса
- ограничение употребления алкоголя
- физические нагрузки
- снижение потребления поваренной соли
- увеличение потребления фруктов и овощей
- снижение доли насыщенного и общего жира.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Принципы медикаментозной терапии:
- терапия должна быть постепенной
- с достижением целевых уровней АД
- большому числу пациентов требуется комбинированная терапия
- возможна как монотерапия в низкой дозе, так и комбинация двух препаратов в низких дозах.
Дальнейшая тактика ведения представлена на рис. 7.
Рис. 7. Выбор между монотерапией и комбинированным лечением.
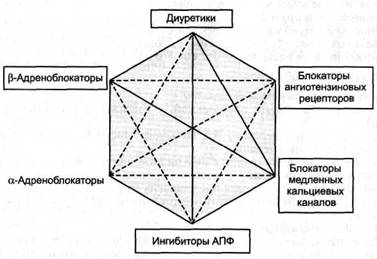
Рациональные комбинации антигипертензивных препаратов представлены на рис. 8.
Рис. 8. Комбинации антигипертензивных препаратов. Сплошные линии — рациональные комбинации, пунктирные — нежелательные комбинации. В рамках — классы препаратов с доказанным положительным влиянием на прогноз.
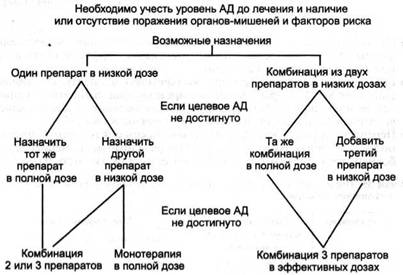
ВЫБОР АНТИГИПЕРТЕНЗИВНОГО ПРЕПАРАТА
Основные классы антигипертензивных препаратов подходят как для начала, так и продолжения терапии.
Выбор препарата зависит от многих факторов, в числе которых:
- предшествующий опыт применения пациентами антигипертензивных препаратов
- стоимость терапии (но не в ущерб индивидуальной эффективности переносимости)
- клинически значимые сердечно-сосудистые или почечные заболевания или диабет
- предпочтения пациента.
Назначайте длительно действующие препараты или лекарственные формы, обеспечивающие антигипертензивную эффективность в течение 24ч при приёме 1 раз в день. Врач должен назначать препарат конкретному пациенту, принимая во внимание все факторы и учитывая предпочтения пациента. Специфические показания и противопоказания к назначению основных классов антигипертензивных препаратов представлены в табл. 35.
Таблица 35. Показания и противопоказания к назначению основных классов антигипертензивных препаратов


Переносимость лечения служит весьма важным фактором приверженности к лечению. Необходимо каждый раз спрашивать пациента о побочных эффектах терапии и при необходимости изменять назначения.
ОСОБЕННОСТИ АНТИГИПЕРТЕНЗИВНОЙ ТЕРАПИИ В ОТДЕЛЬНЫХ ГРУППАХ БОЛЬНЫХ
ПОЖИЛЫЕ ПАЦИЕНТЫ
Антигипертензивная терапия способна предотвратить сердечно-сосудистые осложнения у пожилых больных с изолированной систолической АГ. Снижение АД должно быть постепенным, особенно у ослабленных больных. Необходимо измерять АД в положении стоя для оценки выраженности постуральных эффектов. Проводите терапию сопутствующих факторов риска и заболеваний, частых в пожилом возрасте. Если необходимо, используйте два препарата и более. У лиц >80лет убедительные доказательства преимуществ антигипертензивной терапии отсутствуют.
ПАЦИЕНТЫ С САХАРНЫМ ДИАБЕТОМ
Рекомендуйте мероприятия по изменению образа жизни (особенно снижение веса и уменьшение потребления соли при диабете 2 типа).Целевой уровень АД 130 и 80мм рт.ст. и ниже. Почти всегда требуется комбинированная терапия. Можно применять все классы антигипертензивных препаратов. При нефропатии необходимо включить в комбинации ингибиторы АПФ (диабет 1 типа) и блокаторы ангиотензиновых рецепторов (диабет 2 типа). Если есть микроальбуминурия (при диабете 1 или 2 типа), необходимо назначение блокаторов ангиотензиновых рецепторов, независимо от уровня АД.
ПАЦИЕНТЫ С УЖЕ ИМЕЮЩИМИСЯ СЕРДЕЧНО-СОСУДИСТЫМИ ЗАБОЛЕВАНИЯМИ
У пациентов, перенесших инсульт или транзиторную ишемическую атаку, антигипертензивная терапия (диуретики и ингибиторы АПФ)снижает риск повторного инсульта даже при нормальном или высоком нормальном АД. Применение нескольких классов антигипертензивных препаратов благоприятно влияет на прогноз после перенесённого инфаркта миокарда. При ХСН диуретики, антагонисты альдостерона, б-блокаторы, ингибиторы АПФ и блокаторы ангиотензиновых рецепторов благоприятно влияют на прогноз.
ПАЦИЕНТЫ С НАРУШЕННОЙ ФУНКЦИЕЙ ПОЧЕК
Интенсивное снижение АД необходимо не только у больных с диабетом для предотвращения поражения почек, но и у больных нефропатией, не связанной с диабетом. Необходимо максимально снижать степень протеинурии, насколько это возможно. С этой целью можно применять блокаторы ангиотензиновых рецепторов и ингибиторы АПФ (или комбинацию этих препаратов). Для достижения целевого АД часто требуется комбинированная терапия с добавлением диуретика, блокатора медленных кальциевых каналов и других препаратов.
Возможен сочетанный терапевтический подход (антигипертензивные препараты, статины, дезагреганты).
АГ ПРИ БЕРЕМЕННОСТИ
- у беременных с предшествующей АГ: немедикаментозное лечение, если АД 140-149 и 90-99мм рт.ст., снижение массы тела противопоказано (приводит к снижению массы тела новорождённого), ацетилсалициловая кислота в низких дозах у беременных с преэклампсией в анамнезе
- показания к назначению антигипертензивной терапии: систолическое АД 140мм рт.ст. или диастолическое АД 90мм рт.ст. при АГ беременных или предшествующей АГ с ПОМ, во всех остальных случаях АД 150 и 95мм рт.ст.
- САД >170 или ДАД >110мм рт.ст. у беременных расценивается как неотложное состояние и требует экстренной госпитализации
- метилдопа, лабеталол, блокаторы медленных кальциевых каналов б-блокаторы служат препаратами выбора.
РЕФРАКТЕРНАЯ АГ
Определение: ситуация, когда мероприятия по изменению образа жизни и комбинация по меньшей мере 3 препаратов в адекватных дозах не обеспечивает достаточного снижения систолического и диастолического АД.
Причины:
- нераспознанная вторичная AГ
- несоблюдение назначений врача
- приём препаратов, повышающих АД (глюкокортикоиды, НПВП, оральные контрацептивы и др.)
- невыполнение мероприятий по изменению образа жизни
- перегрузка жидкостью (недостаточная терапия диуретиками, почечная недостаточность, чрезмерное употребление поваренной соли)
- обструктивное апноэ во сне
- псевдогипертензия (например, узкая манжета при большой окружности плеча).
При рефрактерной АГ рекомендуют консультацию специалиста или госпитализацию.
КОРРЕКЦИЯ СОПУТСТВУЮЩИХ ФАКТОРОВ РИСКА (см. также раздел «Профилактика сердечно-сосудистых заболеваний»)
ГИПОЛИПИДЕМИЧЕСКАЯ ТЕРАПИЯ
Статины должно назначать пациентам с АГ как при наличии, так и отсутствии других сердечно-сосудистых заболеваний, если: 10-летний сердечно-сосудистый риск превышает 20% (высокий или очень высокий риск по табл. 31), уровень общего холестерина превышает 5,0ммоль/л.
Цель — снижение холестерина на 30%.
АНТИТРОМБОЦИТАРНАЯ ТЕРАПИЯ
Необходимо назначать ацетилсалициловую кислоту в низких дозах пациентам с АГ старше 50лет даже с небольшим повышением креатинина сыворотки или когда 10-летний сердечно-сосудистый риск превышает 20% (высокий или очень высокий риск по табл. 31).
Назначению низких доз ацетилсалициловой кислоты должна предшествовать стабилизация АД.
НЕОТЛОЖНЫЕ СОСТОЯНИЯ ПРИ АГ
Гипертонические кризы - состояния, требующие неотложной терапии.
Цель - снижение АД в течение первых минут и часов с помощью парентеральных препаратов.
Неотложная терапия необходима при повышении АД >180 и 120мм рт.ст., приводящем к появлению или усугублению симптомов со стороны органов-мишеней:
- нестабильная стенокардия
- острая левожелудочковая недостаточность
- расслаивающая аневризма аорты
- эклампсия.
- инсульт
- отёк соска зрительного нерва.
Незамедлительное снижение АД показано также
при травме ЦНС,
у послеоперационных больных,
при угрозе кровотечения.
Пациент с гипертоническим кризом должен быть госпитализирован в отделение интенсивной терапии для постоянного мониторинга АД и парентерального введения антигипертензивных препаратов для быстрого снижения АД (табл. 36).
Таблица 36. Парентеральные препараты для лечения гипертонических кризов
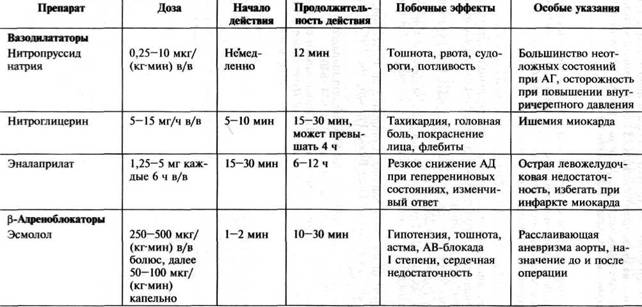
АД необходимо снижать в первые 2ч на 25%, в течение последующих 2-6ч до 160 и 100мм рт.ст.
Не следует снижать АД слишком быстро.
При АД >180 и 120мм рт.ст. его следует измерять каждые 15-30мин.
СОСТОЯНИЯ, ТРЕБУЮЩИЕ СНИЖЕНИЯ АД В ТЕЧЕНИЕ НЕСКОЛЬКИХ ЧАСОВ
Резкое повышение АД, не сопровождающееся симптомами со стороны органов-мишеней, не требует неотложного вмешательства. АД может быть снижено пероральным приёмом препаратов с относительно быстрым действием - приемом б-адреноблокаторов, клонидина, короткодействующего ингибитора АПФ каптоприла, петлевых диуретиков. Лечение может проводиться в амбулаторных условиях.
Короткодействующий нифедипин под язык не следует применять для лечения неотложных состояний при АГ во избежание почечной, мозговой или коронарной ишемии из-за резкого снижения АД.
ОБУЧЕНИЕ ПАЦИЕНТА
Врач должен информировать пациента с АГ о риске сердечно-сосудистых осложнений, факторах и заболеваниях, сопутствующих АГ, а также рассказать о методах медикаментозного и немедикаментозного лечения АГ. Каждый этап лечения и профилактики должен быть согласован с больным. Необходимо выяснить, каким лекарствам и методам немедикаментозной профилактики отдает предпочтение больной. Такие меры должны обеспечить осознанное участие больного в лечебно-профилактическом процессе и повысить его эффективность
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ
Частота последующего наблюдения пациента с АГ зависит от общего сердечно-сосудистого риска и уровня АД. Количество визитов к врачу уменьшается, если достигается целевой уровень АД и проводится самоконтроль АД.
Пациент с низким сердечно-сосудистым риском и небольшим повышением АД (высокое нормальное или 1 степень АГ), получающий монотерапию, должен наблюдаться каждые 6мес. Если целевое АД не достигается в течение 6мес, показана консультация специалиста.
ПРОГНОЗ
Прогноз при АГ определяется степенью общего сердечно-сосудистого риска. Предпочтительно использование шкалы оценки риска смерти от сердечно-сосудистых заболеваний в течение 10лет SCORE (см. раздел «Профилактика сердечно-сосудистых заболеваний»).
ИСТОЧНИКИ
1. Профилактика, диагностика и лечение артериальной гипертензии. Российские рекомендации (второй пересмотр). Кардиоваскулярная терапия и профилактика 2004; (приложение) 1—20.
2. Practice guidelines for primary care physicians:
2003 ESH/ESC hypertension
guidelines. Journal of Hypertension 2003; 21:
1779-1786.
3. 2003
European Society of Hypertension-European Society of Cardiology guidelines for
the management of arterial hypertension. Journal of Hypertension 2003; 21:
1011-1053.
4. The
seventh report of the Joint National Committee on Prevention, Detection,
Evaluation, and Treatment of High Blood Pressure: the JNC 7 report.
Hypertension 2003; 42: 1206-1252.
5. British
Hypertension Society guidelines for hypertension management 2004 (BHS-IV):
summary. British Medical Journal 2004; 328: 634-640.
6. Practice guidelines of the European Society of Hypertension for clinic, ambulatory and self blood pressure measurement. Journal of Hypertension 2005; 23: 697-670.
ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА
СТАБИЛЬНАЯ СТЕНОКАРДИЯ НАПРЯЖЕНИЯ
Стенокардия — клинический синдром, характеризующийся дискомфортом или болью в грудной клетке сжимающего, давящего характера, с локализацией чаше всего за грудиной, реже в области левой руки, лопатки, спины, шеи, нижней челюсти, эпигастрия. Боль провоцируется физической нагрузкой, выходом на холод, обильным приёмом пищи, эмоциональным стрессом, проходит в покое, устраняется приёмом нитроглицерина в течение нескольких минут.
Стенокардия обусловлена преходящей ишемией миокарда, развивается вследствие несоответствия между потребностью миокарда в кислороде и его доставкой по коронарным артериям. В табл. 37 перечислены состояния, которые могут быть как самостоятельными причинами стенокардии, так и усугублять её течение.
Таблица 37. Причины стенокардии

Морфологическим субстратом стенокардии в большинстве случаев служат атеросклеротические сужения в основных субэпикардиальных коронарных артериях. Реже стенокардия развивается при ангиографически нормальных коронарных артериях. В этих случаях причина ишемии миокарда - спазм и/или дисфункция эндотелия. Стенокардия встречается и у больных с патологией сердечных клапанов, гипертрофической кардиомиопатией, неконтролируемой артериальной гипертонией и т.д. (см. табл. 37). С другой стороны, симптомы, похожие на стенокардию, могут быть связаны с болезнями лёгких, пищевода, грудной клетки (см. раздел Дифференциальная диагностика).
КОДЫ МКБ-10
120 Стенокардия (грудная жаба)
120.1 Стенокардия с документально подтверждённым спазмом
120.8 Другие формы стенокардии
120.9 Стенокардия неуточнённая.
ЭПИДЕМИОЛОГИЯ
ИБС в течение многих лет остаётся ведущей причиной смертности в экономически развитых странах.
Вероятность заболеть стенокардией резко повышается с возрастом. Так, в возрасте от 45 до 54лет заболеваемость составляет 0,1-1% у женщин и 2-5% у мужчин, тогда как в интервале от 65 до 74лет 10-15% и 10-20% соответственно.
В России почти 10млн трудоспособного населения страдают ИБС, более трети из них имеют стабильную стенокардию. В 2000 г. в России заболеваемость ИБС составила 425,5 случая на 100 000 населения.
Смертность от ИБС у лиц в возрасте до 65лет за последние 20 лет снизилась на 50%, однако общая смертность от ИБС осталась неизменной. В России смертность от ИБС в 2000г. возросла на 3%. Смертность от ИБС у мужчин в возрасте до 65лет в 3раза выше, чем у женщин. В более старшем возрасте смертность у обоих полов выравнивается, а после 80лет становится в 2раза выше у женщин, чем у мужчин. По данным Фремингемского исследования, 2-летняя частота сердечной смерти составила 5,5% у мужчин и 3,8% у женщин, риск нефатального инфаркта 14,3 и 6,2%.
В популяции только 40-50% больных стенокардией знают о своём заболевании, у остальных 50-60% оно остаётся нераспознанным.
ПРОФИЛАКТИКА
Атеросклероз, лежащий в основе стенокардии - заболевание многофакторное. Выделяют факторы, предрасполагающие к развитию процесса, среди которых выделяют модифицируемые (гиперлипидемия, артериальная гипертония, сахарный диабет, курение, ожирение) и немодифицируемые (пол, возраст, наследственность). На поликлиническом уровне следует обращать особое внимание на выявление и коррекцию факторов риска, особенно в группе пациентов с высокой вероятностью сердечно-сосудистых заболеваний и их осложнений (мужчины старше 50лет, пожилые, с отягощенной наследственностью по ИБС — по мужской линии до 55 лет, по женской до 65 лет).
ОСНОВНЫЕ НАПРАВЛЕНИЯ ПРОФИЛАКТИКИ ИБС
1. Всем больным, пришедшим на приём, нужно рекомендовать диету с пониженным содержанием животных жиров, поддерживать регулярную физическую активность.
2. Необходимо выявлять и лечить АГ. АД нужно измерять у любого пациента, пришедшего на приём. Антигипертензивную терапию назначают на основании общей величины сердечно-сосудистого риска, определяемой величиной АД, наличием факторов риска, поражения органов-мишеней и ассоциированных клинических состояний (см. Артериальная гипертония). Целевой уровень АД для пациентов без СД <140 и 90мм рт.ст., для пациентов е СД и поражениями почек <130/80мм рт.ст.
Всем больным с АГ рекомендуют изменение образа жизни и модификацию питания.
3. Следует настоятельно рекомендовать пациентам отказаться от курения, подчеркивая резкое увеличение риска сердечно-сосудистых и онкологических заболеваний. На фоне массового отказа от курения во многих западных странах в России обратная тенденция: курят более 60% мужчин и около 40% женщин. У всех пациентов нужно выяснять, курят ли они. При каждом визите необходимо оценивать количество выкуриваемых сигарет, рекомендовать отказ от курения, обеспечивая медикаментозную и немедикаментозную поддержку всем пациентам, пытающимся бросить курить. Необходимо помогать пациентам разработать план отказа от курения. При отсутствии противопоказаний следует рекомендовать использование никотинсодержащих препаратов.
4. Всех мужчин старше 40лет и женщин после менопаузы, а также молодых пациентов с повышенным риском развития ИБС периодически необходимо обследовать на наличие дислипидемии. Скрининг на гиперлипидемию необходимо повторять каждые 5 лет. Следует использовать диету, гиполипидемическую терапию по показаниям для лечения бессимптомных пациентов без ИБС, имеющих гиперлипидемию. Следует рекомендовать сбалансированную диету с низким содержанием холестерина и жиров. Следует оценить наличие факторов риска ИБС с использованием системы оценки риска SCORE, рекомендованной Европейским обществом кардиологов. На основании этого следует определить целевые значения ХС ЛПНП и пороговые значения ХС ЛПНП для начала медикаментозной терапии (см. раздел Профилактика). В рекомендуемую терапию вносят коррективы в зависимости от наличия сопутствующих заболеваний, данных о переносимости гиполипидемических препаратов.
5. У пациентов со множеством факторов риска необходимо проводить первичную профилактику с помощью ацетилсалициловой кислоты. При отсутствии противопоказаний пациентам со множеством факторов риска ацетилсалициловую кислоту назначают в дозе 75-325мг/сут. Ацетилсалициловая кислота показана пациентам старше 50лет с АГ на фоне адекватной антигипертензивной терапии (систолическое АД <140мм рт.ст.) в случаях высокого риска сердечнососудистых осложнений (>20%), предшествующих сердечно-сосудистых осложнений и при умеренном повышении уровня креатинина крови. Не следует рекомендовать приём ацетилсалициловой кислоты лицам без симптомов ИБС, имеющим низкий или средний уровень риска.
6. СД 2 типа - наиболее агрессивный фактор риска ИБС. Так, вероятность развития ИМ у больных СД соответствует группе больных, уже перенёсших ИМ. Необходимо активно модифицировать факторы риска у пациентов с СД. У всех пациентов со стенокардией проводят скрининг СД. У пациентов с отягощенной наследственностью по СД следует не реже 1 раза в год определять уровень глюкозы. Указанным лицам рекомендуют свести к минимуму потребление легкоусваяемых углеводов. У пациентов с СД необходимо более агрессивно воздействовать на факторы риска. Целевое АД 130 и 80мм рт.ст. Пациентам с СД, наличием альбуминурии и/или одним и более факторами риска назначают ингибиторы АПФ.
Внимание! Не рекомендовано проводить гормональную заместительную терапию с целью уменьшения сердечно-сосудистого риска у женщин в постменопаузе, не имеющих симптомов ИБС. Обсудите с пациенткой вопрос о прекращении ранее начатой гормональной заместительной терапии, если она назначалась для снижения сердечно-сосудистого риска. Антиоксидантные витамины (витамины С, Е и (б-каротин) для снижения сердечно-сосудистого риска не показаны даже пациентам с высоким уровнем риска.
СКРИНИНГ
Скрининг ИБС показан бессимптомным пациентам, занятым профессиональной деятельностью, связанной с безопасностью людей или сопряжённой с тяжёлыми физическими нагрузками. Назначают ЭКГ в покое и нагрузочные тесты лицам таких профессий, как пилоты самолётов, авиадиспетчеры, работники милиции, пожарные и т.д.
Скрининг ИБС также показан лицам, у которых родственники первой степени родства (родители, братья, сестры) заболели ИБС в молодом возрасте до 35-40лет.
КЛАССИФИКАЦИЯ
Наиболее распространена функциональная Классификация стенокардии Канадского сердечно-сосудистого общества.
I функциональный класс - обычная физическая активность, не вызывает дискомфорта. Приступ провоцирует лишь продолжительная либо интенсивная нагрузка.
II функциональный класс - небольшое ограничение обычной физической активности. Стенокардия возникает в результате быстрой ходьбы или быстрого подъёма по лестнице, после еды, или на холоде, или в ветреную погоду, или под влиянием эмоционального стресса, или в первые несколько часов после подъёма с постели, во время ходьбы на расстояние больше 200м (двух кварталов) по ровной местности или во время подъёма по лестнице более чем на один пролёт в обычном темпе при нормальных условиях.
III функциональный класс - выраженное ограничение обычной физической активности. Приступ стенокардии возникает в результате ходьбы на расстояние от одного до двух кварталов (100—200м) по ровной местности или при подъёме по лестнице на один пролёт в обычном темпе при нормальных условиях.
IV функциональный класс - невозможность выполнять любой вид физической деятельности без возникновения неприятных ощущений. Приступ стенокардии может возникнуть и в покое.
Принята также клиническая классификация стенокардии:
- типичная стенокардия - загрудинная боль или дискомфорт характерного качества и продолжительности, возникает при физической нагрузке или эмоциональном стрессе, проходит в покое или после приёма нитроглицерина
- атипичная стенокардия - два из вышеперечисленных признаков
- несердечная боль - один или ни одного из вышеперечисленных признаков.
Классификация преходящей ишемии миокарда:
- стабильная стенокардия
- вариантная стенокардия (спастическая или стенокардия Принцметала)
- безболевая ишемия миокарда.
ДИАГНОСТИКА
Каждый больной с подозрением на стенокардию нуждается в быстрой квалифицированной оценке состояния, постановке точного диагноза, стратификации риска. Основа первичного диагноза на амбулаторном этапе - тщательный сбор анамнеза с акцентированием внимания на факторах риска, физикальное обследование, регистрация ЭКГ в покое.
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
ЖАЛОБЫ И АНАМНЕЗ
Уточнить наличие факторов риска (возраст, пол, курение, гиперлипидемия, СД, АГ, семейный анамнез, отягощенный по раннему развитию сердечно-сосудистых заболеваний).
Со времён Гебердена, впервые в 1772 г. описавшего клинические проявления angina pectoris, анализ характера болевого приступа остаётся основой диагноза. В табл. 38 указаны ключевые особенности ангинозного приступа.
Таблица 38. Клинические характеристики ангинозного приступа

Подозрение на стенокардию на основании клинических проявлений служит безусловным основанием для продолжения кардиологического обследования амбулаторно либо стационарно в условиях специализированного отделения.
Постановка диагноза «нестабильная стенокардия» (см. раздел Острый коронарный синдром) должна означать немедленную госпитализацию в кардиологическое отделение.
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
При осмотре обратить внимание на признаки нарушения липидного обмена: ксантомы, ксантелазмы, краевое помутнение роговицы («старческая дута»).
Признаки сердечной недостаточности: одышка, цианоз, набухание вен шеи, отёки, патологическая пульсация в области сердца (аневризма).
Необходимо оценить показатели жизненно важных функций (АД, чсс, частота дыхательных движений).
Аускультация сердца: III и IV тоны, систолический шум на верхушке как проявление ишемической дисфункции папиллярных мышц для выявления шумов, характерных для аортального стеноза или гипертрофической обструктивной кардиомиопатии (могут обусловливать проявления стенокардии).
Пульсация и шумы на периферических артериях.
Следует активно выявлять симптомы состояний, которые могут провоцировать ишемию или усугублять её течение (см. табл. 37).
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Всем больным:
- общий анализ крови
- концентрация глюкозы в крови натощак
- развёрнутый липидный профиль ОХС, ХС ЛПВП, ХС ЛПНП, ТГ натощак
- концентрация креатинина.
При наличии специальных показаний:
- маркёры повреждения миокарда (сердечный тропонин)
- тиреоидные тормоны.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Всем пациентам с болью в грудной клетке делают ЭКГ в покое. Желательно записать ЭКГ в момент приступа болей за грудиной.
Признаки ишемии по ЭКГ:
- депрессия или элевация сегмента SТ >1мм на расстоянии, большем или равном 0,06-0,08с от комплекса QRS
- высокий остроконечный «коронарный» зубец T, инверсия зубца Т
- патологический зубец Q.
Вне ангинозного приступа на ЭКГ могут не определяться патологические изменения.
Рентгенография органов грудной клетки не является средством для диагностики стенокардии, однако она показана в случаях, когда есть основания выявить хроническую сердечную недостаточность, поражения клапанов сердца, перикарда или расслаивающую аневризму аорты, заболевания лёгких. Выполнение рентгенографии грудной клетки в иных случаях не обязательно.
ЭхоКГ показана в следующих случаях:
- пациентам с подозрением на перенесённый инфаркт миокарда, поражение клапанов сердца, с симптомами хронической сердечной недостаточности
- пациентам с систолическим шумом, указывающим на аортальный стеноз или гипертрофическую кардиомиопатию.
Нет необходимости в назначении эхоКГ пациентам с подозрением на стенокардию при нормальной ЭКГ, отсутствии в анамнезе инфаркта миокарда и симптомов хронической сердечной недостаточности.
ПРОБА С ФИЗИЧЕСКОЙ НАГРУЗКОЙ
Показания к проведению:
- дифференциальная диагностика ИБС
- определение индивидуальной толерантности к физической нагрузке
- оценка эффективности лечебных мероприятий - антиангинальной терапии и/или реваскуляризации
- экспертиза трудоспособности
- оценка прогноза.
Противопоказания:
- острая стадия инфаркта миокарда (2-7дней от начала)
- нестабильная стенокардия
- нарушение мозгового кровообращения
- острый тромбофлебит
- тромбоэмболия лёгочной артерии
- сердечная недостаточность III—IV класса по NYHA
- желудочковые аритмии высоких градаций (тахикардия), провоцируемые нагрузкой
- выраженная дыхательная недостаточность
- лихорадка
- нарушения опорно-двигательного аппарата
- пожилой возраст, астения.
Нагрузочный тест малоинформативен в следующих случаях:
- при тахиаритмиях
- при полной блокаде левой ножки пучка Гиса
- при синоатриальной и атриовентрикулярной блокаде высокой степени.
Для повышения информативности пробы антиангинальные препараты следует отменять за 24-48ч до проведения теста.
Подробная информация см. раздел Функциональные пробы с дозированной физической нагрузкой.
НАГРУЗОЧНЫЕ ВИЗУАЛИЗИРУЮЩИЕ ИССЛЕДОВАНИЯ
К нагрузочным визуализирующим методам относятся:
- нагрузочная эхоКГ, цель которой - обнаружить нарушения локальной сократимости миокарда ЛЖ, вызванные ишемией миокарда
- перфузионная двухмерная сцинтиграфия миокарда с таллием201
- однофотонная эмиссионная компьютерная томография - выявление участков гипоперфузии миокарда ЛЖ.
Показаниями для нагрузочных визуализирующих исследований служат:
- полная блокада левой ножки пучка Гиса, ритм электрокардиостимулятора, синдром WPW и другие изменения ЭКГ, связанные с нарушениями проводимости
- снижение сегмента ST >1мм на ЭКГ покоя, в том числе обусловленное гипертрофией ЛЖ, приёмом медикаментов (сердечные гликозиды)
- сомнительный результат нагрузочной пробы: нетипичная боль, незначительная динамика ЭКГ
- неспособность больных к выполнению достаточно интенсивной функциональной нагрузки (ФН)
- приступы стенокардии после коронарной реваскуляризации (АКШ и ТБКА) для уточнения локализации ишемии
- необходимость определения жизнеспособности миокарда для решения вопроса о реваскуляризации.
При эхоКГ-контроле учитывают нарушения сократимости миокарда в двух сегментах и более, а при сцинтиграфии миокарда с таллием201 фиксируют локальные дефекты перфузии и другие признаки нарушения кровоснабжения миокарда при сравнении с её исходным состоянием.
ЧРЕСПИЩЕВОДНАЯ ПРЕДСЕРДНАЯ ЭЛЕКТРИЧЕСКАЯ СТИМУЛЯЦИЯ ЧПЭС
Показаниями к проведению ЧПЭС служат:
- невозможность выполнения проб с ФН (ВЭМ-тест, тредмил) в связи с наличием сопутствующих заболеваний или противопоказаний к нагрузочным тестам
- неинформативность пробы с ФН вследствие того, что она не доведена до диагностических критериев по ЭКГ или до субмаксимальной возрастной ЧСС.
Признаки ишемии на ЭКГ при ЧПЭС такие же, как и при пробе с ФН, только во внимание принимают снижение сегмента ST в первых спонтанных комплексах после прекращения стимуляции сердца.
Фармакологические тесты
Пациентам, не способным выполнять ФН, например, при тяжёлом артрите, можно рекомендовать фармакологические «нагрузочные» пробы с использованием добутамина, который повышает потребность миокарда в кислороде за счёт увеличения чсс и усиления сократимости, или дипиридамола, вызывающего «синдром обкрадывания».
Коронарная ангиография КАГ
КАГ - метод прямой визуализации коронарных артерий является «золотым стандартом» диагностики стенозирующих поражений коронарных артерий, служит ключевым методом для принятия решения о необходимости и способе реваскуляризации (рис. 9).
Рис. 9. КАГ - метод прямой визуализации коронарных артерий, является «золотым стандартом» диагностики стенозирующих поражений коронарных артерий, служит ключевым методом для принятия решения о необходимости и способе реваскуляризации.
Степень сужения сосуда определяется уменьшением диаметра его просвета по сравнению с должным и выражается в процентах. До настоящего времени используют визуальную оценку со следующей характеристикой: нормальная коронарная артерия, изменённый контур артерии без определения степени стеноза, сужение менее 50%, сужение на 51-75%, 76-95%, 95-99% (субтотальное), 100% (окклюзия). Гемодинамически незначимым считают сужение просвета сосуда менее 50%. Помимо локализации поражения и его степени, при КАГ могут быть выявлены другие характеристики поражения артерии, такие, как тромб, надрыв (диссекция), спазм или миокардиальный мостик. Принимая решение о назначении КАГ, необходимо оценить не только целесообразность, но и риск этого вмешательства (табл. 39).
Таблица 39. Относительные противопоказания к КАГ
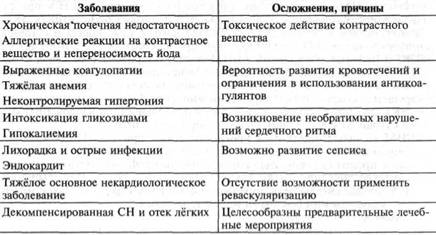
Показания для назначения больному КАГ при стабильной стенокардии для решения вопроса о возможности выполнения транскоронарной ангиопластики или коронарного шунтирования:
- тяжёлая стенокардия III-IV ФК, сохраняющаяся при оптимальной антиангинальной терапии
- признаки выраженной ишемии миокарда по результатам неинвазивных методов
- наличие у больного в анамнезе эпизодов внезапной смерти или опасных желудочковых нарушений ритма
- больные со стенокардией, которым проводилась реваскуляризация АКШ, ТБКА
- прогрессирование заболевания по данным динамики неинвазивных тестов
- сомнительные результаты неинвазивных тестов, особенно у лиц с социально значимыми профессиями (водители общественного транспорта, лётчики).
КРИТЕРИИ ДИАГНОСТИКИ ВАЗОСПАСТИЧЕСКОЙ СТЕНОКАРДИИ:
- отсутствует чёткая взаимосвязь приступа с физической нагрузкой. Боль чаще развивается в покое, при выходе на холод, провоцируется эмоциональными факторами.
- ангинозные приступы сопровождаются преходящим подъёмом (а не снижением) сегмента ST на ЭКГ
- иногда проводят фармакологическую пробу с эргометрином, который вызывает спазм коронарных артерий у чувствительных больных, сопровождавшийся подъёмом сегмента ST на ЭКГ. В связи с большой частотой побочных эффектов и низкой специфичностью тест используют редко.
БЕЗБОЛЕВАЯ (НЕМАЯ) ИШЕМИЯ МИОКАРДА ББИМ
По данным Фремингемского исследования, до 25% ИМ впервые диагностируются только при ретроспективном анализе серии ЭКГ, причём в половине случаев эти ИМ полностью бессимптомны. Выраженный атеросклероз коронарных артерий может протекать бессимптомно и обнаруживается только на аутопсии у лиц, умерших внезапно.
В рамках стабильной ИБС выделяют 2 типа ББИМ:
- I тип полностью ББИМ
- II тип сочетание ББИМ и болевых эпизодов ишемии миокарда.
Эпизоды ББИМ обычно диагностируются во время проб с ФН и при суточном мониторировании ЭКГ, а также при плановых регистрациях ЭКГ. В диагностике и оценке тяжести ББИМ нагрузочные пробы и суточное мониторирование ЭКГ дополняют друг друга. Тредмил-тест, ВЭМ проба, ЧПЭС позволяют обнаружить ББИМ и охарактеризовать её связь с АД, чсс, ФН. Одновременное выполнение перфузионной сцинтиграфии миокарда и нагрузочной эхоКГ помогает оценить возникающие гипоперфузию и нарушение сократительной функции миокарда. Суточное мониторирование ЭКГ фиксирует общее количество и длительность эпизодов ББИМ, а также случаи ББИМ в ночные часы и вне связи с ФН.
ББИМ - неблагоприятный прогностический признак. Повреждающее действие ишемии на миокард определяется не наличием боли, а выраженностью и продолжительностью нарушения его перфузии. Негативное прогностическое значение имеют также значительные количество, выраженность и продолжительность эпизодов ишемии миокарда вне зависимости от того, являются они болевыми или безболевыми.
СИНДРОМ X
Состояние, по-видимому, обусловленное изменением коронарных артерий на уровне мелких сосудов, чаще встречают у больных с артериальной гипертонией и гипертрофией миокарда левого желудочка. Диагностические критерии:
- типичные приступы стенокардии, провоцируемые физическими нагрузками
- положительный нагрузочный тест
- нормальные коронарные артерии.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Важно помнить, что стенокардию могут имитировать другие заболевания, которые сопровождаются болями или неприятными ощущениями в груди. Подробные данные анамнеза, клиническое и инструментальное исследования помогают в этих случаях избежать диагностических ошибок. Ниже, в табл. 40, представлены основные заболевания, при которых возникают боли в грудной клетке.
Таблица 40. Причины возникновения болей в грудной клетке
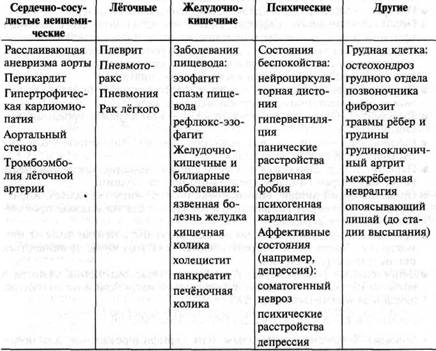
Дифференциальная диагностика болей в грудной клетке.
- аритмии: тахикардии с высокой частотой ритма. Могут вызывать типичные стенокардитические боли вследствие повышения потребности миокарда в кислороде и/или снижения коронарного кровотока в диастолу.
- поражения клапанов сердца или гипертрофическая обструктивная кардиомиопатия. Могут вызвать типичные стенокардитические боли вследствие обструкции выносящего тракта левого желудочка и увеличения миокардиального напряжения
- расслаивающая аневризма аорты. Классически проявляется острой режущей болью в грудной клетке с иррадиацией в спину
- перикардит. Боль часто плевритического характера, но может напоминать стенокардию. В классических случаях боль ослабевает в положении сидя и при наклоне вперёд, усиливается при дыхании, кашле, глотании
- ТЭЛА. Боль часто острая, плевритического характера и сопровождается одышкой. При рентгенографии органов грудной клетки застойных явлений не выявляют
- пневмоторакс. Острое начало, сопровождается одышкой, болью плевритического характера, тимпанический перкуторный звук на поражённой стороне и отсутствие дыхательных шумов при аускультации
- пневмония. Часто сопровождается лихорадкой, болями плевритического характера и продуктивным кашлем
- плеврит. Боль в грудной клетке плевритического характера
- поражения пищевода (рефлюкс, спазм, эзофагит). Боль часто связана с приёмом пищи, может быть неотличима от стенокардитической
- поражения желчевыводящих путей (холецистит, холелитиаз, холангит, жёлчная колика). Боль в правом верхнем квадранте живота, иррадиирущая в правую часть спины или правую лопатку
- язвенная болезнь. Боль в эпигастрии, часто связана с приёмом пищи, может быть неотличима от стенокардитической
- панкреатит. Обычно боль локализуется в эпигастрии и иррадиирует в спину
- реберно-грудинный хондрит (синдром Титце). Характерна боль при пальпации рёбер или движениях
- перелом рёбер. Движения грудной клетки, дыхание могут усиливать боли, характерен симптом крепитации при пальпации
- опоясывающий лишай. Интенсивная боль по типу невралгии. Характерные пузырьковые высыпания, в начальной стадии кожные проявления могут отсутствовать
- тревожные расстройства. Клинически могут быть неотличимы от стенокардии. Часто боли сопровождаются возбуждением, потливостью, ощущением сердцебиения
- депрессивные расстройства. Продолжительные ощущения тяжести в грудной клетке, не связанные с физической нагрузкой и не сопровождающиеся изменениями на ЭКГ.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Больных с предположительным или верифицированным диагнозом стенокардии желательно консультировать у кардиолога.
При подозрении на острый коронарный синдром (инфаркт миокарда, нестабильная стенокардия) показана немедленная госпитализация в кардиологическое отделение.
Если у врача есть основания проводить дифференциальную диагностику с заболеваниями, которые могут имитировать стенокардию либо усугублять её течение, необходимы консультации соответствующих специалистов: невропатолога, эндокринолога, пульмонолога, гастроэнтеролога, гематолога и т.д.
ЛЕЧЕНИЕ
ЦЕЛИ ЛЕЧЕНИЯ
- улучшение прогноза и увеличение продолжительности жизни (предупреждение инфаркта миокарда и внезапной сердечной смерти)
- уменьшение или устранение симптомов.
Если различные терапевтические стратегии равно эффективны в облегчении симптомов, следует предпочесть лечение с доказанным или очень вероятным преимуществом в улучшении прогноза.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Госпитализация показана
при подозрении на острый коронарный синдром
при неясном диагнозе, если невозможно провести соответствующее обследование на амбулаторном этапе
при неэффективности медикаментозной терапии
для определения или уточнения показаний к хирургическому лечению.
НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Следует комплексно воздействовать на модифицируемые факторы риска для снижения величины общего сердечно-сосудистого риска (см. Профилактика).
Информировать пациента о характере заболевания, объяснить алгоритм действий в случае развития ангинозного приступа (см. Острый коронарный синдром).
Избегать физических нагрузок, вызывающих приступ.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Медикаментозная терапия необходима для снижения вероятности развития инфаркта миокарда и внезапной смерти (т.е. увеличения продолжительности жизни) и уменьшения выраженности симптомов стенокардии (улучшение качества жизни).
Терапия, направленная на улучшение прогноза:
- дезагреганты
Ацетилсалициловую кислоту назначают в дозе 75—150 мг/сут всем пациентам со стенокардией, за исключением тех, у кого в анамнезе имеются указания на желудочно-кишечное кровотечение, острую язву, обострение хронической язвы, геморрагический синдром или аллергию к препарату.
При непереносимости или противопоказаниях к назначению ацетилсалициловой кислоты применяют клопидогрел в дозе 75мг/сут.
Больным, перенёсшим ТБКА со стентированием, в течение года назначают клопидогрел 75мг/сут + ацетилсалициловая кислота.
Если на фоне приёма ацетилсалициловой кислоты или клопидагрела у пациента развиваются тромботические осложнения (инфаркт миокарда, инсульт), следует определить уровень агрегации тромбоцитов для исключения развития резистентности к дезагрегантам. В случае выявления резистентности возможно увеличение дозы препарата с повторным контролем уровня агрегации либо замена на препарат с другим механизмом действия, например непрямой антикоагулянт
- липидснижающая терапия
Всем пациентам с ИБС показан приём статинов независимо от исходного уровня холестерина (табл. 41).
Таблица 41. Статины (ингибиторы 3-ГМГ-К.оА-редуктазы)

Обычно терапия статинами хорошо переносится, однако возможно развитие побочных эффектов: рабдомиолиз и повышение печёночных ферментов — аминотрансфераз. Необходимо определять уровень креатинфосфокиназы, аланиновой аминотрансферазы первый раз через 1—1,5мс, далее 1раз в 6мс.
Противопоказаниями к назначению статинов служат активные гепатиты, беременность и отмеченная ранее индивидуальная непереносимость препаратов.
Лечение статинами нужно проводить постоянно, так как уже через месяц после прекращения приёма препарата уровень липидов крови возвращается к исходному.
Повышать дозу любого из статинов следует, соблюдая интервал в 1мс, так как за этот период достигается наибольший эффект препарата.
Целевой уровень холестерина ЛПНП при стенокардии меньше 100мг/дл (<2,6ммоль/л).
В случае непереносимости статинов назначают альтернативные препараты: фибраты, пролонгированные препараты никотиновой кислоты или секвестранты жёлчных кислот.
Пациентам со стенокардией, низким уровнем холестерина ЛПВП, близкими к нормальным уровнями холестерина ЛПНП и высоким уровнем триглицеридов показано назначение фибратов как препаратов первой линии
Никотиновая кислота — активный гиполипидемический препарат, однако побочные эффекты: покраснение, зуд и сыпь на коже, боли в животе, тошнота — ограничивают широкое использование. Никотиновую кислоту назначают по 2—4г 2—3раза в день; а форму с замедленным высвобождением по 0,5 3раза в день.
Фибраты. Гиполипидемический эффект производных фиброевой кислоты (фибратов) проявляется главным образом в снижении содержания триглицеридов и повышении концентрации антиатерогенного холестерина ЛПВП, уменьшение уровня общего ХС менее выражено. Фенофибрат и ципрофибрат снижают концентрацию ХС ЛПНП в большей степени, чем гемфиброзил и безафибрат. Противопоказаниями к назначению фибратов служат желчнокаменная болезнь, гепатит и беоеменность.
Таблица 42. Фибраты (производные фиброевой кислоты)

Секвестранты жёлчных кислот (анионообменные смолы). Эта группа лекарственных средств представлена двумя основными препаратами - колестирамином и колестиполом. Показанием к назначению анионообменных смол служит тяжёлая гиперхолестеринемия, рефрактерная к статинам и фибратам. Колестирамин назначают в дозе 8—24г, колестипол — 5-30г/сут в виде порошка, который растворяют в жидкости. Препараты иногда субъективно плохо переносятся из-за неприятного вкуса. Побочные эффекты проявляются в виде запора, тошноты, вздутия живота; при длительном приёме возможно возникновение дефицита жирорастворимых витаминов
- б-адреноблокаторы
Показаны всем больным с ИБС, перенёсшим инфаркт миокарда и/или с признаками сердечной недостаточности. Рекомендуется назначение б-адреноблокаторов без внутренней симпатомиметической активности: метопролола, бисопролола, пропранолола, атенолола. Более детально схему назначения б-адреноблокаторов см. Антиангинальная терапия
- ингибиторы АПФ
Показаны всем больным с ИБС, перенёсшим инфаркт миокарда, с признаками сердечной недостаточности, артериальной гипертонией, сахарным диабетом.
Принимая во внимание данные крупных исследований (HOPE, EUROPA), ряд экспертов рекомендуют назначать ингибиторы АПФ (рамиприл, периндоприл) всем больным с ИБС
- антиангинальная терапия
Нитраты. Основной механизм действия нитратов — венодилатация, в результате чего уменьшается венозный возврат к сердцу, снижаются преднагрузка и потребность миокарда в кислороде. Кроме дилатации вен, нитраты умеренно расширяют артериолы в большом и малом круге кровообращения, что снижает посленагрузку на оба желудочка сердца. Наконец, нитраты уменьшают степень вазоконстрикции и устраняют спазм коронарных артерий. Нитраты классифицируют по лекарственным формам:
- всасывающиеся через слизистую оболочку рта — таблетки нитроглицерина для приёма под язык, аэрозоли нитроглицерина и изосорбида динитрата
- всасывающиеся в ЖКТ — таблетки и капсулы изосорбида динитрата, изосорбида-5-мононитрата, нитроглицерина пролонгированного действия
- для накожного применения — мази, пластыри с нитроглицерином;
- для внутривенного введения — растворы нитроглицерина и изосорбида динитрата.
По продолжительности действия (табл. 43):
- препараты короткого действия — продолжительность эффекта менее 1ч, предназначены для быстрого купирования ангинозного приступа
- умеренно пролонгированного действия — длительность эффекта 1—6ч
- значительно пролонгированного действия — продолжительность эффекта более 6ч.
Таблица 43. Нитраты и нитратоподобные
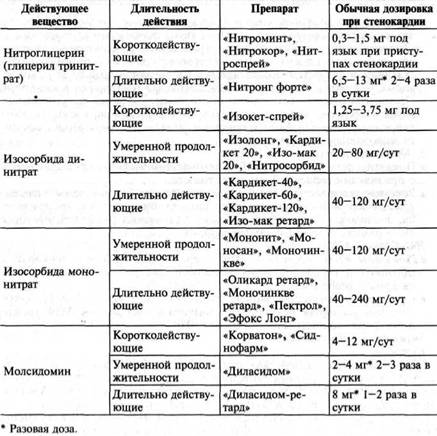
РЕКОМЕНДАЦИИ ПО ПРИМЕНЕНИЮ НИТРАТОВ
Все больные с ИБС должны быть обеспечены нитроглицерином короткого действия в форме таблеток или спрея для купирования приступа и профилактики в ситуациях, где предполагается высокая физическая или эмоциональная нагрузка.
Для предотвращения риска развития привыкания к нитратам их назначают прерывисто с целью создать в течение суток период, свободный от действия нитрата. Продолжительность такого периода должна быть не менее 10—12ч.
Пролонгированные нитраты назначают в виде монотерапии либо в комбинации с б-адреноблокаторами или блокаторами кальциевых каналов.
Недостатки нитратов: сравнительно частое появление побочных эффектов, в первую очередь головной боли, развитие привыкания (толерантности) к ним при регулярном приёме, возможность возникновения синдрома рикошета при резком прекращении поступления препарата в организм.
При стенокардии напряжения I ФК нитраты назначают только прерывисто в лекарственных формах короткого действия, обеспечивающих короткий и выраженный эффект — буккальные таблетки, пластинки, аэрозоли нитроглицерина и изосорбида динитрата. Такие формы следует применять за 5-10мин до предполагаемой ФН, вызывающей обычно приступ стенокардии.
При стенокардии напряжения II ФК нитраты также назначают прерывисто, перед предполагаемыми ФН. Наряду с формами короткого эффекта можно использовать формы умеренно пролонгированного действия.
При стенокардии III ФК нитраты принимают постоянно в течение дня — асимметричный приём с безнитратным периодом в 10-12ч. Для этого используют современные 5-мононитраты пролонгированного действия.
При стенокардии IV ФК, когда приступы стенокардии могут возникать и в ночное время, нитраты следует назначать так, чтобы обеспечить их круглосуточный эффект и, как правило, в комбинации с другими антиангинальными препаратами, в первую очередь с б-адреноблокаторами.
Нитратоподобным действием и, следовательно, антиангинальным эффектом, обладает молсидомин. Препарат может быть использован для профилактики приступов стенокардии.
Не следует назначать совместно с нитратами силденафил, тадалафил и варденафил из-за риска жизнеугрожающей артериальной гипотензии.
Б-адреноблокаторы назначают как препараты первого ряда большинству пациентов со стабильной стенокардией. Б-адреноблокаторы уменьшают адренергическое влияние на сердце, благодаря чему снижаются чсс, САД, реакция сердечно-сосудистой системы на физическую нагрузку и эмоциональный стресс.
Б-адреноблокаторы различаются по селективности действия в отношении б-адренорецепторов, расположенных в сердце, по наличию или от сутствию дополнительных свойств, в первую очередь способности вызывать вазодилатацию, наличию или отсутствию собственной симпатомиметической активности; по продолжительности действия. Предпочтение при лечении больных с ИБС следует отдавать селективным б-адреноблокаторам, не имеющим собственной симпатомиметической активности, обладающим значительным периодом полувыведения (табл. 44).
Таблица 44. Б-адреноблокаторы

Б-адреноблокаторы надо назначать в дозах, обеспечивающих отчётливое урежение чсс в покое и предотвращающих чрезмерную тахикардию во время нагрузок. Дозу б-адреноблокатора подбирают таким образом, чтобы достигнуть уменьшения чсс в покое до 55-60 в минуту и примерно до 75% от чсс при нагрузке, провоцирующей приступ стенокардии.
При стенокардии, устойчивой к монотерапии, используют комбинацию б-адреноблокатора с блокатором кальциевых каналов (с длительно действующим дигидропиридином), пролонгированными нитратами или триметазидином.
Самые распространённые побочные эффекты при терапии б-адреноблокаторами: синусовая брадикардия, различные блокады сердца, артериальная гипотония, слабость, ухудшение переносимости ФН, нарушения сна, снижение эректильной функции, кошмарные сновидения.
Противопоказания к назначению б-адреноблокаторов: брадикардия, атриовентрикулярные блокады, синдром слабости синусового узла, бронхиальная астма, ХОБЛ.
БЛОКАТОРЫ КАЛЬЦИЕВЫХ КАНАЛОВ
В качестве препаратов второго ряда используют блокаторы кальциевых каналов. Их делят на две подгруппы: дигидропиридиновые (нифедипин, никардипин, амлодипин, фелодипин и др.) и недигидропиридиновые (верапамил, дилтиазем) производные (табл. 45).
Таблица 45. Блокаторы кальциевых каналов

В фармакодинамике дигидропиридинов преобладает эффект периферической вазодилатации. Дигидропиридины не влияют на сократимость миокарда и атриовентрикулярную проводимость, поэтому их можно назначать больным с синдромом слабости синусового узла, нарушенной атриовентрикулярной проводимостью, выраженной синусовой брадикардией.
Пациентам со стабильной стенокардией блокаторы кальциевых каналов назначают в случае непереносимости б-адреноблокаторов или когда последние не полностью устраняют симптомы.
В фармакодинамике недигидропиридиновых блокаторов кальциевых каналов преобладают отрицательные инотропный и хронотропный эффекты, способность замедлять атриовентрикулярную проводимость. Эти свойства сближают их с б-адреноблокаторами. Их нельзя назначать при синдроме слабости синусового узла, нарушенной атриовентрикулярной проводимости.
Действие дигидропиридиновых блокаторов кальциевых каналов имеет определённое сходство с эффектом нитратов, их можно использовать тогда, когда нитраты плохо переносятся больными. Недигидропиридиновые блокаторы кальциевых каналов часто назначают в тех случаях, когда приём б-адреноблокаторов противопоказан.
Пациентам со стабильной стенокардией не следует назначать короткодействующие блокаторы кальциевых каналов. Их можно рассматривать лишь как средства купирования приступа стенокардии в случае непереносимости нитратов.
МИОКАРДИАЛЬНЫЕ ЦИТОПРОТЕКТОРЫ
Из известных в настоящее время миокардиальных цитопротекторов наиболее изученным препаратом с доказанными антиангинальным и антиишемическим действиями является триметазидин. Механизм действия триметазидина связан с подавлением бета-окисления жирных кислот и усилением окисления пирувата в условиях ишемии, что помогает сохранить в кардиомиоцитах необходимый уровень АТФ, снизить внутриклеточный ацидоз и избыточное накопление ионов кальция. Триметазидин модифицированного высвобождения (триметазидин MB) может быть назначен в дозе 35мг 2раза в день на любом этапе терапии стабильной стенокардии для усиления антиангинальной эффективности б-адреноблокаторов, блокаторов кальциевых каналов, нитратов.
ИНГИБИТОРЫ IF-КАНАЛОВ
Препараты данной группы могут быть рекомендованы в случае непереносимости б-адреноблокаторов. В настоящее время на рынке присутствует препарат ивабрадин. Средняя суточная доза 10мг.
ЛЕЧЕНИЕ ВАЗОСПАСТИЧЕСКОЙ СТЕНОКАРДИИ
Назначают блокаторы кальциевых каналов дигидропиридинового ряда. При недостаточном эффекте — нитраты.
ЛЕЧЕНИЕ СИНДРОМА X
Назначение нитратов, б-адреноблокаторов, блокаторов кальциевых каналов в качестве монотерапии или в комбинации.
Статины у больных с гиперлипидемией.
Ингибиторы АПФ у больных с артериальной гипертонией.
У большинства пациентов стенокардия протекает на фоне других сердечно-сосудистых и несердечных заболеваний.
Ориентировочные схемы лечения в таких случаях представлены в табл. 46.
Таблица 46. Рекомендованная терапия при сочетании стенокардии и других заболеваний

ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
РЕВАСКУЛЯРИЗАЦИЯ
Показания к реваскуляризации:
- стенокардия сохраняется, несмотря на проводимую антиангинальную терапию, неинвазивные тесты показывают обширную зону ишемии и/или высокий риск осложнений
- больной предпочитает инвазивные методы лечения
- тяжёлое поражение коронарных артерий по данным коронарной ангиографии см. ниже.
Решение об обследовании для оценки возможности реваскуляризации принимают индивидуально, учитывая наличие у пациента сопутствующей патологии, общий риск смерти и др.
Выбор метода реваскуляризации осуществляют с учётом данных коронарной ангиографии, исследования функции левого желудочка, оценки общего риска смерти и наличия сопутствующей патологии, локального опыта в стационаре, предпочтения пациента.
Коронарное шунтирование улучшает прогноз и устраняет симптомы в следующих случаях:
- при стенозе ствола левой коронарной артерии >50% или его эквиваленте: устьевых стенозах передней нисходящей и огибающей артерий
- при проксимальных стенозах трёх основных артерий, особенно у больных с рефрактерной стенокардией и нарушением функции левого желудочка
- при одно- и двухсосудистом поражении с тяжёлым проксимальным стенозом передней нисходящей артерии у больных с обширной ишемией по данным неинвазивных тестов
- при многососудистом поражении у больных с нарушением функции левого желудочка и признаками жизнеспособного миокарда по данным неинвазивных тестов (стресс-эхоКГ с добутамином), с сахарным диабетом и признаками ишемии по функциональным тестам.
Коронарное шунтирование устраняет симптомы без влияния на прогноз при среднем и тяжёлом течении стенокардии на фоне терапии у больных с однососудистым или многососудистым поражением, подходящих для коронарного шунтирования.
ТРАНСЛЮМИНАЛЬНАЯ БАЛЛОННАЯ КОРОНАРНАЯ АНГИОПЛАСТИКА ТБКА
Не существует убедительных данных, что ТБКА улучшает прогноз у больных со стабильной стенокардией. Однако качество жизни после ТБКА заметно улучшается.
Показания - одно- или двухсосудистое поражение коронарного русла в сочетании с объективными признаками выраженной ишемии миокарда.
В последние годы показания для ТБКА заметно расширяются и процедуру выполняют и при многососудистых поражениях, вплоть до стеноза ствола левой коронарной артерии при невозможности оперативного лечения.
ТБКА показана пациентам с высоким риском выполнения коронарного шунтирования:
- с тяжёлыми сопутствующими заболеваниями
- выраженным нарушением функции левого желудочка
- при необходимости реваскуляризации ствола левой коронарной артерии в случае невозможности проведения коронарного шунтирования.
При наличии многососудистого поражения коронарного русла у больных с сахарным диабетом ангиопластика менее эффективна, чем коронарное шунтирование.
Применение стентов с лекарственным покрытием (сиролимус, паклитаксел) всегда предпочтительнее стентов без покрытия в связи с существенно меньшей частотой рестенозов. Преимущество стентов с лекарственным покрытием особенно ощутимо при стентировании артерии небольшого калибра <2,5мм, хронической тотальной окклюзии, бифуркационных стенозах, стентировании коронарных шунтов, сахарном диабете, многососудистом поражении коронарного русла, нешунтированном стенозе ствола левой коронарной артерии, внутристентовом рестенозе.
После имплантации стентов необходим приём клопидогрела в течение минимум 12мес.
ОБУЧЕНИЕ ПАЦИЕНТА.
Индивидуализированное обучение пациента должно быть частью каждого визита к врачу, причём информацию нужно представлять на доступном для пациента уровне.
Необходимо разработать систематический и индивидуализированный подходы к обучению пациентов. Для обучения больного необходимо:
оценить исходный уровень знаний пациента о его заболевании,
определить, насколько пациент стремится к получению информации о заболевании,
при разговоре определять риск в терминах, понятных пациенту,
по возможности, привлекать к этой работе дополнительный персонал и специалистов по обучению пациентов,
по возможности, использовать профессионально подготовленные наглядные материалы,
привлекать пациента к совместной разработке реалистичного и приемлемого плана лечения,
привлекать к обучению пациента членов его семьи,
периодически возобновлять обучение пациента.
Следует обсудить с пациентом модифицируемые факторы риска, лечение, прогноз, физическую активность, а также способ связи с врачами в случае прогрессирования симптомов или развития острого коронарного синдрома.
При беседе с пациентом необходимо:
рассмотреть важнейшие факторы риска, обращая особое внимание на модифицируемые,
рассмотреть возможные осложнения (нестабильная стенокардия, инфаркт миокарда, сердечная недостаточность, аритмии, внезапная сердечная смерть),
рассмотреть индивидуальный прогноз,
рассмотреть пользу и побочные эффекты приёма ЛС,
рассмотреть правильный режим приёма лекарств (дозы, время приёма, особенности приёма отдельных ЛС),
обсудить ограничения физической активности, включая сексуальную,
внимательно проинструктировать пациента, как и когда связываться с врачом или медицинским учреждением (прогрессирование симптомов или острый коронарный синдром),
проинструктировать пациента, какие симптомы могут указывать на развитие инфаркта миокарда, как экстренно использовать ацетилсалициловую кислоту и нитроглицерин, как связаться с медицинским персоналом скорой помощи (см. Инфаркт миокарда).
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ
В ходе регулярных повторных визитов необходимо оценивать наличие симптомов стенокардии, выполнение врачебных рекомендаций по приёму ЛС и модификации факторов риска.
Следует назначать повторные визиты с периодичностью, основанной на стабильности клинических показателей и необходимости поддерживать регулярные контакты пациента с другими врачами, вовлечёнными в процесс лечения.
Пациентов с эффективно леченой стабильной стенокардией необходимо осматривать каждые 6—12мс.
При записях в амбулаторную карту следует акцентировать внимание на симптомах стенокардии, использовании ЛС и модификации факторов риска.
У пациентов с эффективно леченной стабильной стенокардией при каждом визите оценивают следующие пять характеристик:
- не снизилась ли толерантность больного к физической нагрузке со времени последнего визита
- не усилилась ли стенокардия и не стала ли она возникать чаще со времени последнего визита
- насколько эффективно пациент модифицирует факторы риска и повышает свой уровень знаний о ИБС
- не развилось ли у пациента новое сопутствующее заболевание, не усиливает ли стенокардию недостаточно контролируемое течение сопутствующего заболевания либо его лечение
- каковы приверженность пациента к лечению и побочные эффекты терапии.
Обязательны тщательный осмотр и физикальное обследование, особенно ССС,необходимо отслеживать динамику имевшихся ранее симптомов.
При каждом визите следует взвешивать больного, измерять АД и подсчитывать чсс.
Проводят тщательное обследование сердца, обращая особое внимание на наличие ритма галопа, появление новых или изменение интенсивности имевшихся шумов, локализацию и величину верхушечного толчка.
Выявляют признаки сердечной недостаточности, для чего обращают особое внимание на общее состояние, толерантность к нагрузкам, цвет кожных покровов, отёки, состояние югулярных вен, наличие хрипов в лёгких, гепатомегалии.
Проводят исследование сосудов, включающее пальпацию пульса на периферических артериях и выслушивание сосудистых шумов.
Необходимо использовать лабораторные исследования для оценки эффективности модификации факторов риска (СД и гиперлипидемии).
Оценивают липидный профиль натощак и уровни трансаминаз, КФК в первые 6-8нд после начала липидснижающей терапии. После достижения целевых значений липидов при нормальном уровне трансаминаз и креатинкиназы оценивают липидный профиль каждые 6-12мс.
При возникновении у пациента мышечной слабости или болей в мышцах необходимо определить в крови активность КФК.
У пациентов с СД необходим постоянный контроль гликемии. Оценивают концентрацию гликозилированного гемоглобина как минимум 1раз в год.
Сывороточные концентрации электролитов, функции почек, гемоглобина и функцию щитовидной железы оценивают по показаниям (данные анамнеза, осмотра, предыдущих обследований).
В периодической рутинной записи ЭКГ необходимости нет. При отсутствии изменений симптомов, данных осмотра или изменений режима лечения нет необходимости в регистрации ЭКГ чаще чем 1раз в год.
ЭКГ показана при назначении или изменении дозировок ЛС, влияющих на сердечную проводимость (например, б-адреноблокаторов, дигоксина).
ЭКГ в динамике показана при изменении характера стенокардии, появлении симптомов хронической сердечной недостаточности или симптомов нарушений ритма и/или проводимости, а также при синкопальных и пресинкопальных эпизодах.
Повторные нагрузочные тесты показаны тем пациентам, у которых изменились симптомы, и результат теста может уточнить природу симптомов и повлиять на выбор тактики лечения. Повторные неинвазивные нагрузочные тесты рекомендованы пациентам для оценки эффективности терапии и в случаях, когда рассматривают возможность реваскуляризации.
ПРОГНОЗ
Смертность при стабильной стенокардии составляет 2—3% в год. Фатальный инфаркт миокарда развивается у 2—3% больных.
Мужчины, страдающие стенокардией, в среднем живут на 8 лет меньше, чем те, у кого данная патология отсутствует.
ОСТРЫЙ КОРОНАРНЫЙ СИНДРОМ
Острый коронарный синдром ОКС — временный «рабочий» диагноз, необходимый для первичной оценки, стратификации риска, выбора тактики лечения у больных с обострением ИБС. После непродолжительного наблюдения и диагностики (обычно до 24ч) вариант обострения ИБС уточняют - нестабильная стенокардия НС, ИМ без подъёма сегмента ST, ИМ с подъёмом сегмента ST либо исключают коронарную природу болей. Термин возник для того, чтобы иметь возможность оперативно выбирать лечебную тактику до установления окончательного диагноза. С точки зрения патогенеза процесса, возможности быстрой диагностики и выработки тактики лечения удобно делить ОКС на 2 группы в зависимости от изменений на исходной ЭКГ:
- ОКС с подъёмом сегмента ST (ОКССП ST)
- ОКС без подъёма сегмента ST(ОКСБП ST).
При ОКССП ST в большинстве случаев развивается крупноочаговый инфаркт миокарда.
У больных с ОКСБП ST обычно диагностируют нестабильную стенокардию или мелкоочаговый инфаркт миокарда.
Схема 1. Классификация острого коронарного синдрома.

ОСТРЫЙ КОРОНАРНЫЙ СИНДРОМ БЕЗ ПОДЪЕМА СЕГМЕНТА ST
Острый коронарный синдром без подъёма сегмента SТ (ОКСБП ST) характеризуется наличием ангинозных приступов и отсутствием подъёма сегмента ST на ЭКГ. К ОКСБП ST относят НС и ИМ без подъёма сегмента ST.
Нестабильная стенокардия НС — ухудшение клинической картины стенокардии, выражающееся в увеличении частоты, продолжительности приступов, снижении толерантности к нагрузкам, уменьшении эффективности антиангинальной терапии. К НС относят любые варианты впервые возникшей стенокардии (последние 2мс). Тяжесть и продолжительность приступа при НС недостаточны для развития некроза миокарда. Обычно на ЭКГ нет подъёмов ST. Отсутствует выброс в кровоток биомаркёров некроза миокарда в количествах, достаточных для диагноза ИМ.
Инфаркт миокарда без подъёмов сегмента ST (ИМБП ST) — острая ишемия миокарда, приводящая к его некротическому повреждению. На исходной ЭКГ нет подъёмов ST. У большинства больных, болезнь которых начинается как ИМБП ST, зубцы Q не появляются, и в конце концов им ставят диагноз мелкоочагового ИМ без зубца Q на ЭКГ. ИМБП ST отличается от НС наличием (повышением уровней) маркёров некроза миокарда, которые при НС отсутствуют.
ЭТИОЛОГИЯ
В основе патогенеза ОКСБП ST в большинстве случаев лежит неокклюзирующий пристеночный тромбоз на поверхности повреждённой атеросклеротической бляшки. Иногда к ОКСБП ST приводят другие факторы: спазм коронарных артерий, механическая обструкция (быстрый рост) бляшки, воспаление и/или инфекция. При вторичных формах НС причины экстракардиальные (см. ниже).
Рис. 10. Тромботическая окклюзия коронарной артерии.

ЭПИДЕМИОЛОГИЯ
Ежегодно 2-2,5млн человек в мире поступают в отделения неотложной кардиологии с нестабильной стенокардией или ИМ без подъёма сегмента ST; приблизительно в половине случаев нестабильная стенокардия предшествует ИМ. Ежегодная заболеваемость в индустриально развитых странах мира составляет 6 случаев на 10 000 населения. Пик заболеваемости приходится на седьмую декаду жизни, более 40% пациентов с ОКС относятся к старшей возрастной группе (старше 65 лет); преобладают мужчины.
ПРОФИЛАКТИКА
Профилактика складывается из мероприятий, направленных на устранение факторов риска ИБС (см. Профилактика в разделе Стабильная стенокардия).
СКРИНИНГ
См. раздел Стабильная стенокардия напряжения.
КЛАССИФИКАЦИЯ
Клинические формы НС:
- впервые возникшая стенокардия - приступы стенокардии возникли в течение 2мес
- прогрессирующая стенокардия - частота и/или продолжительность ангинозных приступов увеличивается, толерантность к нагрузкам снижается, появляются приступы в покое, а также снижается эффективность атниангинальных препаратов, при развитии НС больной переходит не менее чем на один класс вверх согласно функциональной классификации
- стенокардия покоя - приступы в покое продолжительностью более 20мин в течение 2мес.
Общепринята клинико-функциональная классификация НС по Браунвальду (1989г)
по тяжести
- класс I - впервые возникшая или прогрессирующая стенокардия напряжения
впервые возникшая (продолжительностью <2мес) стенокардия с тяжелыми или частыми (>3 в день) приступами или стабильная стенокардия с прогрессирующим течением (приступы становятся более частыми, тяжёлыми, продолжительными и провоцируются меньшей нагрузкой, чем ранее). В этот класс не входит стенокардия покоя в течение последних 2мес
- класс II - подострая стенокардия покоя
не менее одного приступа стенокардии покоя на протяжении предшествующего месяца. В этот класс не входит стенокардия покоя за последние 48ч
- класс III - острая стенокардия покоя
не менее одного приступа стенокардии покоя за последние 48ч.
по причинам возникновения
- класс А - вторичная НС
НС вызвана точно установленными внешними причинами, не связанными с поражением коронарного русла: анемией, инфекцией, лихорадкой, гипотонией, тахиаритмией, тиреотоксикозом, дыхательной недостаточностью с гипоксией
- класс В - первичная НС
развивается в отсутствие внесердечных причин, перечисленных в классе А
- класс С - постинфарктная НС
развивается в течение 2нед после ИМ
по интенсивности лечения
- НС в отсутствие лечения или при недостаточной антиангинальной терапии
- НС на фоне оптимальной антиангинальной терапии: б-блокаторы, длительно действующие нитраты, антагонисты кальция
- НС на фоне терапии максимально переносимыми дозами выше указанных трёх групп препаратов, включая нитроглицерин в/в.
ДИАГНОСТИКА
При оценке состояния больного необходимо выяснить:
вероятность взаимосвязи симптомов больного с обострением ИБС,
риск неблагоприятных исходов, включая смерть, ИМ, острую сердечную недостаточность, опасные нарушения ритма сердца.
Внимание!
При подозрении на ОКС нельзя ограничиваться контактом по телефону. Необходим осмотр врача и регистрация ЭКГ в 12 отведениях.
АНАМНЕЗ
В большинстве случаев в анамнезе есть указания на приступы стенокардии или наличие ИБС, перенесённые ИМ. Следует обратить внимание на факторы риска ИБС: отягощенный анамнез, артериальная гипертония, сахарный диабет, гиперлипидемия, курение. Нужно узнать, есть ли у пациента медицинская документация с результатами предшествующих обследований (выписки, ЭКГ). Следует выяснить:
впервые ли возникла боль (дискомфорт) в грудной клетке или боль беспокоит пациента длительное время
увеличивалась ли частота и продолжительность приступов стенокардии, менялась ли реакция на терапию
были ли приступы стенокардии при более низкой физической нагрузке.
Наибольшую тревогу представляют больные, у которых приступы развиваются в покое, продолжаются более 10мин и плохо купируются нитроглицерином.
Необходимо подробно выяснить характер боли: локализацию, субъективное восприятие (давящая, сжимающая боль), иррадиацию, продолжительность, наличие сопутствующих симптомов, расспросить больного о факторах, провоцирующих, усугубляющих или облегчающих боль (см. Стабильная стенокардия).
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Во многих случаях физикальное обследование не позволяет найти отклонения от нормы.
Необходимо обратить внимание на вегетативные реакции при интенсивном болевом синдроме:
бледность, холодный пот, тахикардия, слабость.
Нередко у больного возникают ощущения страха и тревоги.
Можно наблюдать симптомы сердечной недостаточности:
одышку, цианоз, набухание вен шеи, отёки, патологическую пульсацию в области сердца (аневризму).
Следует исключить наличие внесердечных факторов, способных провоцировать или усугубить имеющуюся ишемию миокарда:
лихорадка, тахиаритмии, гипертиреоз (тиреотоксикоз), тяжёлая анемия, стрессовая ситуация или тревожное расстройство, тяжёлая артериальная гипертония или гипертонический криз, тяжёлый аортальный стеноз, тяжёлые сопутствующие заболевания (инфекции, травмы), низкая приверженность предписанному лечению.
Подробный осмотр см. в главе Стабильная стенокардия.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
МАРКЁРЫ ПОВРЕЖДЕНИЯ МИОКАРДА
Всем пациентам с подозрением на ОКС необходимо определить уровень биохимических маркёров некроза миокарда (сердечные тропонины I или Т, КФК и МВ-КФК) сразу и через 6-12ч. Сердечные тропонины I и Т в качестве маркёров некроза миокарда предпочтительнее традиционно определяемых креатинфосфокиназы (КФК) и её МВ-изоформы из-за их большей специфичности и надёжности. В случае отрицательного результата при первом исследовании или в случае, если от момента начала болевого приступа до взятия крови прошло <6ч, следует повторить анализ ч/з 6-12ч. Другие маркёры повреждения (миоглобин, ЛДГ) редко используют в клинической практике.
Внимание!
Повышенный уровень тропонинов Т или I свидетельствует о некрозе клеток миокарда и по современной классификации при наличии ангинозного приступа считается достаточным основанием для постановки диагноза ИМБП ST.

Для каждого маркёра повреждения характерно
- время появления в периферической крови
- пик концентрации
- продолжительность повышения уровня (см. рис. 11). Подробнее лабораторную диагностику см. в главе Инфаркт миокарда.
ОБЩИЙ И БИОХИМИЧЕСКИЙ АНАЛИЗЫ КРОВИ
Всем пациентам с подозрением на ОКС следует провести стандартный общий и биохимический анализы крови для исключения альтернативных диагнозов, факторов, усугубляющих течение стенокардии, скрининга на СД, гиперлипидемии, оценки состояния функции печени и почек.
МАРКЁРЫ ВОСПАЛЕНИЯ
В последнее время воспалению как причине дестабилизации атеросклеротической бляшки уделяют большое внимание. В этой связи широко изучают так называемые маркёры воспаления, в частности С-реактивный белок. Больных, у которых биохимические маркёры некроза миокарда отсутствуют, но повышен уровень С-реактивного белка, относят к группе высокого риска коронарных осложнений.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
ЭКГ. Всем пациентам с подозрением на ОКС снимают ЭКГ в 12 стандартных отведениях.
Необходимо обратить внимание на следующие изменения:
- транзиторная депрессия или подъём сегмента ST
- динамические изменения зубца Т в виде инверсии, увеличения амплитуды острого положительного зубца Т
- впервые появившиеся блокады ножек пучка Гиса.
Внимание!
Следует выяснить, есть ли у больного ранее зарегистрированные ЭКГ, так как наиболее точный диагностический критерий ишемии миокарда - динамика ЭКГ, т.е. разница в положении конечной части желудочкового комплекса ST—T при сравнении с предыдущими ЭКГ. При раде состояний, например, при гипертрофии ЛЖ, электролитных нарушениях, внутрижелудочковых блокадах, на ЭКГ могут постоянно присутствовать изменения, имитирующие ишемию (снижение сегмента ST).
Рис. 12. ЭКГ-признаки ишемии:
- транзиторная депрессия или элевация сегмента ST
- динамические изменения зубца Т в виде инверсии, увеличения амплитуды острого положительного зубца Т
- впервые появившиеся блокады ножек.

ЭхоКГ. Обнаружение во время ангинозного приступа транзиторного нарушения локальной сократимости ЛЖ не является безусловным доказательством ишемической природы болей. ЭхоКГ показана при необходимости дифференциальной диагностики с расслаивающейся аневризмой аорты, гипертрофической кардиомиопатией, аортальным стенозом.
Рентгенография органов грудной клетки позволяет найти признаки сердечной недостаточности, а также исключить другие возможные причины болей в грудной клетке (аневризма грудного отдела аорты, заболевания лёгких).
Сцинтиграфия миокарда. Пациентам с малоинформативными результатами ЭКГ и эхоКГ можно провести сцинтиграфию миокарда с 99mТс-пирофосфатом. У больных с острым повреждением миокарда наблюдают дефект накопления радиофармпрепарата в зоне повреждения.
На основании данных обследования можно оценить вероятность ОКС у больного (табл. 47).
Таблица 47. Вероятность ОКСБП ST

После установления диагноза ОКС следует идентифицировать группу риска развития фатального и нефатального ИМ в ближайший период.
Таблица 48. Стратификация риска ОКСБП ST

Если больной жалуется на боль в грудной клетке, предположительно связанную с ОКС, после первичной диагностики возможны следующие варианты:
- ОКС
- возможный ОКС
- стабильная стенокардия
- внесердечные причины.
Алгоритм обследования и лечения больных с подозрением на ОКС показан на схеме 2.
Схема 2. Алгоритм обследования и лечения больных с подозрением на ОКС.

ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальную диагностику болей в грудной клетке см. Стабильная стенокардия. При развитии интенсивного приступа болей в груди см. Инфаркт миокарда.
В первую очередь следует исключать другие причины болевого синдрома, требующие немедленной помощи и госпитализации:
- острое расслоение аорты
- ТЭЛА
- кровотечение из верхних отделов ЖКТ
Для упрощения дифференциальной диагностики ниже представлены жалобы больного, которые должны заставить врача искать экстракардиальные причины болей:
- плевритическая боль (острая, «прокол ножом», связанная с дыханием и кашлем)
- первичная локализация боли в мезо- и гипогастральной области
- боль, которая по площади не превышает кончика пальца (точечная), особенно в области верхушки сердца
- боль, вызываемая движением или пальпацией грудной клетки или рук
- постоянная боль в течение нескольких часов
-очень короткие эпизоды болей (несколько секунд)
- боль, иррадиирующая в ноги.
ЛЕЧЕНИЕ
ЦЕЛИ ЛЕЧЕНИЯ
- восстановление/улучшение кровотока в поражённой коронарной артерии
- профилактика окклюзии артерии (ИМ)
- уменьшение или устранение симптомов
- профилактика и лечение осложнений
- улучшение прогноза и увеличение продолжительности жизни (предупреждение ИМ и внезапной сердечной смерти).
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Немедленная госпитализация в кардиологический блок интенсивной терапии БИТ
- подозрение на ОКС
- продолжающийся дискомфорт в груди в покое
- нестабильная гемодинамика
- признаки недостаточности кровообращения
- синкопэ
- ишемические изменения на ЭКГ.
- при высокой вероятности осложнений ОКС.
Госпитализация в кардиологическое или терапевтическое отделение
- при промежуточной вероятности ОКС для уточнения диагноза.
При низкой вероятности ОКС (по мнению врача-кардиолога) возможно обследование и уточнение диагноза в амбулаторных условиях в тот же день: нагрузочная проба, суточное ЭКГ-мониторирование, эхоКГ, определение уровня липидов и т.д. При невозможности пройти амбулаторное обследование в тот же день необходимо госпитализировать больного. Нельзя рекомендовать больному на следующий день записаться на приём к кардиологу.
Лечение больных с ОКСБП ST можно разделить на три этапа:
догоспитальный,
во время транспортировки
госпитальный.
ДОГОСПИТАЛЬНЫЙ ЭТАП
Внимание!
Всех пациентов с подозрением на ОКС следует рассматривать и вести как больных ОКС до уточнения диагноза.
На догоспитальном этапе при первом контакте пациента с врачом (участковым, кардиологом поликлиники) следует провести клиническую оценку состояния больного, определить причину болевого синдрома, оценить индивидуальный риск ОКС (см. табл. 48)
Необходимо вызвать бригаду скорой помощи и экстренно госпитализировать в лечебное учреждение, имеющее БИТ для кардиологических больных или специализированное кардиологическое отделение.
По возможности, следует госпитализировать больного в медицинское учреждение, где проводят коронароангиографию.
Больному нужно обеспечить соблюдение постельного режима
Ацетилсалициловая кислота показана всем больным с подозрением на ОКС при отсутствии противопоказаний. Если больной не принимал её раньше, первая доза составляет 250-500 мг препарата, не покрытого оболочкой, который следует разжевать для ускорения эффекта
При продолжающейся боли нитроглицерин под язык. Нитроглицерин можно принимать повторно с интервалом 5 мин при условии постоянного контроля уровня АД. При развитии гипотонии следует занять горизонтальное положение с приподнятыми ногами.
Больному следует принять б-блокатор короткого действия внутрь при отсутствии явных клинических противопоказаний (выраженные гипотония, брадикардия, тяжёлая застойная сердечная недостаточность, бронхиальная астма и т.д.). Наиболее оптимален приём 20-40 мг пропранолола.
Важно замечать и устранять факторы, способствующие усугублению ишемии - повышение АД, сердечная недостаточность, аритмии.
При наличии данных за ОКС (впервые возникшая или прогрессирующая стенокардия), но в ближайшие 48ч без сильного приступа стенокардии тактика:
направление на обследование и лечение в специализированное кардиологическое учреждение, но не обязательно в экстренном порядке;
ацетилсалициловая кислота, если больной её ещё не получает.
ЛЕЧЕНИЕ ВО ВРЕМЯ ТРАНСПОРТИРОВКИ
- обеспечить в/в доступ
- купировать болевой синдром. При недостаточном эффекте нитроглицерина использовать наркотические анальгетики: морфин в/в 5-10 мг. По возможности начать в/в введение нитроглицерина
- ацетилсалициловая кислота (разжевать) 250-500мг препарата, не покрытого оболочкой, если больной её ещё не принимает
- ЭКГ
- ввести в/в струйно нефракционированный гепарин в дозе 70ЕД/кг (не более 5000ЕД) или низкомолекулярный гепарин (эноксапарин 1мг/кг подкожно)
- оценить выраженность факторов, способствующих усугублению ишемии: гипертонии, сердечной недостаточности, аритмии. Принять меры к их устранению
- ингаляция О2 при сохраняющемся приступе.
ЛЕЧЕНИЕ В СТАЦИОНАРЕ
Тактика лечения больных с ОКСБП ST зависит от степени риска осложнений (см. табл. 48, 49). В основе патогенетического лечения лежит антитромботическая терапия дезагрегантами и антикоагулянтами. Для снятия симптомов используют антиангинальные препараты, прежде всего парентеральный нитроглицерин. Для больных группы высокого риска (см. табл. 49) следует применять активную тактику. Таких пациентов направляют в специализированное отделение для проведения экстренной коронароангиографии с последующей транслюминальной баллонной ангиопластикой или коронарным шунтированием. Если перевести пациента в специализированное отделение невозможно, следует стабилизировать состояние с помощью медикаментозной терапии. Больных с низким риском осложнений лечат консервативно. В кардиологическом блоке интенсивной терапии больной обычно проводит 1-2 дня, затем при стабилизации состояния его переводят в обычное отделение. При отсутствии ангинозных приступов на 3-7 сутки проводят стресс-тест. Больным со значительной ишемией во время теста, особенно при низкой толерантности к нагрузке, следует выполнить коронароангиографию и, в зависимости от её результатов, процедуру реваскуляризации миокарда (ангиопластику или коронарное шунтирование).
Таблица 49. Критерии высокого риска осложнений у больных ОКСБП ST

В случае сомнительного диагноза ОКС верификация должна занимать не более 2-3 дней. При нетипичном для коронарных характере болей, отсутствии изменений на ЭКГ за период наблюдения, нормальном уровне маркёров некроза миокарда, нормальных результатах нагрузочного теста следует искать экстракардиальные причины. Целесообразно обследовать другие органы и системы. Риск развития сердечно-сосудистых осложнений у таких больных низкий. Возможны дополнительные обследования в амбулаторных условиях.
Существуют два подхода лечения верифицированного ОКССП ST. «агрессивный» (ранний инвазивный) и консервативный (схема 3). Выбор тактики зависит от оснащённости учреждения, принятой в нём тактики, опыта врачей, предпочтения пациента.

НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Обеспечение покоя (строгий постельный режим) в 1-е сутки
Отказ от курения.
Антигиперлипидемическая диета.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Ацетилсалициловая кислота в дозе 160-325мг.
Клопидогрел - нагрузочная доза 300 мг перорально, затем по 75 мг/сут. Противопоказания: подтверждённая гиперчувствительность, активное кровотечение, обострение язвенной болезни, кровоизлияние в мозг.
Блокаторы гликопротеиновых IIb/IIIa рецепторов (абциксимаб) при планируемом вмешательстве на коронарных артериях.
Гепарин нефракционированный в дозе 80ЕД/кг в/в болюсом, затем в/в инфузия со скоростью 12-18ЕД/кг/ч (1250ЕД/кг/ч) либо низкомолекулярный гепарин эноксапарин натрий в дозе 1мг/кг п/к каждые 12ч.
Внутривенная инфузия нитроглицерина. Начальная скорость введения 10мкг/мин. Затем её увеличивают на 10мкг/мин каждые 3-5мин до появления реакции АД или улучшения симптоматики. Не следует снижать АД <100мм рт.ст. у нормотоника или более 25% от исходного у пациента с гипертонией. Максимальная доза (скорость введения) нитроглицерина 200мкг/мин.
Б-Адреноблокаторы. При нестабильной гемодинамике, признаках сердечной недостаточности начинают введение б-блокаторов парантерально. При отсутствии указанных признаков препараты назначают сразу перорально:
- метопролол в дозе 5мг в/в медленно каждые 5мин до достижения максимальной дозы 15мг или желаемой чсс около 60, затем 25-50мг перорально каждые 8ч
- атенолол в дозе 5мг в/в, затем 50-100мг 1р в день
- пропранолол в дозе 0,5-1мг в/в, затем 40-80мг каждые 6-8ч
- эсмолол в дозе 0,1мг/кг/мин в/в с увеличением скорости введения на 0,05мг/кг/мин до общей дозы 0,2мг/кг/мин
В случае непереносимости или недостаточном эффекте б-адреноблокаторов пациентам с нормальной сократительной способностью миокарда левого желудочка можно назначить недигидропиридиновые блокаторы кальциевых каналов (дилтиазем, верапамил).
ОБУЧЕНИЕ ПАЦИЕНТА
Необходимо разъяснить пациенту природу его заболевания и возможные причины, способствовавшие развитию ОКС.
Следует настоятельно рекомендовать пациенту прекратить курение.
Необходимо дать пациенту рекомендации по липидоснижающей диете.
Следует убедиться, что пациент ясно представляет себе необходимость выполнения предписаний врача.
Следует настроить пациента на постоянный длительный приём препаратов, мотивируя рекомендации существенным улучшением качества жизни, уменьшением риска осложнений. Нужно подчеркнуть, что назначаемые препараты специально разработаны и проверены для длительного приёма, их обычно хорошо переносят, они не ухудшают самочувствие.
Больной должен знать основные побочные эффекты препаратов и во всех случаях их развития сразу обращаться к врачу.
Следует проинструктировать пациента о лечебной тактике в случае возникновения приступа стенокардии.
При развитии приступа стенокардии следует принимать нитроглицерин в виде спрея или таблеток. Если приступ не купируется, нитроглицерин принимают с интервалом 5мин под контролем АД. Предпочтительно занять горизонтальное положение.
Если приступ не купируется в течение 10 мин, необходимо вызвать бригаду скорой помощи.
Нужно описать пациенту признаки нестабильной стенокардии и необходимые меры её профилактики.
При уменьшении толерантности к нагрузкам, учащении приступов, появлении приступов в покое, снижении эффективности антиангинальных препаратов следует безотлагательно обратиться к врачу.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Если есть подозрения на заболевания, которые могут имитировать стенокардию либо усугублять её течение, необходимы консультации соответствующих специалистов: невропатолога, эндокринолога, пульмонолога, гастроэнтеролога, гематолога и т.д.
Если у пациента есть признаки декомпенсации углеводного обмена, необходима консультация эндокринолога.
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ
После выписки пациента с ОКС контрольное обследование проводят в пределах 3сут. В дальнейшем частота визитов к врачу зависит от состояния больного и группы риска, к которой он относится. При стабильном состоянии частота визитов составляет 1 раз в месяц первые полгода, далее 1-2р в год.
Необходимо проводить оценку и коррекцию факторов риска ИБС (см. Стабильная стенокардия).
Больные после ОКС нуждаются в ограничении физических нагрузок в течение 1-2мес. У больных с успешной реваскуляризацией, особенно ТБКА, указанный период может быть меньше.
В качестве вторичной профилактики ОКС всем больным показан приём следующих групп препаратов:
- ацетилсалициловая кислота 75-150мг/сут
- б-блокаторы
- липидоснижающая терапия (статины)
- больным артериальной гипертонией, сахарным диабетом, дисфункцией левого желудочка показан прием ингибиторов АПФ.
Подробно лечение см. Стабильная стенокардия
Больным, которым проводили ТБКА со стентированием, назначают клопидогрел в дозе 75мг/сут в течение года. Учитывая совместное назначение двух дезагрегантов (ацетилсалициловой кислоты и клопедогрела) следует тщательно контролировать геморрагические осложнения и инструктировать больного, что при появлении любых спонтанных кровотечений и гематом нужно отменить приём дезагрегантов и немедленно обратиться к врачу.
При ухудшении состояния обсудить с больным возможность реваскуляризации.
Внимание!
Одна из основных причин высокой заболеваемости и смертности от ИБС в России - недостаточная осведомлённость врачей и пациентов о современных возможностях инвазивного лечения.
ПРОГНОЗ
Частота развития серьёзных осложнений (смерть, ИМ, необходимость экстренной реваскуляризации) у госпитализированных больных с НС составляет 5-7% в первые 7дней и до 15% в первые 30дней после развития ОКС. 5-15% пациентов с НС умирают в течение 1-го года после развития клинических проявлений. При своевременной диагностике и правильном лечении у 80-90% пациентов с нестабильной стенокардией болевой синдром купируется в течение 48ч.
Реваскуляризация существенно улучшает прогноз больных с НС.
ИНФАРКТ МИОКАРДА
Инфаркт миокарда ИМ - очаг некроза миокарда, формирующийся вследствие резкого ухудшения коронарного кровотока и сопровождающийся развитием характерной клинической картины, электрокардиографических изменений и динамикой маркеров повреждения миокарда.
Причиной инфаркта миокарда в абсолютном большинстве случаев служит внутрикоронарный тромбоз. Другие этиологические факторы: спазм, механическая закупорка (кровоизлияние в атеросклеротическую бляшку, отслойка интимы), эмболия в коронарную артерию, встречают редко. Патоморфологической основой для развития ИМ чаще всего служит коронарный атеросклероз.
В редких случаях к ИМ приводят следующие заболевания, не связанные с коронарным атеросклерозом.
- артерииты - болезнь Такаясу, узелковый периартериит, ревматоидный артрит, СКВ, анкилозирующий спонидилёз
- травма артерии - радиация, ятрогенные факторы, ранения
- метаболические болезни - мукополисахаридозы, гомоцистинурия, амилоидоз
- уменьшение просвета сосуда - диссекция аорты, диссекция коронарных артерий, спазм (стенокардия Принцметала)
- эмболии коронарных артерий - инфекционый эндокардит, пролапс митрального клапана, внутрисердечные тромбы, тромбоз лёгочных вен, искусственные клапаны, миксома
- врождённая патология коронарных артерий - отхождение ЛКА от лёгочной артерии, артериовенозные фистулы, аневризмы коронарных артерий
- гематологические болезни - истинная полицитемия, тромбоцитозы, ДВС, тромбоцитопеническая пурпура
- употребление кокаина.
КОДЫ МКБ-10
I21 Острый инфаркт миокарда
I21.0 Острый трансмуральный инфаркт передней стенки миокарда
I21.1 Острый трансмуральный инфаркт нижней стенки миокарда
I21.2 Острый трансмуральный инфаркт миокарда других уточнённых локализаций
I21.3 Острый трансмуральный инфаркт миокарда неуточнённой локализации
I21.4 Острый субэндокардиальный инфаркт миокарда
I2Г.9 Острый инфаркт миокарда неуточнённый
I22 Повторный инфаркт миокарда (коды локализации такие же, как и в п. 121).
Критерии ИМ, разработанные экспертами Европейского общества кардиологов и Американской коллегии кардиологов (2000).
Критерии острого, развивающегося или недавнего ИМ - типичное повышение и снижение активности биохимических маркеров некроза миокарда в сочетании с не менее, чем с одним из следующих признаков:
- клинические проявления ишемии миокарда
- наличие патологических зубцов Q
- изменения на ЭКГ ишемического характера
- вмешательства на коронарных артериях
- патоморфологические признаки острого инфаркта миокарда.
Критерии установленного ИМ (один из признаков)
- появление новых патологических зубцов Q на серии ЭКГ
- патоморфологические признаки старого или заживающего ИМ.
ЭПИДЕМИОЛОГИЯ
В США около 500 000 человек, во Франции около 120 000 ежегодно переносят инфаркт миокарда с подъёмом сегмента ST. Пик заболеваемости приходится на 6-7-ю декаду жизни. От сердечно-сосудистых заболеваний в мире ежегодно умирают около 12 млн человек. Большинство этих случаев связано с ИМ. Тогда как в развитых индустриальных странах заболеваемость ИМ прогрессивно снижается, в развивающихся странах и странах с переходной экономикой, к которым относится и РФ, ИМ остаётся ведущей причиной смертности больных и заболеваемость очень высокая.
Около 1/3 больных ИМ погибают в течение первых суток, а многие выжившие остаются инвалидами. Половина больных умирают догоспитально, не дождавшись медицинской помощи.
Госпитальная смертность составляет в среднем около 10%. Причём в ведущих клиниках она приближается к 5%, тогда как во многих регионах РФ смертность около 15%. Еще 10% больных ИМ умирают в течение года.
В возрасте от 40 до 70лет мужчины болеют ИМ чаще женщин. После 70 лет половой разницы в заболеваемости ИМ нет.
Инфаркт миокарда редко встречают в возрасте до 45 лет. Среди молодых пациентов в основном больные инсулинозависимым сахарным диабетом, с тяжёлой гиперлипидемией, отягощенным семейным анамнезом. Пик заболеваемости приходится на возраст 65-75 лет.
Таблица 50. Факторы риска развития инфаркта миокарда

ПРОФИЛАКТИКА И СКРИНИНГ
См. Стабильная стенокардия.
КЛАССИФИКАЦИЯ ИМ
по изменению ST на ЭКГ:
- ИМ с подъёмом сегмента ST (сюда относят также остро возникшую блокаду левой ножки пучка Гиса)
- ИМ без подъёма сегмента ST
по изменению Q на ЭКГ:
- ИМ с формированием патологических зубцов Q
- ИМ без формирования патологических зубцов Q
обычно ИМ с подъёмом сегмента ST соответствует развивающийся крупноочаговый ИМ с эволюцией в ИМ с формированием патологических зубцов Q
по размерам очага некроза:
- крупноочаговый (трансмуральный) ИМ
- мелкоочаговый ИМ
по локализации очага некроза:
- ИМ передней стенки левого желудочка (передний ИМ)
- ИМ боковой стенки левого желудочка (боковой ИМ)
- изолированный ИМ верхушки сердца
- ИМ нижней стенки ЛЖ (нижний ИМ)
- ИМ задней стенки ЛЖ
- ИМ межжелудочковой перегородки
- ИМ правого желудочка
- ИМ предсердии
возможны сочетанные локализации: задненижний, переднебоконой и т.д.
по счету:
- первичный ИМ
- повторный ИМ
- рецидивирующий ИМ
по периоду развития:
- острейший период от начала болевого приступа до формирования очага некроза (первые 4-6ч)
- острый период до окончательного формирования очага некроза (до 2нд)
- подострый период до формирования рубца (до 1-2мс)
- постинфарктный период (после 1-2мс).
ДИАГНОСТИКА
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
АНАМНЕЗ
Факторы риска развития ИМ перечислены выше. У больных со стенокардией в анамнезе следует обратить внимание на особенности течения болезни, частоту приступов, реакцию на терапию, появление затяжных приступов, приступов в покое. Если больной ранее перенес ИМ, важно выяснить, доступна ли выписка из стационара, предыдущие ЭКГ. В выписке обратить внимание на локализацию ИМ, реперфузионную терапию (если проводилась, то каким препаратом), реваскуляризацию, транслюминальную баллонную коронарную ангиопластику и аортокоронарное шунтирование ТБКА или АКШ.
При сборе анамнеза важно уточнить наличие противопоказаний к тромболитической терапии (см. табл. 53).
ЖАЛОБЫ
Основным клиническим признаком ИМ служит интенсивный болевой синдром в грудной клетке. Сила болевого приступа настолько велика, что часто наблюдают вегетативные реакции вплоть до потери сознания, страх смерти. При оценке состояния больного необходимо уточнить характер болевых ощущений, интенсивность, локализацию, продолжительность, наличие иррадиации, провоцирующие и облегчающие боль факторы:
- болевой приступ обычно продолжается более 30мин
- в большинстве случаев приём нитроглицерина и покой либо не купируют болевой приступ, либо облегчают его не полностью
- ангинозный приступ нередко развивается в предутренние часы без наличия чёткого провоцирующего фактора
- боль, усиливающаяся при дыхании, изменении положения тела или пальпации грудной клетки, уменьшает вероятность диагноза ИМ
- сердечный приступ может сопровождаться слабостью, обмороками, потливостью, перебоями в работе сердца, сердцебиением, эмоциональным возбуждением, страхом, одышкой, кашлем, отсутствием сознания (обмороком).
В ряде случаев ИМ начинается не с типичной боли в грудной клетке. Следует обратить внимание на наличие других жалоб.
Около половины ИМ диагностируют ретроспективно, из них половина безболевые. Чаще бессимптомные или малосимптомные формы ИМ наблюдают у пожилых (особенно женщин), у больных сахарным диабетом
У пациентов пожилого возраста основным клиническим проявлением ИМ может быть остро возникшая одышка
Среди других симптомов следует обратить внимание на учащённое сердцебиение, ощущение перебоев в работе сердца, абдоминальный дискомфорт, тошноту, рвоту, предобморочное состояние, выраженную слабость, избыточное потоотделение, тревогу, страх.
Варианты нетипичной манифестации ИМ представлены на рис. 14.
Рис. 14. Нетипичное начало инфаркта миокарда

В зависимости от течения заболевания в острейшем периоде выделяют несколько клинических вариантов:
- ангинозный status anginosus
- абдоминальный status gastralgicus
- астматический status asthmaticus
- аритмический
- церебральный
- безболевой (малосимптомный).
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
При неосложнённом течении ИМ физикальное исследование обычно не выявляет отклонений от нормы. Основная задача клинического обследования - раннее выявление осложнений. Важны следующие симптомы:
- наличие самостоятельного дыхания, проходимость дыхательных путей, пульсация на периферических артериях
- внешний вид: тревога, страх, беспокойство, бледность, цианоз, избыточное потоотделение (холодный липкий пот)
- тахикардия или брадикардия, экстрасистолия
- набухание, пульсация ярёмных вен
- ослабление тонов, S3 или S4, шум митральной и трикуспидальной регургитации, шум трения перикарда, грубый шум при разрыве МЖП
- одышка, кашель, хрипы в лёгких, кровохарканье
- повышение или снижение АД
- неврологические симптомы.
При осмотре больного с подозрением на ИМ врач должен прежде всего оценить параметры гемодинамики АД, пульс, частоту дыхания. При отсутствии сознания, пульса, самостоятельного дыхания следует немедленно начать сердечно-лёгочную реанимацию.
РЕЗОРБЦИОННО-НЕКРОТИЧЕСКИЙ СИНДРОМ
После развития ИМ продукты распада миокарда попадают в кровоток, вызывая системный воспалительный ответ, который принято называть резорбционно-некротическим синдромом. Он характеризуется следующими признаками:
- лихорадка до 38°С не более 1нд, если лихорадка превышает 38°С и/или продолжается более недели, следует искать другие причины повышения температуры
- лейкоцитоз обычно не больше 15000, к концу 1-й недели возвращается к нормальному уровню
- повышение СОЭ начинается к концу 1-й недели, продолжается несколько недель
- анэозинофилия до нескольких недель.
Оценка степени левожелудочковой недостаточности, в соответствии с классификацией Т.Killip:
- Killip I признаков левожелудочковой недостаточности нет
- Killip II умеренная левожелудочковая недостаточность - влажные хрипы не более чем над 50% поверхности лёгких
- Killip III клиническая картина отёка лёгких
- Killip IV шок.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Определение биохимических маркеров некроза миокарда составляет основу диагностики ИМ (табл. 51), однако оно не должно быть причиной задержки проведения реперфузионной терапии.
В клинической практике используют следующие маркеры повреждения:
- внутриклеточные ферменты:
креатинфосфокиназа КФК
КФК-МВ mass активность
КФК-МВ изоформы
лактатдегидрогеназа ЛДГ
ЛДГ изоформы
аспартатаминотрансфераза АСТ
- внутриклеточные белки:
сердечные тропонины I и Т
миоглобин.
Таблица 51. Динамика основных маркеров повреждения после инфаркта миокарда

Оптимально определение содержания сердечных тропонинов I и Т и МВ-фракции КФК в плазме или цельной антикоагулированной крови, при этом время от взятия крови до получения результата не должно превышать 1ч. Целесообразно иметь в поликлинике оборудование для экспресс-определения уровня тропонинов. В ряде случаев, когда у пациента сомнительные жалобы и недиагностическая ЭКГ, определение уровня тропонинов может помочь в верификации диагноза.
СЕРДЕЧНЫЕ ТРОПОНИНЫ I И Т
Преимущества:
- чувствительность и специфичность выше, чем у КФК-МВ
- возможна поздняя диагностика ИМ в течение 2нд.
Недостатки:
- низкая чувствительность в ранние сроки ИМ (меньше 4—6ч от начала симптомов)
- ограниченная возможность выявлять небольшие повторные ИМ.
Возможно повышение уровня тропонинов при других заболеваниях:
- ТЭЛА
- острый перикардит
- острая сердечная недостаточность
- миокардит
- почечная недостаточность
- электрическая кардиоверсия
- электрическая аблация
- сепсис
- ложно-положительные реакции (гетерофильные антитела, ревматоидный фактор, сгустки фибрина, нарушение работы анализатора).
КФК
КФК-МВ остаётся наиболее доступным маркером некроза миокарда.
Преимущества:
- быстрый, дешёвый, точный анализ
- возможность выявить ранний повторный инфаркт.
Недостатки:
- низкая специфичность (см. ниже)
- низкая чувствительность в ранние сроки ИМ (меньше 6ч от начала симптомов и больше 36ч от начала ИМ)
- низкая чувствительность при небольших повреждениях миокарда (определяемых тропонином).
При отсутствии возможности определения содержания тропонинов или КФК-МВ определяют активность общей КФК, которая должна превышать нормальный уровень в 2 и более раз (низкая специфичность).
Необходимо серийное определение содержания биохимических маркеров через 6-8ч в течение первых суток, далее ежедневно до нормализации.
Причины повышения КФК и КФК-МВ:
- внутримышечные инъекции
- лекарственные препараты: статины, фибраты, никотиновая кислота
- приём алкоголя
- воспалительные миопатии (системные заболевания)
- инфекционные болезни
- миодистрофии
- рабдомиолиз
- периодический паралич
- болезни ЦНС (амиотрофический боковой склероз)
- эндокринные миопатии (гипотиреоз, акромегалия).
Всем больным ИМ следует определять следующие лабораторные показатели исходно, а в случае отклонения от нормы контролировать в динамике:
- общий анализ крови с подсчётом тромбоцитов
- международное нормализованное отношение MHO
- активированное частичное тромбопластиновое время АЧТВ
- электролиты и магний
- мочевина
- креатинин
- глюкоза
- липиды
- общий анализ мочи.
ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА
ЭЛЕКТРОКАРДИОГРАФИЯ
ЭКГ остаётся самым важным диагностическим инструментом при ИМ. В классическом варианте после острой окклюзии коронарной артерии на ЭКГ последовательно возникают изменения, соответствующие различной степени острой ишемии миокарда (рис. 15).
Рис. 15. Изменения на ЭКГ, соответствующие различной степени острой ишемии миокарда.
1 степень ишемии характеризуется появлением высоких симметричных и заострённых зубцов Т.
2 степень ишемии характеризуется подъёмом сегмента ST без изменений конечной части комплекса QRS.
3 степень ишемии характеризуется подъёмом сегмента ST с изменениями конечной части комплекса QRS.

Всем пациентам с подозрением на ИМ следует как можно быстрее зарегистрировать ЭКГ в 12 стандартных отведениях. Если больной находится в поликлинике, в которой есть электрокардиограф, то в идеале в течение 10мин зарегистрировать ЭКГ.
ЭКГ-признаки развивающегося ИМ:
- в двух соседних отведениях
- элевация сегмента SТ на уровне точки J >2мм в отведениях V1-V3 и >1мм в отведениях I, II, III, aVL, aVF, V4-V6
- патологический зубец Q любой в отведениях V1—V3 и >0,03с в отведениях I, II, III, aVL, aVF, V4-V6
- для ИМ не характерна статичная «застывшая» ЭКГ. Напротив, особенностью ЭКГ при ИМ служит характерная динамика, заключающаяся в формировании патологического зубца Q или комплекса QS, постепенном снижении сегмента ST, образовании отрицательных зубцов Т. Если изменения на ЭКГ неизменны и не претерпевают указанной динамики, то диагноз ИМ должен вызывать сомнение.
Исходная ЭКГ не обладает достаточной чувствительностью, чтобы исключить ИМ. Если на ЭКГ отсутствуют изменения, характерные для ИМ, но сохраняется боль в грудной клетке, следует повторно регистрировать ЭКГ с интервалом 5—10 мин или проводить постоянное мониторирование ЭКГ в 12 отведениях.
Всем больным с нижним ИМ необходимо регистрировать ЭКГ в правых прекардиальных отведениях для исключения инфаркта правого желудочка (см. ЭКГ 4).
Почти в 10% случаев у пациентов с ИМ изменения на ЭКГ отсутствуют. Даже при отсутствии диагностически значимых изменений на ЭКГ при наличии клинических признаков следует исключать развитие ИМ.
Блокада левой ножки пучка Гиса БЛНПГ существенно затрудняет ЭКГ-диагностику ИМ. Поэтому остро возникшая БЛНПГ при наличии клинических признаков острой ишемии миокарда считается ЭКГ-признаком ИМ (см. ЭКГ 5).
Если у пациента имплантирован постоянный ЭКС, стимулятор, при возможности, временно перепрограммируют на меньшую частоту; это позволяет оценить ЭКГ на фоне собственного ритма (следует помнить, что длительная ЭКС сама по себе может вызвать нарушения реполяризации).
В случае подозрения на ИМ задней локализации (высокоамплитудные зубцы R в отведениях V1—V3), может понадобиться регистрация ЭКГ в дополнительных грудных отведениях V7, V8, или V9.
Важно знать и обращать внимание на другие возможные причины подъёма сегмента ST:
синдром ранней реполяризации желудочков,
БЛНПГ,
гипертрофия левого желудочка,
аневризма левого желудочка,
стенокардия Принцметала,
острый перикардит,
синдром Бругада,
субарахноидальное кровоизлияние (см. ЭКГ 7—12).
Диагностическая ценность ЭКГ увеличивается при сравнении с предшествующими ЭКГ.
На начальном диагностическом этапе ЭКГ служит основным методом определения локализации ИМ (см. табл. 52 и ЭКГ 1-6).
Таблица 52. Локализация ИМ на основании ЭКГ

ПНА передняя нисходящая артерия, ОА огибающая артерия, ПКА правая коронарная артерия.
ЭХОКАРДИОГРАФИЯ ЭХОКГ
С помощью эхоКГ можно подтвердить диагноз, но этот метод не может быть единственным диагностическим критерием ИМ.
Основной признак ИМ — выявление участков нарушенной сократимости миокарда.
ЭхоКГ позволяет определить локализацию, что особенно важно при недиагностической ЭКГ.
С помощью эхоКГ можно оценить функцию ЛЖ, визуализировать перенесённые ИМ.
ЭхоКГ — более чувствительный метод, чем ЭКГ для диагностики ИМ правого желудочка.
ЭхоКГ — основной метод выявления следующих осложнений ИМ:
разрыв межжелудочковой перегородки,
разрыв свободной стенки ЛЖ,
дисфункция и отрыв папиллярных мышц,
формирование аневризмы ЛЖ,
внутриполостного тромбоза.
КОРОНАРНАЯ АНГИОГРАФИЯ КАГ
Обнаружение острой окклюзии вместе с клиническими симптомами - точный диагноз ИМ.
Преимуществом КАГ является возможность немедленно выполнить механическую реканализацию сосуда.
Показана для решения вопроса о проведении первичной ангиопластики.
РЕНТГЕНОГРАФИЯ ГРУДНОЙ КЛЕТКИ
Рутинное обследование для больных с болями в грудной клетке.
Позволяет проводить дифференциальную диагностику с заболеваниями лёгких.
Позволяет выявлять и контролировать признаки левожелудочковой недостаточности.
Не должна быть причиной задержки реперфузионной терапии, когда диагноз представляется ясным.
СЦИНТИГРАФИЯ С ТЕХНЕЦИМ99-ПИРОФОСФАТОМ
Показания для проведения:
- подтверждение диагноза, локализация инфаркта, размер поражения
- оценка реперфузии.
КТ, МРТ ГРУДНОЙ КЛЕТКИ
Показания для проведения:
- подозрение на расслоение аорты
- ТЭЛА (КТ с контрастированием лёгочных артерий — основной метод диагностики ТЭЛА)
- дифференциальная диагностика с заболеваниями лёгких.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Врач поликлиники может оказаться первым врачом, к которому обращается больной с болями в грудной клетке. Необходимо чётко представлять особенности клинической картины развивающегося ИМ, а также знать, какие заболевания и состояния могут протекать с подобными клиническими проявлениями. От точности постановки диагноза зависит правильный выбор места последующего обследования и лечения, своевременность начала лечебных мероприятий. При подозрении на развитие ИМ следует проводить дифференциальную диагностику со следующими заболеваниями:
- болезни сердца: миокардит, перикардит, расслоение аорты, вазоспастическая стенокардия, аортальный стеноз, ГКМП, синдром WPW, синдром ранней реполяризации, синдром Бругады
- болезни ЖКТ: язвенная болезнь желудка и двенадцатиперстной кишки, панкреатит, спазм пищевода, эзофагит, гастрит, холецистит, холелитиаз
- болезни легких: ТЭЛА, пневмоторакс, плеврит
- другие: корешковый синдром, плексит, миозит, субарахноидальное кровоизлияние, герпес, паническая атака.
Ниже представлены особенности клинической картины заболеваний, с которыми наиболее часто приходится проводить дифференциальную диагностику при подозрении на ИМ.
Расслаивающая аневризма аорты. Обычно начинается с приступа интенсивных болей в грудной клетке с иррадиацией в спину, часто похожих на боли при ИМ. При физикальном обследовании возможно выслушивание грубого систолического шума на аорте, проводящегося на сонные артерии. При распространении расслоения до подключичных артерий наблюдают асимметрию пульса. На ЭКГ чаще отсутствуют признаки ишемии миокарда. В редких случаях процесс может затрагивать устья коронарных артерий, тогда дифференциальная диагностика особенно затруднена, так как развивается типичный ангинозный приступ и «инфарктная» динамика ЭКГ. При малейших подозрениях на расслоение аорты необходимо провести эхоКГ, КТ, МРТ. Огромная важность правильной дифференциальной диагностики между ИМ и расслоением аорты определяется ещё и тем, что тромболитическая терапия ТЛТ, необходимая для эффективного лечения ИМ, абсолютно противопоказана при расслоении аорты.
Тромбоэмболия легочных артерий. Боль часто острая, плевритического характера и сопровождается одышкой, иногда кровохарканьем. При физикальном обследовании надо обратить внимание на состояние вен ног. Аускультативно в лёгких в 1-е сутки развития ТЭЛА могут отсутствовать патологические изменения, при развитии инфарктной пневмонии выслушивают хрипы, ослабление дыхания. При рентгенографии органов грудной клетки до развития пневмонии можно обнаружить обеднение сосудистого рисунка. На ЭКГ признаки перегрузки правых отделов сердца (см. ЭКГ 7): феномен QIII~SI, блокада правой ножки пучка Гиса ПНПГ, р-pulmonale. Подтвердить диагноз можно с помощью вентиляционно-перфузионной сцинтиграфии лёгких, КТ с контрастированием лёгочных артерий, иногда проводят ангиографию лёгочных артерий.
Острый перикардит. Часто предшествует простудное заболевание. Боль в левой половине грудной клетки, обычно колющая, режущая, иногда по интенсивности сопоставимая с ИМ, связана с дыханием, усиливается на вдохе, зависит от положения тела. Может выслушиваться шум трения перикарда. На ЭКГ характерны элевации сегмента ST, затрагивающие многие отведения, как стандартные, так и грудные, носящие конкордантный характер, т.е. имеющие одно направление с комплексом QRS (см. ЭКГ 9). Патологические зубцы Q и комплексы QS не формируются. Возможно повышение уровня маркеров повреждения миокарда за счёт повреждения субэпикардиальных зон миокарда.
Острый миокардит. Иногда предшествует простудное заболевание. Характерен более молодой возраст по сравнению с ИМ. Миокардит может манифестировать с болями в грудной клетке. На ЭКГ могут быть низкоамплитудные зубцы R в грудных отведениях, даже комплексы QS (см. ЭКГ 12), однако типичную для ИМ динамику ЭКГ наблюдают крайне редко, и обычно она связана с сопутствующим коронариитом. Для постановки правильного диагноза часто приходится проводить КАГ, которая у больных миокардитом, как правило, не выявляет признаков выраженного атеросклероза.
Острый панкреатит. Часто предшествует погрешность в диете. Боль в верхней половине живота, иногда захватывающая грудную клетку, опоясывающая, иногда с иррадиацией в спину. Возможны симптомы раздражения брюшины. На ЭКГ могут быть отклонения конечной части желудочкового комплекса ST-T. Следует определять уровень амилазы крови и/или мочи.
Язвенная болезнь желудка. Боль в области эпигастрия, иногда нижней части грудной клетки. Характерна выраженная болезненность при пальпации живота, могут быть симптомы раздражения брюшины. При прободении язвы боль резкая, очень интенсивная, почти всегда симптомы раздражения брюшины. На ЭКГ могут быть отклонения конечной части желудочкового комплекса ST-T. Показана экстренная гастроскопия.
Межрёберная невралгия, торакалгия. Боль колющая, режущая, локализованная. Характерна болезненность при пальпации межрёберных промежутков. На ЭКГ обычно нет отклонений от нормы.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Если у врача на основании сбора анамнеза, осмотра, физикального исследования, ЭКГ есть основания предполагать другие причины болей в грудной клетке, может потребоваться консультация специалистов: кардиолога, хирурга, гастроэнтеролога, пульмонолога.
ЛЕЧЕНИЕ
ЦЕЛИ ЛЕЧЕНИЯ
— восстановление нарушенного коронарного кровотока и поддержание проходимости поражённой коронарной артерии
- ограничение размеров очага поражения (некроза)
- профилактика и лечение угрожающих жизни осложнений.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
При подозрении на ИМ необходимо немедленно вызвать бригаду скорой помощи СМП и госпитализировать больного в специализированное кардиологическое отделение, желательно в блок интенсивного наблюдения. Основанием для госпитализации могут служить только клинические симптомы даже при неизмененной ЭКГ.
Наибольшую смертность от ИМ наблюдают в течение 1-го часа с момента развития ангинозного приступа. Принципиально важное значение для судьбы больного имеет максимальное сокращение времени тотальной ишемии миокарда. Самый лучший прогноз у больных, которым восстанавливают коронарный кровоток в течение 1ч. В развитых странах перед службами, задействованными в лечении больных ИМ (терапевты, кардиологи, скорая помощь, блоки интенсивного наблюдения), поставлена задача, чтобы время от начала болезни до восстановления кровотока не превышало 2ч. Главная причина поздней госпитализации состоит в том, что больные не сразу обращаются за медицинской помощью, вследствие, прежде всего, недостаточной информированности. Задача врачей поликлиники — объяснять больным причины развития ИМ, основные клинические проявления и, конечно, необходимость при подозрении на ИМ вызывать бригаду скорой медицинской помощи.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
До приезда бригады скорой медицинской помощи необходимы следующие мероприятия:
- обеспечить соблюдение постельного режима
- ацетилсалициловая кислота показана всем больным с подозрением на ИМ при отсутствии противопоказаний. Если больной раньше не принимал ацетилсалициловую кислоту, первая доза составляет 250—500мг препарата, не покрытого оболочкой, который следует разжевать для ускорения начала действия препарата
- нитроглицерин под язык, можно повторно с интервалом 5мин при условии контроля за уровнем АД. При развитии гипотонии следует занять горизонтальное положение с приподнятыми ногами
- б-адреноблокатор короткого действия внутрь при отсутствии явных противопоказаний (выраженные гипотония, брадикардия, тяжёлая застойная сердечная недостаточность, бронхиальная астма), оптимально дать 20-40мг пропранолола
- если больной на момент приступа находится в поликлинике, зарегистрировать ЭКГ в 12 отведениях.
ЛЕЧЕНИЕ БРИГАДОЙ СМП
- ацетилсалициловая кислота 250-500мг, если не назначена раньше
- мониторное наблюдение за сердечной деятельностью
- в/в доступ, следует избегать пункции некомпрессируемых вен (подключичная вена), учитывая повышенный риск кровотечений, связанный с тромболитической терапией
- нитроглицерин или изосорбида динитрат сублингвально или спрей каждые 5мин до 3р или в/в инфузия с начальной скоростью 10мкг/мин. При сохраняющемся болевом синдроме дозу повышают до снижения среднего АД на 10-15% от исходного, но не ниже 100мм рт.ст., при ГБ снижать систолическое АД на 20-25%
- ингаляция кислорода со скоростью потока 2-4л/мин
- для купирования болевого синдрома морфин в/в 2—4мг каждые 5мин по потребности
- оптимально начинать тромболитическую терапию специализированными бригадами СМП догоспитально
- при тахикардии, повышенном АД б-адреноблокатор в/в пропранолол по 1мг дробно из расчёта 0,1мг/кг при отсутствии противопоказаний.
Пациенты с ИМ должны быть госпитализированы в блок интенсивной терапии.
ЛЕЧЕНИЕ В СТАЦИОНАРЕ
Порядок ведения больного в блоке интенсивной терапии:
- обеспечить постоянный внутривенный доступ
- проводить постоянное ЭКГ-мониторирование
- всем пациентам назначают строгий постельный режим в течение 12-24ч, сидеть разрешают через 24ч, на 3-й день режим может быть расширен до палатного
- в первые 12ч диета состоит только из жидкой пищи, затем рацион расширяют до обычной диеты для кардиологических больных
- следует оценить состояние отправления естественных физиологических потребностей и при необходимости назначить препараты, размягчающие каловые массы
- лекарственная терапия: тромболитическая терапия,..
ТРОМБОЛИТИЧЕСКАЯ ТЕРАПИЯ
Тромболитическая терапия — главный патогенетический метод лечения ИМ с подъёмом сегмента ST. Проведение тромболитической терапии показано пациентам с клинической картиной острого коронарного синдрома (боль или дискомфорт в грудной клетке продолжительностью более 30мин, не устраняющиеся после приёма нитропрепаратов или покоя) при давности начала заболевания менее 12ч и наличии на ЭКГ одного из перечисленных признаков: остро возникшая (или предположительно остро возникшая) элевация сегмента ST в точке J в 2 или более смежных отведениях >2мм в отведениях V1-V3 и >1мм в остальных отведениях, остро возникшая (или предположительно остро возникшая) БЛНПГ (затрудняющая анализ сегмента S), депрессия сегмента ST в V1-V3 в сочетании в высоким зубцом R, предполагающая задний ИМ (показана регистрация ЭКГ в дополнительных отведениях V7-V9).
Важно знать и оперативно оценить наличие противопоказаний к проведению тромболитической терапии (табл. 53).
Таблица 53. Противопоказания тромболитической терапии
Абсолютные противопоказания:
- геморрагический инсульт или инсульт неизвестной этиологии в анамнезе
- ишемический инсульт в предшествующие 6мс
- отсутствие сознания
- расслоение стенки аорты
- повреждение или новообразования ЦНС
- недавняя (предшествующие 3нд) обширная травма, операция или повреждение головы
- желудочно-кишечное кровотечение в предшествующий 1месяц
- геморрагический диатез.
Относительные противопоказания:
- транзиторное нарушение мозгового кровообращения в предшествующий 1месяц
- лечение антикоагулянтами непрямого действия
- беременность и 1-я неделя после родоразрешения
- нарушение целостности стенки сосудов, не поддающихся прижатию
- травматичные реанимационные мероприятия
- рефрактерная тяжёлая артериальная гипертония
- тяжёлые нарушения функции печени
- инфекционный эндокардит
- язвенная болезнь в фазе обострения.
Максимальный положительный эффект от тромболитической терапии можно ожидать в первые 3ч от начала болезни, а особенно в течение первого, «золотого» часа.
При наличии стандартных показаний к проведению тромболизиса показано назначение любого из тромболитических препаратов. Выбор препарата для проведения тромболизиса определяется его доступностью и стоимостью. Всегда предпочтительней применение фибринспецифичных препаратов.
Основные побочные эффекты при использовании ТЛТ:
- кровотечение
- лихорадка
- артериальная гипотония
- сыпь
- анафилаксия
- реперфузионные аритмии.
АНТИКОАГУЛЯНТЫ
Антикоагулянты показаны при совместном использовании с фибринспецифичными тромболитиками. При применении стрептокиназы антикоагулянты не используют. Продолжительность терапии 1-2сут. При наличии специальных показаний — внутрисердечный тромбоз, тяжёлая сердечная недостаточность, венозные тромбозы, ТЭЛА — продолжительность антикоагулянтной терапии может увеличиваться.
Гепарин нефракционированный в дозе 80ЕД/кг в/в болюсом, затем внутривенная инфузия со скоростью 12-18ЕД/кг/ч (1250 ЕД/кг/ч) или низкомолекулярный гепарин эноксапарин натрий в дозе 1мг/кг п/к каждые 12ч).
![]() Таблица
54. Сравнительная характеристика тромболитических препаратов
Таблица
54. Сравнительная характеристика тромболитических препаратов

ДЕЗАГРЕГАНТЫ
- ацетилсалициловая кислота 250-500мг, если не назначена раньше. Поддерживающая доза 75—150мг/сут
- клопидогрел — нагрузочная доза 300мг перорально, затем по 75мг/сут. Противопоказания: подтверждённая гиперчувствительность, активное кровотечение, обострение язвенной болезни, кровоизлияние в мозг. В настоящее время доказана эффективность применения клопидогрела в течение периода госпитализации. Если проводилась ТБКА со стентированием, клопидогрел назначают в течение года
- блокаторы гликопротеиновых IIЬ/IIIа рецепторов (абциксимаб, итегрилин, тирофибан) показаны больным при планируемой ТБКА.
НИТРОГЛИЦЕРИН
Внутривенная инфузия нитроглицерина. Начальная скорость введения 10мкг/мин. Затем она увеличивается на 10мкг/мин каждые 3—5мин до появления реакции АД или улучшения симптоматики. Не следует снижать АД ниже 100мм рт.ст. у нормотоника или более чем на 25% от исходного у пациента с гипертонией. Максимальная доза (скорость введения) нитроглицерина 200мкг/мин. Продолжительность инфузии нитроглицерина при неосложнённом течении ИМ 12-24ч. В случае рецидивирования ангинозных приступов, неконтролируемой артериальной гипертонии, левожелудочковой недостаточности продолжительность терапии увеличивается.
Б-АДРЕНОБЛОКАТОРЫ
Учитывая выраженные гемодинамические эффекты б-адреноблокаторов, начинать введение с препаратов короткого действия парентерально (эсмолол, пропранолол). Далее переходить на пролонгированные препараты. Обращать внимание на противопоказания: гипотония, брадиаритмии, бронхиальная астма и т.д.
ИНГИБИТОРЫ АПФ
Показаны в ранние сроки ИМ всем больным с передним ИМ, фракцией выброса ЛЖ <40%, артериальной гипертонией, сахарным диабетом. Начинают терапию с препаратов короткого действия (каптоприл по 6-12мг 2—3р в день).
БЛОКАТОРЫ РЕЦЕПТОРОВ АНГИОТЕНЗИНА II
Назначают при непереносимости ингибиторов АПФ. Показания те же, что для ингибиторов АПФ.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
ПЕРВИЧНАЯ КОРОНАРНАЯ АНГИОПЛАСТИКА
Данный метод лечения ИМ используют как альтернативу ТЛТ для восстановления коронарного кровотока. Преимущества первичной ТБКА:
- вероятность восстановления коронарного кровотока более 95%
- одномоментное устранение инфаркт-связанного стеноза коронарной артерии с помощью имплантации стента
- снижение риска геморрагических осложнений, связанных с ТЛТ.
Недостатки первичной ТБКА:
- большая стоимость лечения на начальном этапе
- необходимость наличия дорогостоящего оборудования и круглосуточного дежурства опытной бригады специалистов
- осложнения, связанные с пункцией артерии.
При принятии решения, какой способ восстановления кровотока выбрать ТЛТ или ТБКА, следует иметь в виду ряд факторов, представленных в табл. 55.
Таблица 55. Сравнение ТЛТ и первичной ТБКА при ИМ
ТЛТ предпочтительней
- менее 3ч от начала симптомов
- если по сравнению с ТЛТ задержка времени для проведения ТБКА превышает 1ч
- если время от контакта с врачом в больнице до начала ТБКА превышает 90мин
- отсутствует ангиографическая лаборатория для проведения ТБКА
- недостаточный опыт персонала
- трудности с сосудистым доступом (тяжёлый периферический атеросклероз, врождённые аномалии)
ТБКА предпочтительней
- наличие ангиографической лаборатории и опытного персонала
- более 3ч от начала симптомов
- если по сравнению с ТЛТ задержка времени для проведения ТБКА не превышает 1ч
- если время от контакта с врачом в больнице до начала ТБКА не превышает 90мин
- кардиогенный шок
- сердечная недостаточность Killip 3 и более
Противопоказания к ТЛТ:
- диагноз ИМ сомнителен
ОТСРОЧЕННАЯ ТБКА
Показания
- инвазивные стратегии лечения инфаркта миокарда
- сохранение ангинозного приступа после ТЛТ и/или отсутствие косвенных признаков реперфузии на ЭКГ (быстрое снижение сегмента ST >50% ч/з 3ч в наиболее информативных отведениях)
- рецидив ИМ
- постинфарктная стенокардия
- нестабильность гемодинамики: тяжёлая сердечная недостаточность, артериальная гипотония, кардиогенный шок
- рецидивирующая желудочковая тахикардия и фибрилляция желудочков.
В вышеперечисленных случаях может возникнуть необходимость перевода пациента в стационар, в котором существует возможность проведения ТБКА.
АОРТОКОРОНАРНОЕ ШУНТИРОВАНИЕ
В связи с высоким риском осложнений коронарное шунтирование в острый период ИМ проводят редко.
Показания:
- неэффективная или осложнённая баллонная коронарная ТБКА
- проведение ТБКА сопряжено с высоким риском (стеноз ствола левой коронарной артерии)
- механические осложнения ИМ: разрыв свободной стенки ЛЖ, разрыв межжелудочковой перегородки, дисфункция папиллярных мышц с тяжёлой митральной регургитацией, отрыв хорд митрального клапана, в таких случаях наряду с коррекцией дефекта проводят коронарное шунтирование.
ЛЕЧЕНИЕ ОСЛОЖНЕНИЙ ИМ
ОТЁК ЛЁГКИХ
Для раннего выявления отёка лёгких внимательно контролировать общее состояние больного, частоту дыхания, уровень АД, диурез, проводить аускультацию лёгких. При обширных передних ИМ оправдано превентивное введение лазикса 20—40мг. Всем больным необходимо провести рентгенографию лёгких, которая выявляет признаки венозного лёгочного застоя на ранних стадиях.
- ингаляция кислорода
- фуросемид в/в 0,5—1мг/кг
- морфин 2—4мг
- нитроглицерин в/в при АД >100мм рт.ст
- допамин 5—15мкг/кг/мин при АД 70—100мм рт.ст. и признаках развивающегося шока. Добутамин 2-20мкг/кг/мин при АД 70-100мм рт.ст. и отсутствии признаков шока
- ингибиторы АПФ короткого действия (каптоприл) при АД >100мм рт.ст.
При отсутствии реакции на терапию и гипотонии — внутриаортальная баллонная контрпульсация.
При некупируемом отёке лёгких показана экстренная коронарография и попытка восстановления кровотока.
РЕЦИДИВ ИМ
- экстренная реперфузионнная терапия: ТЛТ или ТБКА
Повторное введение стрептокиназы противопоказано.
КАРДИОГЕННЫЙ ШОК
Кардиогенный шок обусловлен резким снижением сократительной функции миокарда ЛЖ и клинически определяется как состояние, сопровождающееся стойкой артериальной гипотензией (систолическое АД ниже 90мм рт.ст. в течение более 30мин) и признаками гипоперфузии периферических тканей (нарушение сознания, похоладание конечностей, цианоз, олигурия). Сердечный индекс <2,2л/(минм2).
Лечение осуществляют на фоне мониторирования показателей центральной гемодинамики.
- допамин 5—15мкг/кг/мин), добутамин 2—20мкг/кг/мин, норэпинефрин 0,5-30мкг/мин
- ингаляция кислорода, при необходимости ИВЛ.
При отсутствии реакции на прессорные амины — внутриаортальная баллонная контрпульсация.
Экстренная реваскуляризация — самый эффективный способ лечения кардиогенного шока.
ГИПОВОЛЕМИЯ
Введение плазмозамещающих растворов, чаще под контролем показателей центральной гемодинамики.
Иногда прессорные амины.
Лечение причины, приведшей к гиповолемии. Например, восстановление кровотока при инфаркте правого желудочка.
НАРУШЕНИЯ СЕРДЕЧНОГО РИТМА У БОЛЬНЫХ С ИНФАРКТОМ МИОКАРДА
Желудочковые аритмии (тахикардия, экстрасистолия, фибрилляция).
У всех больных с ИМ необходимо поддерживать нормальный уровень электролитов (калий, магний) в крови.
Желудочковая экстрасистолия обычно не требует лечения. Проходит самостоятельно или после коррекции уровня электролитов. При ранних экстрасистолах R на Т, являющихся предвестником опасных аритмий, возможно назначение антиаритмической терапии.
При пароксизмах устойчивой ЖТ с нарушением гемодинамики или фибрилляции желудочков показана экстренная ЭИТ.
Профилактическое введение лидокаина не показано. Применение лидокаина показано как неотложная терапия при устойчивой или рецидивирующей неустойчивой желудочковой тахикардии с нарушениями гемодинамики, а также после фибрилляции желудочков. Лидокаин вводят болюсом 1мг/кг, затем по половине этой дозы каждые 8—10мин максимально до 4мг/кг, далее инфузия 1—3мг/мин.
Другими препаратами выбора для лечения желудочковых нарушений ритма служат б-адреноблокаторы и амиодарон.
Амиодарон применяют по схеме: 5мг/кг в течение часа, далее 900-1200мг в течение суток.
При рецидивировании фибрилляции желудочков, желудочковой тахикардии, особенно после 2сут от начала ИМ, следует ставить вопрос об установке кардиовертера-дефибриллятора.
Применение препаратов I класса для лечения желудочковых нарушений ритма у больных с ИМ сопровождается увеличением смертности и не рекомендуется.
Мерцание предсердий. Во многих случаях желудочковый ритм не высокий, переносимость хорошая и специального лечения не требуется. При частом ритме вводят б-адреноблокаторы, купируют с помощью прокаинамида, амиодарона, нитрофенилдиэтиламинопентилбензамида. При неконтролируемом сердечном ритме, развитии ангинозного приступа, появлении и/или прогрессировании сердечной недостаточности проводят кардиоверсию.
Встречаются и другие виды суправентрикулярных тахикардии, обычно они купируются самостоятельно. Для восстановления ритма используют б-адреноблокаторы, иногда верапамил. При АВ-узловой тахикардии возможно применение АТФ под строгим контролем ритма и АД. При нестабильной гемодинамике — кардиоверсия.
При синусовой брадикардии, синоатриальных блокадах или АВ-блокаде II степени типа Мобитц-1, сопровождающихся артериальной гипотонией, ишемией миокарда, развитием или утяжелением сердечной недостаточности, а также выскальзывающими желудочковыми аритмиями начальная тактика заключается в назначении атропина в/в 0,3—0,5мг, при необходимости повторно с интервалами 5-10мин до суммарной дозы 1,5-2мг).
Электрокардиостимуляция показана при асистолии, клинически выраженной брадикардии (в том числе включая АВ-блокаду II степени типа Мобитц-1 с артериальной гипотонией), двух- или трёхпучковой блокаде, АВ-блокаде II степени типа Мобитц-2, полной поперечной блокаде. При обширном переднем ИМ даже при АВ-блокаде I степени, появлении блокады ЛНПГ показана превентивная установка зонда-электрода в связи с высоким риском развития полной поперечной блокады с гемодинамически неэффективным замещающим ритмом.
ПОСТИНФАРКТНАЯ СТЕНОКАРДИЯ
Всегда рассматривается как нестабильная с высокой вероятностью развития ИМ.
АНТИАНГИНАЛЬНАЯ ТЕРАПИЯ
(см. раздел Стенокардия).
Не используют блокаторы кальциевых каналов из группы дигидропиридинов короткого действия.
КОРОНАРОГРАФИЯ И РЕВАСКУЛЯРИЗАЦИЯ
При выраженной ишемической динамике ЭКГ коронарографию проводят экстренно.
РАЗРЫВ МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКИ
Опасное осложнение, начинающееся обычно с боли в груди, одышки, гипотонии. Может быстро прогрессировать левожелудочковая недостаточность, развиться кардиогенный шок. Выслушивают грубый систолический шум. Диагноз подтверждают с помощью эхоКГ. Лечение хирургическое. Иногда устанавливают окклюдер в место дефекта с помощью внутрисосудистой техники. На период подготовки к операции лечение симптоматическое.
РАЗРЫВ СВОБОДНОЙ СТЕНКИ ЛЖ
Смертность более 99%. Проявляется потерей сознания и электромеханической диссоциацией. Диагноз подтверждают с помощью эхоКГ. Лечение только хирургическое. Во время подготовки к операции реанимационные мероприятия с эвакуацией крови из полости перикарда.
ОТРЫВ ПАПИЛЛЯРНЫХ МЫШЦ
Начинается с внезапной быстро прогрессирующей одышки, гипотонии. Обычно быстро развивается отёк лёгких. Диагноз подтверждают с помощью эхоКГ. Лечение только хирургическое. На период подготовки к операции лечение симптоматическое.
ЭПИСТЕНОКАРДИТИЧЕСКИЙ ПЕРИКАРДИТ
Развивается в первые дни ИМ. Проявляется болью в прекардиальной области, связанной с дыханием, положением тела. Может выслушиваться шум трения перикарда. На ЭКГ появление или увеличение элевации сегмента ST как в стандартных, так и грудных отведениях (не всегда). Для лечения применяют нестероидные противовоспалительные препараты, в тяжёлых случаях глюкокортикоиды.
СИНДРОМ ДРЕССЛЕРА
Развивается, начиная со 2-й недели ИМ. Проявляется в виде перикардита, плеврита, иногда полиартрита. Возможна лихорадка. Лечение: глюкокортикоидные гормоны.
ВНУТРИПОЛОСТНОЙ ТРОМБОЗ ЛЖ
Чаще развивается при обширных инфарктах. Выявляют с помощью эхоКГ. При обнаружении тромба с признаками неоднородной структуры, фрагментации, флотации существует высокий риск тромбоэмболических осложнений. В таких случаях показана терапия непрямыми антикоагулянтами (варфарин) с поддержанием MHO в интервале 2-3. Через 3—4 нед повторная эхоКГ для оценки динамики тромба. Небольшие плоские тромбы обычно не требуют лечения.
ТАКТИКА ВЕДЕНИЯ БОЛЬНЫХ ИМ В СТАЦИОНАРЕ
При ежедневных осмотрах оценить общее состояние больного, наличие жалоб, обращать внимание на цвет кожных покровов, состояние вен шеи, наличия отёков, частоту дыхания, пульса, уровень АД. Внимательно проводить аускультацию сердца и лёгких. У больных с признаками сердечной недостаточности контролировать диурез, массу тела. Строго ограничивать количество потребляемой жидкости. Повторная регистрация ЭКГ. В 1-е сутки ИМ определить уровень липидов крови. При неосложнённом течении ИМ на 5—7-е сутки проводят нагрузочную пробу для выявления ишемии миокарда. В случае неспособности больного выдержать физическую нагрузку проводят фармакологические пробы (добутами новая с эхоКГ) или сцинтиграфию миокарда. ЭхоКГ желательно провести в 1-е сутки и перед выпиской из стационара для оценки сократительной функции Л Ж и характера ремоделирования полости ЛЖ после ИМ в динамике.
ПОКАЗАНИЯ КОРОНАРНОЙ АНГИОГРАФИИ:
- постинфарктная стенокардия
- обширный ИМ с ФВ <40%
- тяжёлая сердечная недостаточность
- рецидивирующая желудочковая тахикардия и фибрилляция желудочков
- признаки ишемии миокарда по данным нагрузочных проб, суточного мониторирования ЭКГ.
Следует отметить, что последнее время становится всё больше сторонников концепции, согласно которой коронарная ангиография показана всем больным, перенесшим ИМ.
ОСОБЫЕ СИТУАЦИИ
ИНФАРКТ МИОКАРДА ПРАВОГО ЖЕЛУДОЧКА
ИМ нижней стенки в 20—50% случаев сочетается с ИМ правого желудочка.
Клинические проявления, характерные для ИМ правого желудочка:
- набухание вен шеи
- артериальная гипотония
- парадоксальный пульс
- олигурия
- отсутствие клинических признаков застоя по малому кругу
- шум трикуспидальной регургитации.
Во всех случаях нижнего ИМ следует зарегистрировать ЭКГ в дополнительных правых грудных отведениях.
Особенности лечения больных с ИМ правого желудочка:
- следует избегать назначения нитратов, вазодилататоров, диуретиков в связи с риском тяжёлой гипотонии
- тактика ведения пациентов с ИМ правого желудочка включает применение следующих препаратов: плазмозамещающие растворы до 2—4л в/в, добугамин 2,5-5 мкг/кг/мин при отсутствии положительного эффекта от введения растворов.
ОБУЧЕНИЕ ПАЦИЕНТА
См. Острый коронарный синдром.
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ
После выписки пациента с ИМ контрольное обследование проводят в пределах 3сут, в дальнейшем частота визитов к врачу зависит от состояния больного и последствий перенесённого ИМ. При стабильном состоянии частота визитов составляет 1р в месяц первые полгода, далее 1—2р в год.
Необходимо проводить оценку и коррекцию факторов риска ИБС (см. Стабильная стенокардия).
Врачу необходимо проводить вторичную профилактику ИМ по всем направлениям.
Лекарственная терапия
- антиагреганты: аспирин 75—150мг постоянно, клопидогрел 75мг в течение года, если проводилась ТБКА
- б-адреноблокаторы
- липидснижающая терапия: статины (цель ХС ЛПНП <2,6ммоль/л или 100мг/дл), фибраты если уровень триглицеридов на фоне терапии статинами 200—499мг/дл, при уровне триглицеридов >500мг/дл начинают сразу с фибратов
- ингибиторы АПФ — особенно больным обширным ИМ (ФВ <40%), повышенным АД, с сахарным диабетом, при непереносимости ингибиторов АПФ блокаторы рецепторов ангиотензина-II
- лечение сердечной недостаточности, нарушений ритма, повышенного АД.
АРТЕРИАЛЬНАЯ ГИПЕРТОНИЯ
Поддержание АД на целевом уровне ниже 140 и 90мм рт.ст., при почечной недостаточности и сахарном диабете ниже 130 и 80мм рт.ст.
КУРЕНИЕ
Прекращение (при необходимости фармакотерапия, психотерапия). Рекомендовать прекратить курить на каждом визите.
МАССА ТЕЛА
Целевой уровень индекса массы тела 18,5-24,9кг/м2.
ДИЕТА
Средиземноморская диета. Увеличение содержания омега-3-жирных кислот.
ФИЗИЧЕСКАЯ РЕАБИЛИТАЦИЯ
Индивидуальные программы физической реабилитации. Минимальная нагрузка — прогулки по 30—60мин 3—4р в неделю.
ПСИХИЧЕСКАЯ РЕАБИЛИТАЦИЯ
Лечение тревоги и депрессии. Обсуждение вопросов социальной реабилитации, сексуальной активности и т.д.
САХАРНЫЙ ДИАБЕТ
Оптимизация гликемического контроля совместно с эндокринологом. Цель: HbAlc <7%.
Внимание!
При сохранении или появлении стенокардии после ИМ, особенно при недостаточной эффективности антиангинальной терапии, рекомендовать больным проведение коронарной ангиографии.
Больных с повышенным риском внезапной смерти следует направлять в специализированные лечебные учреждения для установки дефибриллятора-кардиовертера. Риск внезапной смерти высокий при следующих состояниях:
- желудочковые аритмии, не связанные с реперфузией (т.е. более поздние): рецидивирующая тахикардия, фибрилляция
- резкое снижение сократимости миокарда ЛЖ (ФВ <30%).
ПРОГНОЗ
Критерии неблагоприятного прогноза:
- клинические: пожилой возраст, сахарный диабет, артериальная гипотония, чсс >100 в минуту, хроническая сердечная недостаточность, обширный ИМ с ФВ <40%, частая желудочковая экстрасистолия или желудочковая тахикардия спустя первые 48ч от начала ИМ
- инструментальное обследование: признаки ишемии по данным нагрузочных проб, желудочковые нарушения ритма (частая экстрасистолия, пароксизмы тахикардии) по данным суточного мониторирования ЭКГ, при эхоКГ обширные зоны нарушенной сократимости, ФВ <40, аневризма ЛЖ.
- ангиографические: многососудистое поражение коронарных артерий, сохраняющаяся окклюзия или плохой кровоток в сосуде, снабжающем зону ИМ, фракция выброса левого желудочка <40%, аневризма ЛЖ.
ЭКГ 1. ИМ передней локализации.

ЭКГ 2. ИМ нижней локализации.

ЭКГ 3. ИМ задней локализации.

ЭКГ 4. Нижний ИМ + правый желудочек.

ЭКГ 5. Передний ИМ + блокада ЛНПГ.

ЭКГ 6. Передний ИМ + блокада ПНПГ.

ЭКГ 7. ТЭЛА.

ЭКГ 8. ДКМП.

ЭКГ 9. Перикардит.

ЭКГ 10. Гиперкалиемия.

ЭКГ 11. Субарахноидальное кровоизлияние.

ЭКГ 12. Миокардит.

ВНЕЗАПНАЯ СЕРДЕЧНАЯ СМЕРТЬ
Внезапная сердечная смерть ВСС — неожиданная смерть от сердечных причин, произошедшая в течение 1 ч от появления симптомов у пациента с известной сердечной болезнью или без неё.
КОД МКБ-10
I46.1 Внезапная сердечная смерть.
ЭПИДЕМИОЛОГИЯ
Частота ВСС составляет от 0,36 до 1,28 на 1000 населения в год. У мужчин в возрасте от 60 до 69лет, страдающих заболеванием сердца, частота ВСС достигает 8 на 1000 человек в год. В США ежегодно наблюдают около 325 000 случаев ВСС. Пик распространённости ВСС приходится на возраст 45—75 лет.
Основной контингент больных ВСС — пациенты с тяжёлой сердечной недостаточностью и ФВЛЖ <30%, перенёсшие ИМ, больные после сердечно-лёгочной реанимации.
Распространённость ВСС пропорциональна заболеваемости ИБС. Соответственно, до 65 лет случаи ВСС чаще регистрируют у мужчин, после 65 лет половых различий нет. Всего внезапно умирают 21% мужчин и 14,5% женщин, 40% случаев ВСС происходит без свидетелей.
ЭТИОЛОГИЯ
Непосредственным механизмом смерти при ВСС у 80—85% больных служит фибрилляция желудочков, в остальных случаях выявляют брадиаритмии и асистолию. Большинство больных (около 80%) ВСС страдают ИБС и переносили ИМ. Другие причины — кардиомиопатии дилатационная, гипертрофическая, аритмогенная кардиомиопатия правого желудочка. Генетические заболевания ионных каналов: синдром удлинённого интервала Q-T, синдром Бругада, клапанные пороки сердца: аортальный стеноз, пролапс митрального клапана; синдром предвозбуждения (синдром WPW); ТЭЛА и т.д.
Принимая во внимания, что к развитию ВСС приводят заболевания сердца с различной этиологией и патогенезом, целесообразно вопросы стратификации риска первичной и вторичной профилактики рассматривать отдельно по каждой нозологии.
ПРОФИЛАКТИКА
Группа высокого риска: перенёсшие инфаркт миокарда, имеющие признаки дисфункции левого желудочка, а также угрожающие жизни желудочковые аритмии в анамнезе.
Группа среднего риска: лица с множественными факторами риска коронарного атеросклероза, клиническими проявлениями ИБС.
Факторы риска ВСС в основном соответствуют факторам риска коронарного атеросклероза, поэтому профилактика ВСС в общей популяции сводится к профилактическим мероприятиям в отношении ИБС.
Рекомендации по профилактике ВСС при различной кардиологической патологии (см. ниже) ранжированы следующим образом:
- инфаркт миокарда и сердечная недостаточность. У больных с инфарктом миокарда ВСС становится результатом фибрилляции желудочков, блокады сердца или асистолии. В течение 2,5 лет после ИМ (если в острую фазу инфаркта миокарда тромболитическая терапия не проводилась) 75% случаев смерти связаны с аритмиями. У 60% больных, умерших от аритмии, смерти предшествовали симптомы ишемии миокарда. Стратификация риска у больных после ИМ с наличием сердечной недостаточности или без неё представлена ниже. Ведущие факторы риска: предшествующие эпизоды остановки сердца, синкопальные состояния, предшествующий ИМ (особенно в течение 6мс), фракция выброса ЛЖ <30—35%, частая желудочковая экстрасистолия, неустойчивая желудочковая тахикардия. Другие факторы риска: непроходимость инфаркт-связанной артерии, низкая вариабельность сердечного ритма, увеличенный объём Л, тахикардия в покое, поздние потенциалы желудочков. Первичная профилактика: б-адреноблокаторы, ингибиторы АПФ, ацетилсалициловая кислота, гиполипидемические средства (статины). Менее доказано применение полиненасыщенных жирных кислот, амиодарона. Имплантация кардиовертера-дефибриллятора показана больным после ИМ с дисфункцией ЛЖ и ФВ <30% или сочетанием дисфункции ЛЖ с ФВ <40% и пароксизмов желудочковой тахикардии, а также при тяжело переносимых пароксизмах желудочковой тахикардии, особенно при отсутствии эффекта антиаритмической терапии, при устойчивой желудочковой тахикардии, индуцируемой программированной электрической стимуляцией. Амиодарон и б-адреноблокаторы показаны больным с гемодинамически хорошо переносимой желудочковой тахикардией. В этом же случае можно рассматривать имплантацию кардиовертера-дефибриллятора, радиочастотную аблацию, хирургическое лечение. Блокаторы рецепторов альдостерона показаны для больных с дисфункцией ЛЖ. Реваскуляризация — чрескожная баллонная коронарная ангиопластика ТБКА или аортокоронарное шунтирование АКШ у больных с клиническими или инструментальными признаками ишемии, особенно при отсутствии эффекта лекарственной терапии. Вторичная профилактика: частота применения антиаритмических препаратов с целью вторичной профилактики ВСС в последнее время в развитых странах значительно уменьшилась в связи с использованием имплантируемых кардиовертеров-дефибрилляторов. Фибрилляция желудочков — имплантация кардиовертера-дефибриллятора. Гемодинамически непереносимая устойчивая желудочковая тахикардия - имплантация кардиовертера-дефибриллятора, амиодарон и б-адреноблокаторы.
- гипертрофическая кардиомиопатия ГКМП. ВСС при ГКМП — ведущий механизм смерти, частота 2-6% в год. ВСС может возникнуть в любом возрасте, часто у бессимптомных пациентов. Ведущие факторы риска: предшествующие эпизоды остановки сердца, устойчивые и неустойчивые пароксизмы желудочковой тахикардии, синкопальные состояния, семейная история ГКМП, симптомы сердечной недостаточности, толщина МЖП более 3см, снижение АД во время проведения нагрузочного теста. Другие факторы риска: мутации высокого риска. ПЕРВИЧНАЯ ПРОФИЛАКТИКА Имплантация кардиовертера-дефибриллятора, амиодарон. ВТОРИЧНАЯ ПРОФИЛАКТИКА имплантация кардиовертера-дефибриллятора.
- дилатационная кардиомиопатия ДКМП. ВСС при ДКМП — основная причина смерти больных. Основные лекарственные средства для профилактики ВСС у больных дилатационной кардиомиопатией — ингибиторы АПФ, б-адреноблокаторы, антагонисты альдостерона, в меньшей степени амиодарон. Ведущие факторы риска: предшествующие эпизоды остановки сердца, устойчивая желудочковая тахикардия, фибрилляция желудочков, синкопальные состояния. Другие факторы риска: ФВЛЖ <30%, неустойчивые пароксизмы желудочковой тахикардии. ПЕРВИЧНАЯ ПРОФИЛАКТИКА ингибиторы АПФ, б-адреноблокаторы, блокаторы рецепторов альдостерона, менее доказано применение амиодарона и имплантация кардиовертера-дефибриллятора. Вторичная профилактика: имплантация кардиовертера-дефибриллятора, ингибиторы АПФ, б-адреноблокаторы, блокаторы рецепторов альдостерона, менее доказано применение амиодарона.
- аритмогенная кардиомиопатия правого желудочка. ВСС при этом редком заболевании — одна из основных причин смерти улиц молодого возраста. Основным вмешательством при этой патологии, направленным на первичную и вторичную профилактику ВСС, выступает имплантация кардиовертера-дефибриллятора. Ведущие факторы риска: устойчивая желудочковая тахикардия/фибрилляция желудочков, дилатация правого желудочка, дисфункция правого желудочка, воспроизводимость аритмии при программированной электрической стимуляции. Другие факторы риска: семейный анамнез ВСС, поздние потенциалы желудочков и дисфункция правого желудочка, желудочковая тахикардия.
Первичная профилактика: имплантация кардиовертера-дефибриллятора, антиаритмические препараты менее эффективны. Вторичная профилактика — имплантация кардиовертера-дефибриллятора.
- синдром удлинённого интервала Q—T. Удлинение интервала Q-T ассоциируют с высоким риском развития ВСС. Основные меры по профилактике ВСС: осторожное применение препаратов, удлиняющих интервал Q—Т (или исключение их применения), исключение значительных физических нагрузок, а также приём б-адреноблокаторов. Ведущие факторы риска:желудочковая тахикардия типа «пируэт», фибрилляция желудочков, остановка сердца, синкопальные эпизоды, наследственные синдромы: синдром Джервела—Нильсена, наследственные варианты синдрома удлинённого интервала Q—Т. Другие факторы риска: интервал Q—T >600мс, сердечные приступы в детстве, синдактилия в сочетании с АВ-блокадой,
альтернация зубца Т на ЭКГ, женский пол, семейный анамнез ВСС, увеличение дисперсии Q-T. Первичная профилактика: исключение препаратов, удлиняющих интервал Q-T, запрет интенсивных нагрузок, б-адреноблокаторы, менее эффективны левосторонняя симпатическая денервация сердца и
имплантация электрокардиостимулятора. Вторичная профилактика: имплантация кардиовертера-дефибриллятора и назначение б-адреноблокаторов, исключение назначения препаратов, удлиняющих интервал Q- Т, запрет интенсивных нагрузок.
- синдром Бругада. Синдром Бругада открыт в 1992 г. Критерии диагноза - спонтанный или индуцируемый подъём сегмента ST в отведениях V1—V3 в сочетании с блокадой правой ножки пучка Гиса (или без неё). ВСС — основное клиническое проявление этого синдрома, что обусловлено высоким риском развития фибрилляции желудочков. Основное вмешательство при синдроме Бругада — установка кардиовертера-дефибриллятора. Основные факторы риска: желудочковая тахикардия/фибрилляция желудочков, синкопальные эпизоды, семейный анамнез ВСС. Другие факторы риска: индуцируемая устойчивая желудочковая тахикардия или фибрилляция желудочков. Первичная профилактика: имплантация кардиовертера-дефибриллятора больным с синкопальными эпизодами и желудочковой тахикардией, менее доказано — имплантация кардиовертера-дефибриллятора бессимптомным больным с желудочковой тахикардией, индуцируемой программированной электрической стимуляцией. Вторичная профилактика: имплантация кардиовертера-дефибриллятора.
- нарушения атриовентрикулярной проводимости и дисфункция синусового узла. Брадиаритмии лежат в основе ВСС в 15-20% случаев. У многих больных с нарушением проводимости и брадиаритмиями непосредственной причиной ВСС служат желудочковые нарушения ритма. В основе профилактики ВСС у данных больных лежит установка ЭКС. Основные факторы риска: при приобретённых АВ-блокадах блокады II и III степени типа 2, синкопальные состояния, сопутствующие болезни сердца, сердечная недостаточност, при врождённых блокадах синкопальные состояния, врождённые пороки сердца, удлинённый интервал Q—Т, при внутрижелудочковых блокадах сопутствующие болезни сердца, сердечная недостаточность, синкопальные состояния, интервал HV >100 мс (по данным ЭФИ),
индуцируемая устойчивая желудочковая тахикардия/фибрилляция желудочков. Первичная и вторичная профилактика: установка ЭКС, лечение основного заболевания.
- катехоламинергическая полиморфная желудочковая тахикардия. Основные факторы риска: фибрилляция желудочков, семейный анамнез ВСС, неустойчивые пароксизмы желудочковой тахикардии, синкопальные состояния в молодом возрасте. Другие факторы риска: синкопальные состояния. Прогноз при этом заболевании плохо определён в связи с отсутствием крупных исследований. При этом синдроме отмечают высокий риск развития ВСС в молодом возрасте.
- аортальный стеноз. У 20% больных, умерших в связи с аортальным стенозом, смерть возникает внезапно. Основное вмешательство для первичной профилактики ВСС при аортальном стенозе — своевременное хирургическое лечение данного порока сердца. Основные факторы риска:
синкопальные эпизоды в анамнезе, стенокардия, желудочковые аритмии спонтанные и индуцируемые программированной электрической стимуляцией, низкая толерантность к нагрузкам. Другие факторы риска: выраженность стеноза. Первичная профилактика: хирургическое лечение, амиодарон. Вторичная профилактика: имплантация кардиовертера-дефибриллятора, хирургическое лечение.
- пролапс митрального клапана. Течение митрального пролапса обычно доброкачественное. Предполагается связь данного заболевания с ВСС, но убедительных данных по этому поводу нет. Основные факторы риска: устойчивая желудочковая тахикардия, фибрилляция желудочков, семейный анамнез ВСС, удлинённые миксоматозные створки митрального клапана. Другие факторы риска: удлинённый интервал Q-Т, частые/сложные желудочковые экстрасистолы, индуцируемость программированной электрической стимуляцией, выраженная митральная регургитация, поздние потенциалы желудочков. Первичная профилактика — отсутствует. Вторичная профилактика — имплантация кардиовертера-дефибриллятора.
- миокардиальные мостики. Миокардиальные мостики — пучки мышечных волокон, сдавливающие коронарные артерии в различных участках. В большинстве случаев мостики перекрывают левую коронарную артерию. Долгосрочный прогноз при изолированных миокардиальных мостиках обычно благоприятный, однако в редких случаях развиваются желудочковые тахиаритмии и ВСС. Основное вмешательство для предупреждения ВСС при данной патологии — хирургическое лечение при наличии симптомов ишемии миокарда. Основные факторы риска: фибрилляция желудочков, желудочковая тахикардия с симптомами ишемии миокарда. Первичная профилактика: хирургическое лечение при наличии симптомов ишемии миокарда, б-адреноблокаторы. Вторичная профилактика — хирургическое лечение при наличии симптомов ишемии миокарда.
- аномальное отхождение коронарной артерии. Из врождённой аномалии коронарных артерий чаще встречают отхождение левой коронарной артерии от правой или синуса Вальсальвы. Основное лечение — хирургическое. Основные факторы риска: фибрилляция желудочков, стенокардия и положительный нагрузочный тест у молодых пациентов. Первичная профилактика — хирургическое лечение. Вторичная профилактика— хирургическое лечение.
- синдром предвозбуждения Вольфа—Паркинсона-Уайта WPW. При синдроме WPW y 0,15% больных в год в результате развития фибрилляции предсердий с быстрым ответом желудочков и её перехода в фибрилляцию желудочков развивается ВСС. Основное вмешательство для профилактики ВСС у больных с синдромом WPW при возникновении фибрилляции предсердий — аблация дополнительных проводящих путей. Основные факторы риска: длина цикла при фибрилляции предсердий <250 мс, антеградный рефрактерный период дополнительного пути проведения <270 мс. Первичная профилактика: аблация дополнительного пути проведения при фибрилляции предсердий, аблация дополнительного пути проведения у бессимптомных пациентов с семейным анамнезом ВСС, у спортсменов, менее доказано амиодарон, антиаритмики IА, IС-классов. Вторичная профилактика: аблация дополнительного пути проведения.
- тромбоэмболия лёгочных артерий ТЭЛА. ТЭЛА часто наблюдают у лиц пожилого возраста, с заболеваниями вен нижних конечностей, у больных сахарным диабетом, после больших полостных и ортопедических операций. Особенности клинической картины представлены в разделе Инфаркт миокарда, рубрика Дифференциальная диагностика. Массивные тромбоэмболии часто манифестируют с ВСС. Основные факторы риска: массивная ТЭЛА, сопутствующие заболевания сердца, пожилой возраст. Первичная и вторичная профилактика: лечение заболеваний вен нижних конечностей, других заболеваний, приводящих к тромбозу, установка кава-фильтров больным с выявленными венозными тромбами и высоким риском ТЭЛА, превентивное назначение гепарина, непрямых антикоагулянтов перед обширными полостными, ортопедическими операциями, назначение непрямых антикоагулянтов, ацетилсалициловой кислоты больным с тромбозами вен нижних конечностей.
ДИАГНОСТИКА
НЕОТЛОЖНЫЕ МЕРОПРИЯТИЯ ПО ДИАГНОСТИКЕ И ЛЕЧЕНИЮ
Все больные, пережившие ВСС, т.е. после успешной сердечно-лёгочной реанимации, нуждаются в детальном обследовании в стационаре для выяснения причин развития ВСС и определения тактики вторичной профилактики. Особенно тщательное обследование требуется, если ВСС произошла не в стационаре.
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Необходимо выяснить наличие сердечно-сосудистых заболеваний, прежде всего ИБС, нарушений ритма и проводимости сердца, пороков сердца. Внимательно изучить медицинскую документацию, предыдущие ЭКГ (при их наличии). Следует сконцентрировать внимание на состоянии больного в предшествующие ВСС дни, особенностях лекарственной терапии, уточнить, была ли за последнее время изменена терапия. Далее провести физикальное обследование:
- наличие самостоятельного дыхания, проходимость дыхательных путей, пульсация на периферических артериях
- внешний вид: цвет кожных покровов, бледность, цианоз, набухание, пульсация ярёмных вен, отёки
- аускультация: чсс, ритмичность, дополнительные тоны, шумы в сердце, одышка, кашель, хрипы в лёгких, кровохарканье
- измерить АД
- оценить наличие неврологических симптомов.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ:
Маркеры повреждения миокарда (тропонин, МВ-КФК) для исключения ИМ.
Уровень электролитов, кальция, магния для выявления тяжёлых метаболических нарушений, ацидоза. Гипокалиемия, гиперкалиемия, гипомагниемия, гипокальциемия могут способствовать развитию опасных нарушений ритма.
При подозрении на передозировку лекарственных препаратов, обладающих проаритмическим эффектом, следует определить их концентрацию в крови. К таким препаратам относят дигоксин, антиаритмики 1 класса, трициклические антидепрессанты и т.д.
Определение уровня тиреоидных гормонов. При гипертиреозе можно наблюдать тяжёлые нарушения ритма.
Повышение уровня предсердного натрийуретического пептида BNP говорит о высоком риске ВСС у больных с сердечной недостаточностью, особенно перенёсших ИМ.
Генетические исследования — часть диагностики синдрома длинного Q-T, ГКМП.
ИНСТРУМЕНТАЛЬНОЕ ОБСЛЕДОВАНИЕ
ЭКГ для выявления признаков ИМ, синдрома длинного Q-T, WPW, синдрома Бругада и т.д. Иногда регистрируют сигнал-усреднённую ЭКГ — выявление поздних потенциалов свидетельствует о высоком риске ВСС.
Рентгенография грудной клетки может выявить признаки сердечной недостаточности, дилатации сердца, гипертрофии ЛЖ, лёгочной гипертензии, ТЭЛА.
ЭхоКГ помогает в диагностике ИМ, пороков сердца.
Изотопная сцинтиграфия определяет признаки ИМ, преходящей ишемии миокарда.
Коронарная ангиография и вентрикулография помогают уточнить характер поражения коронарных артерий, оценить функцию ЛЖ. Иногда ангиография выявляет врождённые аномалии артерий.
Электрофизиологическое исследование для выявления пациентов с воспроизводимыми желудочковыми аритмиями, подбора антиаритмической терапии.
ЛЕЧЕНИЕ
Внезапная сердечная смерть представляет собой остановку сердечной деятельности, поэтому лечение заключается в проведении сердечно-лёгочной реанимации СЛР. Сложность лечения ВСС заключается в том, что около 2/3 случаев ВСС происходит внегоспитально. Основной механизм ВСС — желудочковая тахикардия с большой частотой желудочкового ритма и фибрилляция желудочков. Следовательно, существуют следующие возможности улучшить лечение и прогноз у больных ВСС. Обучение персонала всех лечебных учреждений, включая поликлиники, принципам проведения СЛР. Необходимо обучать СЛР сотрудников служб быстрого реагирования: милиция, служба МЧС, пожарные. Необходимо, чтобы в общественных местах, поездах, самолетах и т.д. постоянно находился персонал, обученный проводить СЛР. Следует пропагандировать обучение СЛР среди населения, организовывать бесплатные курсы при поликлиниках и больницах. Эффективность лечения ВСС резко повышается при оснащении общественных мест, самолетов, поездов автоматическими наружными дефибрилляторами и обучении персонала работе с ними. Лечение ВСС оптимально, если время от остановки сердца до кардиоверсии в госпитале не превышает 3мин, внегоспитально 5мин. Следует максимально сократить время прибытия бригад скорой медицинской помощи. Безусловно, все бригады, включая фельдшерские, должны быть оснащены дефибрилляторами. Все больные после успешной СЛР должны быть доставлены в отделение кардиореанимации.
ПРОГНОЗ
Выживаемость после ВСС составляет от 5 до 60% в зависимости от этиологии, места и времени проведения СЛР. Клиническое течение после СЛР зависит от продолжительности реанимации, характера основного заболевания, наличия неврологической симптоматики. Выжившие после ВСС переживают повторные случаи ВСС в 20-25% в год. Частота рецидивов заметно снизилась после начала широкого использования кардиовертеров-дефибрилляторов.
СЕРДЕЧНО-ЛЁГОЧНАЯ РЕАНИМАЦИЯ
Термин «сердечно-лёгочная реанимация» подразумевает проведение мероприятий, направленных в первую очередь на поддержание жизнедеятельности организма — восстановление дыхания и кровообращения. Цель сердечно-лёгочной реанимации СЛР состоит в обеспечении хотя бы на минимальном уровне снабжения кислородом головного мозга, кора которого погибает в условиях кислородного голодания уже через 5мин. СЛР, неотъемлемая часть подготовки любого врача, включает действия, которые необходимо предпринять, когда по той или иной причине у человека внезапно развиваются крайне тяжёлые расстройства деятельности сердечно-сосудистой системы, кровообращения головного мозга и дыхания вплоть до наступления клинической смерти. В комплекс мер входят:
- выявление ранних признаков внезапного развития критического состояния или клинической смерти
- немедленное начало проведения базового реанимационного пособия
- дефибрилляция (если таковая возможна) и стабилизация состояния пострадавшего
- доставка пострадавшего в стабильном состоянии в стационар.
КОДЫ МКБ-10
I46 Остановка сердца
I46.0 Остановка сердца с успешным восстановлением сердечной деятельности
I46.1 Внезапная сердечная смерть
I46.9 Остановка сердца неуточнённая
R95 Внезапная смерть грудного ребёнка
R96 Другие виды внезапной смерти по неизвестной причине
R96.0 Мгновенная смерть
R96.1 Смерть, наступившая менее чем через 24ч с момента появления симптомов, не имеющая другого объяснения
R99 Другие неточно обозначенные и неуточнённые причины смерти
ПЕРВЫЕ ДЕЙСТВИЯ СПАСАТЕЛЯ В СИТУАЦИИ, ТРЕБУЮЩЕЙ ОКАЗАНИЯ ЭКСТРЕННОЙ МЕДИЦИНСКОЙ ПОМОЩИ
В обычной жизни самым важным звеном в системе оказания экстренной кардиологической помощи является любой человек, оказавшийся по воле случая рядом с пострадавшим. Однако, поскольку условия, при которых может возникнуть необходимость в проведении экстренных мероприятий, могут быть различными, в том числе опасными, ещё до начала СЛР перед человеком, оказывающим помощь, встают три задачи:
- определить, продолжает ли действовать поражающий фактор, угрожает ли он жизни других людей, в том числе жизни тех, кто будет оказывать первую помощь
- определить количество пострадавших и предположительный характер повреждений (при массовом поражении спасают в первую очередь тех, у кого возникли тяжёлые, но устранимые повреждения)
- позвать на помощь всех, кто может услышать этот призыв (использовать все доступные виды связи или громко звать на помощь).
Лишь обезопасив себя и пострадавшего, можно думать об оказании помощи. При попытке реанимировать человека на удачный исход можно рассчитывать только в том случае, если предпринимаемые действия выстраиваются в следующую цепочку:
- выявление признаков наступления клинической смерти
- вызов бригады СМП или бригады реаниматологов, если помощь оказывают в условиях медицинского учреждения
- выполнение приёмов СЛР
- проведение дефибрилляции (при наличии дефибриллятора)
- поддержание проходимости дыхательных путей и налаживание вентиляции
- внутривенное введение лекарств.
Крайне важно, чтобы ни одно из звеньев в цепи не оказалось слабым (неправильно выполненное действие) или выпало полностью.
БАЗОВОЕ РЕАНИМАЦИОННОЕ ПОСОБИЕ
Базовое реанимационное пособие БРП включает:
- быстрая оценка ситуации и установление диагноза клинической смерти
- меры предотвращения аспирации
- обеспечение проходимости дыхательных путей и искусственная вентиляция лёгких
- дефибрилляция при фибрилляции желудочков ФЖ, желудочковой тахикардии ЖТ или электрической активностью сердца без пульса ЭАБП
- устранение обструкции дыхательных путей инородным телом.
ПОКАЗАНИЯ К ПРОВЕДЕНИЮ СЕРДЕЧНО-ЛЁГОЧНОЙ РЕАНИМАЦИИ
ОСТАНОВКА ДЫХАНИЯ
Остановка дыхания иногда возникает при сохранном кровообращении, однако нарастающая гипоксия быстро приводит к желудочковой тахикардии и фибрилляций желудочков, остановке кровообращения. Тем не менее на этом этапе можно ограничиться только проведением искусственного дыхания. Причиной остановки дыхания становятся асфиксия, инсульт, отравление продуктами горения, отёк гортани, передозировка лекарств/наркотиков, поражение электрическим током, тяжёлая травма, кома любого происхождения и многое другое.
ОСТАНОВКА КРОВООБРАЩЕНИЯ
Остановка кровообращения возникает, когда сердце прекращает выполнение своей насосной функции, т.е при желудочковой тахикардии, фибрилляции желудочков, электрической активностью без пульса, асистолии.
ОЦЕНКА СОСТОЯНИЯ ЖИЗНЕННО ВАЖНЫХ ФУНКЦИЙ ОРГАНИЗМА
Чтобы выявить указанные выше состояния, в первую очередь обращают внимание на жизненно важные функции организма:
сознание,
дыхание,
кровообращение.
Эти функции оценивают по предельно упрощённой, но весьма эффективной схеме.
Сначала определяют, в сознании ли пострадавший: отвечает ли он на обращение, громкий оклик, похлопывание по щеке.
Если сознание и реакция на раздражители отсутствуют,
необходимо проверить, проходимы ли дыхательные пути, обеспечить их проходимость,
удостовериться в наличии самостоятельного дыхания, определить, совершает ли движения грудная клетка, ощущается ли выдыхаемый изо рта и носа воздух, слышно ли, как дышит человек,
постараться определить пульс на сонной артерии (альтернатива — пальпация бедренной артерии, её прощупывают у маленьких детей). Не следует заниматься подсчётом пульса, поскольку в рассматриваемой ситуации важно лишь выяснить наличие или отсутствие пульсации: пульс есть — кровообращение сохранено, пульса нет — кровообращение прекратилось. В случае сомнения в результатах определения пульса на сонной артерии выполняют приём «выявление признаков наличия сердечной деятельности» - делают 1—2 вдувания воздуха в рот или нос пострадавшему (как при выполнении искусственного дыхания), в ответ на это у пострадавшего при сохранном кровообращении должна появиться какая-то реакция: самостоятельное дыхание, кашель или активные движения. Если нет полной уверенности в сохранности кровообращения, немедленно приступают к проведению наружного массажа сердца.
МЕРОПРИЯТИЯ, ОБЕСПЕЧИВАЮЩИЕ ПРОХОДИМОСТЬ ДЫХАТЕЛЬНЫХ ПУТЕЙ
В ситуации, когда отсутствует сознание и дыхание не определяется, в первую очередь необходимо думать о нарушении проходимости дыхательных путей. Все возможные варианты сводятся к двум причинам:
- западение языка, задняя часть которого, опускаясь (если пострадавший лежит лицом вверх), способна перекрыть вход в гортань
- инородное тело в дыхательных путях.
Западение языка устраняют запрокидыванием головы пострадавшего и выдвижением его нижней челюсти. При запрокидывании головы задняя стенка глотки отдаляется от языка и между ними появляется пространство. Запрокидывания головы назад добиваются, подкладывая под лопатки лежащего на спине человека что-то не слишком мягкое (сложенная одежда, домашние тапочки или другой предмет).
Приподнять корень языка позволяет выдвижение нижней челюсти вперёд. Такой прием особенно выгоден, когда не исключено повреждение шейного отдела позвоночника (при наличии травм об этом нужно думать всегда) и чрезмерное отведение головы назад способно привести к смещению отломков. Двумя руками, охватив голову с обеих сторон, за углы нижней челюсти смещают челюсть вперёд (относительно пострадавшего).
Рис. 17. Приём с выдвижением нижней челюсти.

Поддержанию проходимости дыхательных путей способствует применение воздуховодов. К ним относятся орофарингеальный, назофарингеальный воздуховоды, ларингеальная маска, комбинированная эзофагально-трахеальная трубка, фарингеально-трахеальный воздуховод и интубационная трубка. Каждый из воздуховодов требует навыков в обращении с ним. Все они применимы только у
пострадавших, не реагирующих на раздражители, находящихся в состоянии клинической смерти или глубокой комы, так как введение воздуховода человеку с сохранным сознанием приводит к сильному раздражению глотки или дыхательных путей и чревато серьёзными осложнениями (регургитация и др.).
ИСКУСТВЕННОЕ ДЫХАНИЕ
Искусственное дыхание проводят методом изо рта в рот или изо рта в нос (рис. 18, 19). В особых ситуациях возможно осуществление искусственного дыхания изо рта в трахеостому, а при наличии специальной маски (без клапана выдоха) изо рта в маску. При проведении искусственного дыхания очень эффективно применение мешка Амбу с маской, поэтому целесообразно позаботиться о заблаговременном приобретении этих принадлежностей.
ИСКУССТВЕННОЕ ДЫХАНИЕ ИЗО РТА В РОТ
Приступая к проведению искусственного дыхания, нужно обеспечить проходимость дыхательных путей, зажать нос пострадавшего и охватить рот своим ртом. Для этого одну ладонь кладут на лоб пострадавшего, зажимают его нос указательным и большим пальцами. Такой приём исключает утечку воздуха через нос. Делают глубокий вдох и плотно охватывают своим ртом губы пострадавшего. Производят медленные (каждое в течение 2 с) вдувания примерно 700мл воздуха (т.е не следует пытаться максимально наполнить лёгкие пострадавшего воздухом), одновременно следя за тем, чтобы грудная клетка поднималась при каждом вдувании (см. рис. 18). В случае попадания воздуха в желудок не следует надавливать на живот, пытаясь ликвидировать растяжение органа. Если первоначальная попытка вдувания воздуха оказалась безуспешной и воздух не проходит, следует изменить положение головы пострадавшего, чтобы образовать пространство для прохождения воздуха, и повторить вдувание. Если вновь не удаётся осуществить вдувание воздуха, медицинский работник должен прибегнуть к манипуляциям, устраняющим обструкцию дыхательных путей инородным телом.
ИСКУССТВЕННОЕ ДЫХАНИЕ ИЗО РТА В НОС
К методу искусственного дыхания изо рта в нос прибегают, когда вентиляция пострадавшего через рот невыполнима из-за тризма или тяжёлых разрушений в области рта, невозможности герметичного соединения губ спасателя с губами пострадавшего. Одной рукой голову человека запрокидывают назад (рука лежит на лбу), другой поджимают нижнюю челюсть. Делают глубокий вдох, охватывают ртом нос пострадавшего и вдувают воздух в его нос. Далее, отстранившись от лица пострадавшего, выдерживают паузу для пассивного выдоха (см. рис. 19). Чтобы выход воздуха был более свободным, периодически открывают рот пострадавшего.
НАРУЖНЫЙ МАССАЖ СЕРДЦА
Согласно современным установкам, при оказании помощи как одним, так и двумя спасателями частота компрессий грудной клетки должна составлять примерно 100 в минуту (следует иметь в виду, что речь идёт не о числе компрессий в минуту, а о скорости их осуществления), соотношение компрессий и вдуваний воздуха 15:2. С момента введения интубационной трубки с манжетой (полная защита дыхательных путей) непрямой массаж сердца и вентиляцию лёгких можно продолжать в отношении 5:1 без синхронизации.
При проведении наружного массажа сердца пострадавший должен лежать на спине на твёрдой поверхности. Если его нельзя снять с кровати, то под тело подкладывают твёрдый щит (на всю ширину кровати). Для выполнения наружного массажа сердца (рис. 20, 21) одну ладонь помещают на границе между средней и нижней третями грудины, вторую ладонь кладут на первую и делают энергичные толчки в переднезаднем направлении. Руки должны быть выпрямленными, толчки производят в строго вертикальном направлении. Пауза для вдувания воздуха в лёгкие — возможность частично расслабить руки.
Рис. 20. Наружный массаж сердца, правильная позиция рук.

Рис. 21. Правильное положение спасателя во время проведения наружного массажа сердца.

Проведение СЛР облегчается, если помощь оказывают два человека. Вместе с тем, когда работает помощник, решающее значение приобретает соблюдение ритма и очерёдности основных элементов СЛР. Сначала один спасатель производит два не слишком быстрых (в течение 2 с) нефорсированных вдувания воздуха (необходимо, чтобы грудная клетка при этом приподнималась, а воздух не встречал препятствия), затем помощник делает 15-30 надавливаний на грудную клетку. Эти циклы повторяются. Недостаточная координация действий чревата последствиями. До окончания процесса вдувания воздуха изо рта в рот или изо рта в нос начинать наружный массаж сердца нельзя, так как это приведёт к наполнению желудка воздухом. Весьма полезным методом, позволяющим избежать в процессе проведения СЛР попадания воздуха в желудок и последующей регургитации, служит надавливание двумя пальцами, указательным и большим, на перстневидный хрящ, расположенный под щитовидным хрящом (рис. 22). Для выполнения данного приёма необходим хотя бы один помощник.
Рис. 22. Приём с надавливанием на перстневидный хрящ.

ОБСТРУКЦИЯ ДЫХАТЕЛЬНЫХ ПУТЕЙ ИНОРОДНЫМ ТЕЛОМ
КОДЫ МКБ-10
Т17 Инородное тело в дыхательных путях
Т17.2 Инородное тело в глотке
Т17.3 Инородное тело в гортани
Т17.4 Инородное тело в трахее
Т17.8 Инородное тело в другом или нескольких отделах дыхательных путей
Т17.9 Инородное тело в неуточнённой части дыхательных путей
Т98.0 Последствия воздействия инородного тела, попавшего через естественное отверстие тела
W80 Вдыхание и заглатывание инородного тела, приводящее к закупорке дыхательных путей.
Довольно типично перекрытие гортани куском пищи (обычно это мясо) (рис. 23).
Рис. 23. Типичное положение рук человека, страдающего от асфиксии.

Без помощи быстро возникает асфиксия, наступает клиническая, а затем биологическая смерть.
Показано выполнение приёма Геймлиха, но предварительно, если человек в сознании и остаётся на ногах, наносят пять довольно чувствительных ударов по спине на уровне верхней части межлопаточного пространства. При отсутствии эффекта сразу приступают к выполнению приёма Геймлиха в расчёте на то, что резкое сдавление живота (за счёт смещения диафрагмы) сформирует поток воздуха, способный вытолкнуть препятствие из гортани. Пособие выполняют в положении пострадавшего стоя или лёжа. Если он стоит (рис. 24), нужно подойти к нему со стороны спины, охватить обеими руками его туловище на уровне талии, сцепив руки спереди (одну руку следует сжать в кулак и той стороной, где находится большой палец, разместить по средней линии живота выше пупка). Кисть второй руки захватывает кулак и ещё больше прижимает его к телу пострадавшего. Важно, чтобы руки оказывающего помощь не охватывали нижнюю часть грудной клетки, а располагались только в области живота, т.е. они должны занимать более горизонтальное положение (сдавление грудной клетки в области рёберных дуг делает вмешательство опасным из-за возможных осложнений и снижает его эффективность). Далее несколько 5р резко и сильно сдавливают живот, пока инородное тело не покинет гортань.
Если пострадавший лежит (рис. 25), то компрессию живота осуществляют, расположив сложенные друг на друга ладони по средней линии живота выше пупка. При этом варианте выполнения приёма Геймлиха оказывающий помощь садится верхом на бёдра пострадавшего и резкими толчками сдавливает живот, добиваясь выталкивания инородного тела из гортани.
Рис. 24. Приём Геймлиха в положении пострадавшего стоя

Рис. 25. Приём Геймлиха в положении пострадавшего лёжа.

Как только воздухоносные пути освободятся от преграды, необходимо обнаружить и удалить из глотки инородный объект, вызвавший обструкцию.
ПРИПОДНИМАНИЕ (ВЫТЯГИВАНИЕ) ЯЗЫКА ВМЕСТЕ С НИЖНЕЙ ЧЕЛЮСТЬЮ И УДАЛЕНИЕ ИНОРОДНОГО ТЕЛА ПАЛЬЦЕМ
Можно предпринять попытку удалить инородное тело пальцем. Это допустимо у больного, не реагирующего на раздражители, находящегося в состоянии клинической смерти. Нельзя прибегать к данному приёму, если пострадавший контактен или у него наблюдаются судороги. Человека укладывают лицом вверх, открывают ему рот и, захватив язык вместе с нижней челюстью пальцами, приподнимают нижнюю челюсть. В результате язык оттягивается от задней стенки глотки и инородное тело, если оно зажато на этом уровне, освобождается. Иногда одного лишь этого приёма достаточно для устранения обструкции. Далее, если инородное тело остаётся на месте, указательный палец другой руки вводят по щеке глубоко в глотку к основанию языка и предпринимают попытку пальцем, как крючком, сдвинуть инородное тело в полость рта, откуда его можно легко извлечь. Иногда указательным пальцем сначала приходится сместить инородное тело к противоположной стенке глотки. Необходимо действовать очень осторожно и не допускать проталкивания инородного тела в дыхательные пути ещё глубже (рис. 26).
Рис 26. Приподнимание языка вместе с нижней челюстью и удаление инородного тела пальцем.

КРИКОТИРЕОТОМИЯ (КОНИКОТОМИЯ)
Чаще гортань оказывается полностью блокированной, и удалить инородное тело с помощью приёма Геймлиха не удаётся. В этом случае необходимо быстро, выполнить коникотомию любым режущим инструментом. В настоящее время имеются одноразовые стерильные наборы для выполнения данной манипуляции, которые можно включить в перечень принадлежностей для оказания первой медицинской помощи.
Коникотомия — вскрытие гортани в промежутке между щитовидным и перстневидным хрящом (рис. 27).
Рис. 27. Анатомическое расположение «конической связки» (эластичного конуса) и способ её пересечения (коникотомия).

Для этого нащупывают нижний край щитовидного хряща. Ямка под щитовидным хрящом соответствует локализации «конической связки». Ниже лежит перстневидный хрящ. Выполнить операцию технически довольно просто: спереди по средней линии шеи в указанном месте нужно сделать поперечный разрез кожи на небольшом протяжении, затем кончиком режущего инструмента рассечь связку до просвета трахеи, как показано на рис. 27. Для поддержания проходимости в образовавшееся отверстие можно вставить трубку подходящего диаметра.
ДЕЙСТВИЯ ПОСЛЕ УСТРАНЕНИЯ ОБСТРУКЦИИ ДЫХАТЕЛЬНЫХ ПУТЕЙ
Если обструкция устранена и воздухоносные пути очищены, проверяют, не появилось ли самостоятельное дыхание. Если пострадавший не дышит, делают 2 вдувания воздуха в его лёгкие, отмечают «признаки наличия кровообращения» и пульс на сонной артерии. В их отсутствие приступают к СЛР. В случае удачного разрешения ситуации больной нуждается во врачебном наблюдении, показана госпитализация.
УСТОЙЧИВОЕ (ВОССТАНОВИТЕЛЬНОЕ) ПОЛОЖЕНИЕ НА БОКУ
Нельзя надеяться, что в случае успешной реанимации работа основных систем в организме пострадавшего быстро восстановится. Его состояние будет оставаться тяжёлым. Следствие продолжительного отсутствия кровообращения — развитие гиповолемического, кардиогенного и вазодилататорного шока, реперфузионных повреждений, глубокой коагулопатии, интоксикации головного мозга за счёт ишемических метаболитов. В такой ситуации показано продолжение лечения в реанимационном отделении. На период наблюдения и транспортировки пострадавшего ему следует придать устойчивое (восстановительное) положение на боку.
Такое положение удобно для наблюдения за больным и транспортировки, оно предотвращает западение языка и попадание рвотных масс в дыхательные пути. Самый приемлемый вариант — положение на боку с подложенной под голову ладонью верхней согнутой руки (относительно лежащего человека). Нижняя рука вытянута вперёд и согнута под углом 90° в локтевом суставе (голова при этом должна быть опущена, чтобы жидкость из полости рта свободно вытекала). Нижняя нога выпрямлена, верхняя согнута под прямым углом в тазобедренном и коленном суставах (рис. 28). Пострадавшего нужно повернуть на другой бок, если данное положение сохраняется более 30мин.
 Рис.
28. Устойчивое (восстановительное) положение на боку.
Рис.
28. Устойчивое (восстановительное) положение на боку.
ДЕФИБРИЛЛЯЦИЯ
Поскольку непосредственной причиной остановки кровообращения в большинстве случаев служат ФЖ или ЖТ (ВСС связана именно с такими нарушениями ритма), при оказании помощи человеку в состоянии клинической смерти первоочередная цель состоит в максимально быстром осуществлении дефибрилляции (в течение первых 5 мин). Время до дефибрилляции выступает определяющим фактором выживания при остановке кровообращения. Затянувшаяся ФЖ и ЖТ с глубокими гемодинамическими расстройствами неизбежно переходят в асистолию. При асистолии восстановить работу сердца удаётся крайне редко. Современные автоматические внешние дефибрилляторы АВД способны анализировать ритм и генерировать инструкции. Применять АВД можно только в случаях клинической смерти, когда у больного отсутствует реакция на раздражители, дыхание и кровообращение. Человек, осуществляющий дефибрилляцию, выполняет функцию второй верификационной системы, и именно он должен установить, что больной находится в состоянии клинической смерти.
ОСОБЫЕ СИТУАЦИИ, ТРЕБУЮЩИЕ ПОДГОТОВИТЕЛЬНЫХ ДЕЙСТВИЙ
При наличии воды на коже пострадавшего кожу в области грудной клетки быстро протирают насухо.
На догоспитальном этапе с помощью АВД допустима дефибрилляция у детей старше 8лет, с массой тела больше 25 кг. Следует иметь в виду, что самыми частыми причинами остановки кровообращения у маленьких детей служат асистолия и электрическая активность без пульса, поэтому приоритет отдают обеспечению проходимости дыхательных путей, оксигенации и вентиляции.
При наличии на коже наклеек с лекарствами для трансдермального применения перед наложением электродов наклейки удаляют, кожу под ними тщательно протирают.
При имплантированном дефибрилляторе (прибор легко нащупать под кожей в верхней части грудной клетки или живота) чтобы исключить наложение разрядов имплантированного и внешнего дефибриллятора, следует подождать 30—60с, пока внутренний дефибриллятор не закончит свой цикл (активность имплантированного дефибриллятора сопровождается сокращением мышц в зоне его расположения).
ОБЩИЕ ЭТАПЫ ПРИ РАБОТЕ СО ВСЕМИ ВИДАМИ АВД
АВД ставят у уха лежащего на спине пострадавшего. Если расположиться слева от больного, легче достать ручки управления АВД и удобнее накладывать электроды, Позиция слева освобождает также место для второго спасателя, позволяет ему приступить к проведению СЛР.
Этап 1. Соединение АВД с источником питания и включение прибора (прибор, работающий на внутренней батарее, требует только включения).
Этап 2. Наложение электродов. Одноразовые электроды быстро извлекают из упаковки и накладывают на кожу. К электродам присоединяют провода (в некоторых моделях электроды через соединительные кабели заранее подключены к АВД). Накладываемые электроды смазывают токопроводящим гелем и плотно прижимают к коже. Места размещения электродов:
- на уровне верхней границы грудины под правой ключицей
— сбоку от левого соска (верхний край электродной пластины должен располагаться на 7см ниже подмышечной ямки) (рис. 29).
Чтобы наложить электроды, приходится прерывать проведение СЛР.
Этап 3. Анализ ритма. Всех помощников и лиц, находящихся рядом, просят отдалиться от больного. Прибор сам начинает анализ ритма или оператор нажимает на кнопку АНАЛИЗ ANALYZE. Если выявлена ФЖ, то прибор заявит об этом надписью на дисплее, визуальным или звуковым оповещением. Поступающая информация укажет на необходимость нанесения разряда.
Этап 4. Всех присутствующих заставляют отстраниться от больного и нажимают кнопку РАЗРЯД SHOCK. Обязательно громко произносят предупреждающую фразу: «Я не касаюсь, вы не касаетесь, никто не касается» или краткое «Все от больного!». Ещё раз убеждаются, что никто не располагается рядом с больным. Прибор заряжают нажатием соответствующей кнопки. Появление тона, сообщения голосового синтезатора или световая индикация сигнализируют о начале зарядки. По окончании зарядки следует разряд.
После первого разряда не следует сразу приступать к СЛР. В некоторых АВД предусмотрено, что спасатель самостоятельно нажмет кнопку АНАЛИЗ ANALYZE. В других моделях после нанесения разряда немедленно автоматически начинается анализ ритма. Если ФЖ продолжается, АВД указывает на это и появляется сообщение «нанесение разряда показано» shock indicated, и цикл «зарядки» charging повторяется во 2-й, а если необходимо, то и в 3-й раз. АВД запрограммирован на повторение анализа ритма больного и способен максимально быстро осуществить серию циклов (до 3). Нанесение серии разрядов предусмотрено с той целью, чтобы идентифицировать и устранить те нарушения ритма, которые поддаются электроимпульсной терапии, причём сделать это максимально быстро, поэтому в процесс работы АВД спасатель вмешиваться не должен.
После троекратной дефибрилляции необходимо проверить наличие кровообращения, быть готовым приступить к СЛР и продолжать выполнение компрессии и искусственное дыхание в течение 1мин (см. ниже).
Регулировка уровня энергии разряда
Мощность первого однофазного разряда составляет 200Дж. Мощность второго разряда оставляют прежней 200Дж или повышают до 300Дж (от 200 до 300Дж).
Если 2 предыдущих однофазных разряда не вызвали дефибрилляцию, при нанесении третьего разряда мощность повышают до 360Дж.
Если первыми тремя разрядами купировать приступ не удалось, необходимо продолжить проведение СЛР в течение минуты, обеспечить внутривенный доступ, по возможности заинтубировать трахею, ввести адреналин. Далее, если ФЖ продолжается, ещё раз осуществляют дефибрилляцию и решают вопрос о применении амиодарона или лидокаина.
Двухфазные разряды меньшей мощности, которые способны генерировать наиболее современные приборы, признаны более эффективными, чем однофазные. Общие рекомендации, касающиеся уровня энергии двухфазных разрядов, пока не выработаны, поэтому при использовании новых моделей АВД следует придерживаться инструкции производителя. В процессе транспортировки больного в движущейся санитарной машине АВД можно оставить подключённым, но если в процессе транспортировки возникает необходимость в оценке ритма или нанесении разряда, машину необходимо остановить.
Когда появляются признаки возобновления эффективной работы сердца и дыхания, больному придают устойчивое (восстановительное) положение на боку. Многие дефибрилляторы снабжены функцией продолжительного мониторинга ритма больного, поэтому они способны просигнализировать, если фибрилляция возобновилась.
СИТУАЦИИ, ТРЕБУЮЩИЕ ОСОБОГО ПОДХОДА ПРИ ПРОВЕДЕНИИ СЕРДЕЧНО-ЛЕГОЧНОЙ РЕАНИМАЦИИ
ЭЛЕКТРИЧЕСКАЯ АКТИВНОСТЬ БЕЗ ПУЛЬСА
В эту группу нарушений ритма входят ситуации, когда при наличии некоторой электрической активности (но не ФЖ или ЖТ) пульс выявить не удаётся. Под существующим термином «электромеханическая диссоциация» подразумевают не все варианты. Термин «электрическая активность без пульса» более полно охватывает гетерогенную группу ритмов, в которую входят псевдоэлектрическая активность без пульса, идиовентрикулярные, желудочковые ускользающие и брадисистолические ритмы. Механические сокращения мышцы сердца при таких ритмах могут присутствовать, но они слишком слабы, чтобы создавать давление крови, определяемое обычной пальпацией или сфигмоманометрией. Электрическую активность сердца без пульса относят к «ритмам выживания». Больных иногда можно спасти, если вовремя провести дефибрилляцию и устранить причину этого состояния. Дефибрилляцию в случае необходимости комбинируют с фармакотерапией. Применение адреналина и атропина (см. ниже) показано также в ситуации, когда дефибриллятора под рукой нет.
Причин развития электрической активности без пульса 10 (эти же причины имеют отношение к возникновению асистолии):
- гиповолемия
- гипоксия
- ацидоз
- гипер-, гипокалиемия
- гипотермия
- передозировка лекарств и отравления химическими веществами
- тампонада сердца
- напряжённый пневмоторакс
- коронарный тромбоз
- тромбоэмболия лёгочной артерии.
Тяжёлая гиперкалиемия, гипотермия, гипоксия, предсуществующий ацидоз, передозировка лекарств (трициклические антидепрессанты, б-адреноблокаторы, блокаторы кальциевых каналов и сердечные гликозиды) могут проявляться редким ритмом с широкими комплексами. Наоборот, быстрый ритм с комплексами нормальной продолжительности при электрической активности без пульса указывает на относительно естественный ответ сердца на тяжёлую гиповолемию, инфекцию, эмболию лёгочной артерии или тампонаду сердца. Эти состояния требуют особых видов вмешательства. Гиповолемия служит самой частой причиной электрической активности при падении АД до нуля. Не устранив причину, вызвавшую развитие электрической активности сердца без пульса, рассчитывать на успех реанимации сложно.
АСИСТОЛИЯ
У больных с остановкой сердца, когда на мониторе дефибриллятора видна асистолия (при выявлении сплошной линии на мониторе крайне важно исключить «псевдоасистолию», обусловленную нарушением техники регистрации ритма, например отсоединением клеммы от электрода), шансов выжить мало (выживают не больше 1—2 человек из 100). Во время проведения реанимационных мероприятий можно зарегистрировать единичный комплекс на экране монитора, но самостоятельное кровообращение при этом возобновляется редко. Как и при электрической активности без пульса, при асистолии единственная надежда на быстрое выявление и купирование обратимой причины данного состояния (перечень причин см. выше), в первую очередь — максимально быстрая и эффективная оксигенация крови.
Алгоритм оказания помощи при асистолии не включает в себя дефибрилляцию. Кроме СЛР, подключения кислорода к реанимационным мероприятиям относят обеспечение внутривенного доступа, введение адреналина и атропина. При осуществлении лекарственной терапии допустимо сокращение промежутков между повторными введениями препаратов до 3мин и менее. Набор реанимационных мероприятий при асистолии можно дополнить лишь чрескожной кардиостимуляцией, но она требует наличия соответствующего оборудования и навыков у медицинского персонала.
ТРАДИЦИОННЫЕ И НОВЫЕ ФАРМАКОЛОГИЧЕСКИЕ ПОДХОДЫ В КАРДИОРЕАНИМАЦИИ
Фармакология в кардиореанимации за последнее время претерпела значительные изменения в связи с переходом на принципы доказательной медицины. Некоторые положения, казавшиеся безусловно правильными в прошлом, не обнаружили под собой основательной доказательной базы. В данном разделе рассмотрены те препараты, которые актуальны в оказании помощи при критических состояниях и клинической смерти, обусловленной развитием желудочковой тахикардии, фибрилляции желудочков, электрической активности сердца без пульса и асистолии. Основные положения взяты из руководства «Guidelines 2000for Cardiopulmonaty Resuscitation and Emergency Cardiovascular Care. International Consensus on Science», выпущенного Американской кардиологической ассоциацией.
При оказании реанимационной помощи больному в состоянии клинической смерти фармакотерапия отходит на второй план после базового реанимационного пособия и дефибрилляции. Общий порядок применения лекарств следующий:
- обеспечение доступа в периферическую вену (манипуляция значительно осложнена спадением вен), пункция центральной вены требует специальных принадлежностей, навыка у персонала, перерыва в проведении СЛР, последнее может ухудшить прогноз
- быстрое струйное введение препарата, разведённого 0,9% раствором натрия хлорида или декстрозы в шприце на 20мл
- быстрое струйное введение 20мл растворителя вслед за препаратом
- приподнимание соответствующей конечности после инъекции.
На внутрисердечное введение лекарств в современных руководствах указаний нет. Инъекция в мышцу сердца, если она производится не на открытом сердце, чревата тяжёлыми последствиями (в том числе повреждением коронарных сосудов), которые способны свести к нулю любые действия спасателя.
Если трахея заинтубирована, адреналин, норадреналин, атропин можно вводить внутритрахеально. Обычную дозу при этом увеличивают вдвое.
Адреналин. Благоприятное действие адреналина гидрохлорида при остановке кровообращения обусловлено в первую очередь его стимулирующим влиянием на а-адренорецепторы. Лицам старше 8лет всегда вводят стандартную, не зависящую от массы тела и возраста дозу 1мг в/в. В отсутствие эффекта введение повторяют через 3-5мин. В научных исследованиях, посвященных изучению эффективности адреналина в высоких дозах (первоначально высоких или быстро возрастающих) при остановке сердца, не удалось показать роста показателя выживаемости. Поскольку высокие дозы адреналина (0,1мг/кг) грозят нанесением вреда больному, применять их не рекомендуют (класс неопределён).
Вазопрессин (аргинин вазопрессин) — более ценный прессорный агент, чем адреналин. Он эффективнее восстанавливает самостоятельное кровообращение в случае прекращения сердечной деятельности. Отзывы специалистов неизменно положительные. Вазопрессином 40ЕД в/в без повторного введения можно заменить адреналин. Меньшее число побочных эффектов — главный аргумент в пользу вазопрессина.
Амиодарон. Если речь идёт о начальной терапии гемодинамически стабильной желудочковой тахикардии с широкими комплексами, особенно у больных с нарушенной функцией желудочков, в настоящее время приоритет следует отдавать амиодарону (а также прокаинамиду). Лидокаин перемещён на вторую позицию. Очевидно, при оказании помощи человеку в состоянии клинической смерти, обусловленной желудочковыми нарушениями ритма, амиодарон столь же значим (хотя подведение строгой доказательной базы под данное положение крайне затруднено спецификой ситуации). Необходимо отметить, что к фармакотерапии амиодароном, поскольку действие препарата развивается относительно медленно даже при внутривенном пути введения, прибегают после нанесения 3-4 разрядов дефибриллятором в ходе проведения базового реанимационного пособия с дефибрилляцией. Вслед за амиодароном (содержимое двух ампул 150 мг разбавляют раствором декстрозы до 20мл) вводят адреналин.
Бретилия тосилат. Лекарство в алгоритмах оказания помощи при ФЖ/ЖТ без пульса больше не упоминают. Во-первых, к 2000 г. из-за отсутствия сырья препарат практически снят с производства, во-вторых, с применением бретилия связана высокая частота побочных эффектов, особенно гипотензии, в постреанимационном периоде.
Лидокаин остаётся в ряду противоаритмических средств для купирования рефрактерной к электроимпульсной терапии ФЖ и ЖТ без пульса, но факты в пользу амиодарона намного весомее. По мнению многих авторов, амиодарон имеет преимущества перед лидокаином.
Препараты магния. Достоверно показано, что введение препаратов магния оправдано только по поводу чётко установленной гипомагнезиемии при пируэтной ЖТ torsades de pointes.
Атропин устраняет изменения сердечного ритма, системного сосудистого сопротивления и кровяного давления, которые возникают под влиянием холиномиметических факторов. При асистолии и медленной электрической активности без пульса доза атропина сульфата составляет 1мг в/в. Её можно ввести повторно через 3—5 мин, не прерывая СЛР, если асистолия не купируется.
ПРЕКРАЩЕНИЕ РЕАНИМАЦИОННЫХ МЕРОПРИЯТИЙ
Критерий неэффективности реанимационных мероприятий и сигнал к прекращению попыток вернуть человека к жизни — появление безусловных признаков биологической смерти. Один из самых ранних и наглядных признаков (по прошествии 40мин с момента наступления смерти) — трупные пятна. Они выглядят как синюшные или синюшно-багровые разлитые пятна на нижерасположенных поверхностях тела (область спины, ягодицы, задняя поверхность ног, если человек лежит на спине). Ни в коем случае не следует ориентироваться по диаметру зрачка, так как при наступлении биологической смерти зрачок останавливается в произвольном положении. Вместе с тем у мёртвого человека при надавливании на глазное яблоко меняется форма зрачка, чего никогда не бывает у живого.
Окончательное решение о прекращении реанимационных мероприятий никогда не бывает простым. Невозможно указать на определённый временной интервал. При принятии решения должны учитываться клинический здравый смыслу и уважение к человеческому достоинству.
ПОРОКИ СЕРДЦА
МИТРАЛЬНЫЙ СТЕНОЗ
Митральный стеноз — сужение левого атриовентрикулярного отверстия, препятствующее нормальному току крови из левого предсердия в левый желудочек. В норме площадь митрального отверстия составляет 4—5см2, а давление в полости левого предсердия не превышает 5мм рт.ст. При митральном стенозе оно нарастает до 20—25мм рт.ст. и возникает градиент давления между левым предсердием и левым желудочком, способствующий продвижению крови через суженное отверстие.
КОДЫ МКБ-10
I05.0 Митральный стеноз
I05.2 Митральный стеноз с недостаточностью.
ЭПИДЕМИОЛОГИЯ
Практически всегда митральный стеноз — следствие острой ревматической лихорадки. Изолированный, «чистый» митральный стеноз наблюдают в 40% случаев среди всех пациентов с ревматической болезнью сердца; в остальных случаях — сочетание с недостаточностью и поражением других клапанов.
ПРОФИЛАКТИКА
Всем больным с митральным стенозом показана вторичная профилактика рецидивов ревматической лихорадки. Кроме того, всем больным показана профилактика инфекционного эндокардита.
СКРИНИНГ
Скрининг следует проводить у лиц, перенёсших острую ревматическую лихорадку. Основной метод скрининга — аускультация сердца.
КЛАССИФИКАЦИЯ
Митральный стеноз классифицируют по степени тяжести (табл. 56).
Таблица 56. Классификация митрального стеноза по степени тяжести

ДИАГНОСТИКА
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
При площади митрального отверстия более 1,5см2 симптомы в большинстве случаев отсутствуют, однако увеличение трансмитрального кровотока или снижение времени диастолического заполнения приводит к резкому повышению давления в левом предсердии и появлению симптомов. Провоцирующие (триггерные) факторы декомпенсации:
- физические нагрузки
- эмоциональный стресс
- мерцание (фибрилляция) предсердий
- беременность.
Первым симптомом митрального стеноза может быть эмболическое событие после развития мерцательной аритмии, чаще всего инсульт. Источником эмболии обычно бывают тромбы, расположенные в левом предсердии, особенно в его ушке. При повышении давления в малом круге кровообращения (особенно в стадии пассивной лёгочной гипертензии) возникает одышка при физической нагрузке. При прогрессировании стеноза одышка возникает при меньших нагрузках. Следует помнить, что жалобы на одышку могут отсутствовать даже при несомненной лёгочной гипертензии, так как больной может вести малоподвижный образ жизни или подсознательно ограничивать повседневную физическую активность. Пароксизмальная ночная одышка возникает в результате застоя крови в малом круге кровообращения при положении больного лёжа как проявление интерстициального отёка лёгких и резкого увеличения давления крови в сосудах малого круга кровообращения. Вследствие увеличения давления в лёгочных капиллярах и пропотевания плазмы и эритроцитов в просвет альвеол может развиться кровохарканье. Больные часто жалуются на повышенную утомляемость, сердцебиение, перебои в работе сердца. Может быть преходящая охриплость голоса (симптом Ортнера). Этот симптом возникает в результате сдавления возвратного нерва увеличенным левым предсердием.
Физикальные признаки у бессимптомных пациентов могут отсутствовать. При развитии выраженной декомпенсации можно наблюдать facies mitralis, эпигастральную пульсацию и признаки правожелудочковой сердечной недостаточности.
Аускультативная картина при митральном стенозе достаточно характерна:
- усиленный (хлопающий) Iтон
- следующий за IIтоном тон открытия митрального клапана
- диастолический шум с пресистолическим усилением.
ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА
Метод выбора для диагностики митрального стеноза — двухмерная эхо-кардиография с допплеровским анализом. Этот метод позволяет оценить:
- подвижность створок
- выраженность сращения по комиссурам, фиброза и кальциноза
- наличие подклапанных спаек.
Тяжесть стеноза оценивают с помощью допплеровского исследования. Средний трансмитральный градиент давления и площадь митрального клапана могут быть достаточно точно определены с помощью непрерывно-волновой техники. Большое значение имеет оценка степени лёгочной гипертензии, а также сопутствующей митральной и аортальной регургитации. Дополнительную информацию можно получить с помощью нагрузочного теста (стресс-эхокардиографии) с регистрацией трансмитрального и трикуспидального кровотока. При площади митрального клапана <1,5см2 и градиенте давления >50мм рт.ст. (после нагрузки) необходимо рассмотреть вопрос о выполнении баллонной митральной вальвулопластики.
ПОКАЗАНИЯ К ЭХОКАРДИОГРАФИИ
Диагностика митрального стеноза и оценка его гемодинамической тяжести (среднего градиента, площади митрального клапана, давления в лёгочной артерии), оценка состояния других клапанов, оценка морфологии митрального клапана (возможность баллонной вальвулопластики).
Повторное обследование пациента с уже установленным диагнозом митрального стеноза при изменении состояния или появлении симптомов.
Оценка ответа на нагрузку (изменение среднего градиента и давления в лёгочной артерии) при расхождении данных допплеровского исследования и симптоматики.
Эхокардиография целесообразна для повторного обследования бессимптомных пациентов с митральным стенозом и стабильным состоянием для определения давления в лёгочной артерии (при тяжёлом митральном стенозе ежегодно, при умеренном через 1—2 года, при лёгком митральном стенозе 1р в 3-5лет).
Проведение чреспищеводной эхокардиографии показано:
- для уточнения вопроса о наличии или отсутствии тромба левого предсердия и уточнения степени митральной регургитации при запланированной баллонной митральной вальвулопластике
- для уточнения морфологии митрального клапана и оценки гемодинамики в тех случаях, когда трансторакальная эхокардиография даёт результаты неудовлетворительного качества.
Чреспищеводное исследование позволяет точно оценить состояние клапанного аппарата и выраженность изменений подклапанных структур, а также оценить вероятность рестеноза. Кроме того, спонтанное эхоконтрастирование при проведении чреспищеводной эхокардиографии — независимый показатель эмболических осложнений у больных с митральным стенозом. Однако относительная техническая сложность процедуры и необходимость специального обучения персонала ограничивают применение чреспищеводной эхокардиографии.
В специализированных кардиохирургических учреждениях для уточнения диагноза проводят катетеризацию сердца.
Катетеризация сердца и магистральных сосудов показана:
- для оценки тяжести митрального стеноза, когда результаты неинвазивных методов неинформативны или есть расхождение между данными неинвазивных методов и клиническими признаками, характеризующими тяжесть митрального стеноза
- если есть расхождение между средним градиентом и площадью клапана, которые определены допплеровским методом.
Катетеризация сердца целесообразна:
- для оценки ответа на нагрузку (изменение давления в лёгочной артерии и левом предсердии) при расхождении симптоматики и данных гемодинамики в покое, полученных в результате неинвазивных тестов
- для установления причины тяжёлой лёгочной гипертензии, несоразмерной с тяжестью митрального стеноза по данным неинвазивных тестов.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
При тщательном обследовании диагноз митрального порока обычно не вызывает сомнений. Дифференциально-диагностические признаки митрального стеноза и других пороков сердца, выявляемые при физикальном обследовании, представлены в табл. 57.
Таблица 57. Дифференциальный диагноз пороков сердца по данным физикального обследования

Митральный стеноз дифференцируют также от миксомы левого предсердия, других клапанных дефектов (митральная недостаточность, стеноз трёхстворчатого клапана), дефекта межпредсердной перегородки.
ЛЕЧЕНИЕ
ЦЕЛИЛЕЧЕНИЯ
Цель лечения — увеличить продолжительность жизни и облегчить симптомы заболевания.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Госпитализация показана больным с клиническими проявлениями митрального стеноза, не поддающимися адекватному контролю в амбулаторных условиях.
Госпитализация необходима больным без клинических проявлений, но с прогрессирующим увеличением сердца или снижением его сократительной способности.
На госпитализацию следует направлять пациентов, которым показано оперативное лечение.
МЕДИКАМЕНТОЗНАЯ ТЕРАПИЯ
Медикаментозную терапию назначают для контроля симптомов, например, при подготовке к хирургическому вмешательству или при невозможности его выполнения.
Диуретики снижают давление в левом предсердии и облегчают симптомы, связанные с застоем крови в малом круге кровообращения. В то же время их надо применять с осторожностью, так как может снизиться сердечный выброс.
Б-блокаторы и урежающие ритм антагонисты кальция (верапамил и дилтиазем) снижают чсс в покое и при нагрузке, улучшая наполнение левого желудочка за счёт удлинения диастолы. Эти препараты могут облегчить симптомы, связанные с физической нагрузкой, их применение особенно показано при синусовой тахикардии и мерцании предсердий.
Мерцательная аритмия — частое осложнение митрального стеноза, особенно у лиц старшего возраста. Риск тромбоэмболии при наличии мерцательной аритмии значительно увеличивается (10-летняя выживаемость — 25% больных по сравнению с 46% у больных с синусовым ритмом). Терапия непрямыми антикоагулянтами показана:
- всем больным с митральным стенозом, осложнённым мерцательной аритмией (пароксизмальной, персистирующей или постоянной)
- больным с эмболическими событиями в анамнезе, даже при сохранённом синусовом ритме
- пациентам с тромбом в левом предсердии.
Назначение непрямых антикоагулянтов целесообразно:
- больным с тяжёлым митральным стенозом и размером левого предсердия >55мм
- пациентам с тяжёлым митральным стенозом, расширением левого предсердия и спонтанным контрастированием при эхокардиографии.
Терапию проводят под контролем международного нормализованного отношения MHO, целевые уровни MHO от 2,0 до 3,0. Если у больного возникают эмболические осложнения, несмотря на проводимую антикоагулянтную терапию, рекомендуют добавить аспирин в дозе 75—100мг/сут. Следует отметить, что рандомизированных контролируемых исследований антикоагулянтной терапии у больных с митральным стенозом не проводили, рекомендации основаны на экстраполяции данных, полученных в когортах больных с мерцательной аритмией.
Так как появление мерцательной аритмии у больного с митральным стенозом сопровождается декомпенсацией, первостепенное значение имеет терапия, направленная на урежение ритма желудочков. Как сказано выше, препаратами выбора могут быть б-блокаторы, верапамил или дилтиазем. Возможно также применение дигоксина, однако узкий терапевтический интервал и худшая по сравнению с б-блокаторами способность предотвращать учащение ритма при нагрузках ограничивают его использование. Электрическая кардиоверсия также имеет ограниченное применение при персистирующей мерцательной аритмии, так как без хирургического лечения митрального стеноза вероятность рецидива очень высока.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Основной метод лечения митрального стеноза хирургический, так как на сегодняшний день нет медикаментозной терапии, способной замедлить прогрессирование стеноза. Процедура выбора — баллонная митральная вальвулопластика.
Показания для проведения митральной баллонной вальвулопластики при митральном стенозе:
- декомпенсация порока (сердечная недостаточность по классификации NYHA II, III или IV ФК) при умеренном или тяжёлом стенозе и при соответствующей морфологии митрального клапана, отсутствии тромба левого предсердия и сопутствующей умеренной или тяжёлой митральной регургитации
- отсутствие симптомов и умеренный или тяжёлый митральный стеноз при соответствующей морфологии митрального клапана и наличии лёгочной гипертензии (систолическое давление в лёгочной артерии больше 50мм рт.ст.) в отсутствие тромба левого предсердия и сопутствующей умеренной или тяжёлой митральной регургитации.
Кроме того, проведение митральной баллонной вальвулопластики целесообразно у пациентов с умеренным или тяжёлым митральным стенозом с кальцинированными, жёсткими створками клапана, с III—IV ФК сердечной недостаточности по NYHA и у пациентов, которым противопоказано хирургическое лечение или у которых оно сопряжено с высоким риском.
Пластику (открытая комиссуротомия) или протезирование митрального клапана проводят по следующим показаниям:
- при наличии сердечной недостаточности III—IV ФК и умеренном или тяжёлом митральном стенозе в тех случаях, когда: невозможна митральная баллонная вальвулопластика, митральная баллонная вальвулопластика противопоказана в связи с тромбом в левом предсердии, несмотря на терапию антикоагулянтами, или в связи с сопутствующей умеренной или тяжёлой митральной регургитацией, морфология клапана не подходит для митральной баллонной вальвулопластики
- при умеренном или тяжёлом митральном стенозе и сопутствующей умеренной или тяжёлой митральной регургитации показано протезирование клапана, если невозможно проведение пластики. Протезирование митрального клапана целесообразно при тяжёлом митральном стенозе и тяжёлой лёгочной гипертензии (систолическое давление в лёгочной артерии более 60 мм рт.ст.), симптомах сердечной недостаточности I—II ФК, если не предполагается митральная баллонная вальвулопластика или пластика митрального клапана.
ОБУЧЕНИЕ ПАЦИЕНТА
Необходимо рассказать пациенту о заболевании, объяснить необходимость терапии антикоагулянтами при мерцательной аритмии и регулярного контроля MHO, разъяснить цели вторичной профилактики ревматической лихорадки. Пациента необходимо информировать о естественном течении митрального стеноза, преимуществах и возможных осложнениях хирургического лечения (вальвулопластика, протезирование).
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ БОЛЬНОГО
Пациенты, не имеющие симптомов декомпенсации, должны обследоваться ежегодно. Обследование должно включать сбор жалоб, анамнеза, осмотр, рентгенографию грудной клетки и ЭКГ. Если состояние пациента изменилось за предшествующий период или по результатам предшествующего обследования имеется тяжёлый митральный стеноз, показано проведение эхокардиографии. Во всех остальных случаях ежегодная эхо-кардиография не обязательна. Если пациент жалуется на сердцебиение, рекомендовано проведение суточного (холтеровского) мониторирования ЭКГ для выявления пароксизмов фибрилляции (мерцания) предсердий.
ВЕДЕНИЕ ПОСЛЕ ВАЛЬВУЛОПЛАСТИКИ ИЛИ КОМИССУРОТОМИИ
Как минимум через 72ч после хирургической процедуры необходима эхокардиография для оценки послеоперационной гемодинамики и для исключения осложнений, таких как митральная регургитация, дисфункция левого желудочка или дефект межпредсердной перегородки (в случае баллонной вальвулопластики). При наблюдении за пациентом может потребоваться повторная баллонная вальвулопластика в случае возникновения рестеноза.
ПРОГНОЗ
Митральный стеноз обычно прогрессирует медленно и протекает с длительным периодом компенсации. Более 80% пациентов выживают в течение 10 лет при отсутствии симптомов или умеренно выраженных признаках ХСН (I-II функциональный класс по NYHA). Десятилетняя выживаемость декомпенсированных и неоперированных больных значительно хуже и не превышает 15%. При формировании тяжёлой лёгочной гипертензии средний срок выживаемости не превышает 3лет.
ХРОНИЧЕСКАЯ МИТРАЛЬНАЯ РЕГУРГИТАЦИЯ
Хроническая митральная регургитация (недостаточность) — поражение аппарата митрального клапана (створок, сухожильных хорд, папиллярных мышц), при котором возникает обратный ток крови из левого желудочка в левое предсердие во время систолы.
КОДЫ МКБ-10
I05.1 Ревматическая недостаточность митрального клапана
I34.0 Митральная (клапанная) недостаточность
I34.8 Другие неревматические поражения митрального клапана.
ЭПИДЕМИОЛОГИЯ
В настоящее время ведущие причины митральной регургитации — миксоматозная дегенерация и кальциноз створок клапана, а также ишемическая болезнь сердца. На долю ревматической болезни сердца приходится около 14% среди всех причин митральной регургитации.
ПРОФИЛАКТИКА
Больным с ревматической митральной регургитацией показана вторичная профилактика рецидивов ревматической лихорадки. Всем больным показана профилактика инфекционного эндокардита.
СКРИНИНГ
У пациентов без клинических проявлений диагноз митральной регургитации обычно выставляют при обследовании по поводу других заболеваний. У лиц, перенёсших острую ревматическую лихорадку, следует проводить скрининг на наличие митрального порока сердца. Основной скрининговый метод — аускультация сердца.
КЛАССИФИКАЦИЯ
Классификация митральной регургитации по степени тяжести представлена в табл. 58.
 Таблица
58. Допплер-эхокардиографическая оценка тяжести митральной регургитации
Таблица
58. Допплер-эхокардиографическая оценка тяжести митральной регургитации
ДИАГНОСТИКА
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Симптомы при митральной регургитации могут длительное время отсутствовать. Часто наблюдают сердцебиение, слабость, повышенную утомляемость. Могут быть кровохарканье и одышка, однако эти симптомы более характерны при митральном стенозе. При аускультации сердца Iтон обычно ослаблен. IIтон часто расщеплён на аортальный и лёгочный компоненты.
Наиболее характерный аускультативный признак митральной регургитации — голосистолический шум, начинающийся сразу после Iтона. Лучше всего он выслушивается на верхушке сердца в фазе выдоха, особенно в положении на левом боку после физической нагрузки. Чем громче и продолжительнее шум, тем тяжелее митральная регургитация. При тяжёлой митральной регургитации часто выслушивается IIIтон. В то же время наличие IIIтона не обязательно указывает на хроническую сердечную недостаточность, а служит следствием быстрого заполнения левого желудочка увеличенным объёмом крови из левого предсердия.
ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА
На ЭКГ при митральной регургитации могут быть признаки увеличения левого предсердия и гипертрофии левого желудочка, а также признаки мерцательной аритмии. При выполнении рентгенографии грудной клетки можно наблюдать признаки застоя в малом круге кровообращения, увеличения левого предсердия и левого желудочка.
Основной метод диагностики митральной регургитации — допплер-эхо-кардиография, которая позволяет оценить структуру митрального клапана, размеры и функцию левого предсердия и левого желудочка, оценить тяжесть регургитации и давление в лёгочной артерии.
Показания к эхокардиографии при митральной регургитации:
- оценка размеров и функции левого желудочка, размеров правого желудочка и левого предсердия, давления в лёгочной артерии и тяжести митральной регургитации
- уточнение причины митральной регургитации
- повторное обследование (ежегодное или 1р в 6мс) бессимптомных пациентов с умеренной или тяжёлой митральной регургитацией для оценки функции левого желудочка (фракции выброса и конечно-систолического размера)
- оценка аппарата митрального клапана и функции левого желудочка при изменении состояния или при появлении симптомов
- оценка размеров, функции левого желудочка и гемодинамики после пластики или протезирования митрального клапана.
Катетеризацию полостей сердца проводят для уточнения функции левого желудочка, степени митральной регургитации, наличия сопутствующей ИБС, пороков других клапанов и степени лёгочной гипертензии.
Показания к катетеризации сердца при митральной регургитации:
- невозможность точной оценки тяжести регургитации и функции левого желудочка с помощью неинвазивных методов или при запланированном хирургическом вмешательстве
- давление в лёгочной артерии несоразмерно тяжести митральной регургитации по данным неинвазивных тестов
- оценка тяжести митральной регургитации, если есть расхождение между данными неинвазивных методов и клиническими признаками.
Коронарная ангиография показана перед хирургическим вмешательством у пациентов с высоким риском ИБС.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Митральную регургитацию дифференцируют от гипертрофической кардиомиопатии, лёгочной или трикуспидальной регургитации, дефекта межжелудочковой перегородки. У пожилых больных необходимо дифференцировать митральную регургитацию от кальцинированного аортального стеноза (см. табл. 57).
Лечение
ЦЕЛИ ЛЕЧЕНИЯ
Цель лечения — улучшение прогноза (предотвращение дисфункции левого желудочка, тромбоэмболических событий) и облегчение симптомов заболевания.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Подозрение на острую митральную регургитацию. Госпитализация показана для определения тяжести и этиологии клапанной дисфункции, исключения сопутствующего инфекционного эндокардита и острой ишемии миокарда и для начала лечения.
Клинические проявления митрального порока, не поддающиеся адекватному контролю в амбулаторных условиях.
Больные без клинических проявлений, но с прогрессирующим увеличением сердца или снижением его сократительной способности.
Показания для оперативного лечения.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Если хирургическое лечение невозможно (например, при тяжёлых сопутствующих заболеваниях), проводят медикаментозное лечение митральной регургитации. Обосновано применение нитратов и диуретиков, хотя контролируемые исследования эффективности этих препаратов при митральной регургитации не проводились. Применение ингибиторов АПФ, по данным небольшого количества работ, эффективно у больных с митральной регургитацией и ХСН. Надо отметить, что при ишемической митральной регургитации применение ингибиторов АПФ и других вазодилататоров более эффективно, так как оно уменьшает степень регургитации. При мерцательной аритмии показано назначение дигоксина и антикоагулянтов. Вопрос о терапии антикоагулянтами подробно рассмотрен в разделе, посвященном митральному стенозу. В целом пациенты с митральной регургитацией менее склонны к эмболическим осложнениям по сравнению с пациентами с митральным стенозом, но более склонны к инфекционному эндокардиту. Поэтому профилактику инфекционного эндокардита больным с митральной регургитацией нужно проводить обязательно.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Основной метод лечения митральной регургитации хирургический (пластика или протезирование митрального клапана). Оперативное лечение показано при появлении симптомов ХСН или при нарушении систолической функции левого желудочка.
Основные показания к хирургическому вмешательству при митральной регургитации:
- тяжёлая митральная регургитация, сопровождающаяся симптомами сердечной недостаточности II, III или IV ФК при отсутствии тяжёлой дисфункции левого желудочка (фракция выброса менее 30%) и/или конечно-систолическом размере желудочка менее 55мм
- тяжёлая митральная регургитация при отсутствии симптомов, но в сопровождении лёгкой и умеренной дисфункции левого желудочка (фракция выброса от 30 до 60%, конечно-систолический размер не менее 40мм)
- реконструктивная операция (пластика митрального клапана) предпочтительна перед протезированием у большинства пациентов с тяжёлой митральной регургитацией. Пациентов следует направлять в кардиохирургические центры, имеющие опыт реконструктивных операций на митральном клапане.
ОБУЧЕНИЕ ПАЦИЕНТА
Необходимо рассказать пациенту о заболевании, объяснить необходимость терапии антикоагулянтами при мерцательной аритмии и вторичной профилактики ревматической лихорадки. Пациента необходимо информировать о естественном течении митральной регургитации и о преимуществах и возможных осложнениях хирургического лечения.
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ БОЛЬНОГО
Пациентов с лёгкой митральной регургитацией без дилатации или дисфункции левого желудочка и без лёгочной гипертензии нужно осматривать ежегодно. Пациенты должны знать, что при появлении симптомов необходимо обратиться к врачу, не дожидаясь запланированного визита. Ежегодное выполнение эхокардиографии не обязательно. При умеренной митральной регургитации во время ежегодного обследования необходима эхокардиография. Бессимптомные пациенты с тяжёлой митральной регургитацией должны наблюдаться врачом с интервалом 6-12мс. Помимо эхокардиографии, возможно проведение нагрузочных тестов. При появлении симптомов хирургическое лечение необходимо даже при сохранённой функции левого желудочка.
ПРОГНОЗ
При митральной регургитации наблюдают достаточно длительный период компенсации, но при формировании систолической дисфункции левого желудочка появляются симптомы ХСН. Прогноз при ревматической митральной регургитации более благоприятный, чем при ишемической.
ИШЕМИЧЕСКАЯ МИТРАЛЬНАЯ РЕГУРГИТАЦИЯ
Ишемическая митральная регургитация — следствие дисфункции левого желудочка, возникшей после перенесённого инфаркта миокарда. Створки митрального клапана при этом не изменены, и регургитация возникает из-за смещения папиллярных мышц и напряжения хорд. Хирургическое лечение ишемической митральной регургитации заключается в коронарном шунтировании и пластике митрального клапана.
ОСТРАЯ МИТРАЛЬНАЯ РЕГУРГИТАЦИЯ
Острая митральная регургитация — состояние, при котором из-за резкой перегрузки неадаптированных левых отделов сердца всегда наблюдают выраженные клинические проявления. Основные причины — инфекционный эндокардит, разрыв сухожильных хорд и острая ишемическая дисфункция папиллярной мышцы. Диагностика острой митральной регургитации затруднена, так как систолический шум не всегда бывает голосистолическим и часто отсутствует. Трансторакальная эхокардиография даёт ценную информацию о типе повреждения (например, о разрыве хорд), но возможна недооценка тяжести митральной регургитации. Наиболее точный диагностический метод при острой митральной регургитации — чреспищеводная эхокардиография. Острая митральная регургитация — показание к срочному хирургическому лечению. Для стабилизации гемодинамики применяют внутривенное введение нитропруссида натрия, при гипотензии в комбинации с добутамином.
ПРОЛАПС МИТРАЛЬНОГО КЛАПАНА
Пролапс митрального клапана — прогиб, смещение створок клапана в полость левого предсердия во время систолы.
КОД МКБ-10
I34.1 Пролапс (пролабирование) митрального клапана.
ЭПИДЕМИОЛОГИЯ
По данным современных эхокардиографических критериев, распространённость пролапса митрального клапана в популяции составляет 1,6—2,4%. Основная причина пролапса митрального клапана — миксоматозная дегенерация створок.
ПРОФИЛАКТИКА
Профилактика пролапса митрального клапана не разработана. При установленном диагнозе пролапса митрального клапана, особенно в сочетании с регургитацией, показана профилактика инфекционного эндокардита (назначение антибиотиков) при проведении процедур, сопровождающихся бактериемией.
СКРИНИНГ
Пролапс митрального клапана чаще всего обнаруживают случайно при проведении эхокардиографии с другой целью. У пациентов молодого и среднего возраста с низкой массой тела, астеническим телосложением, низким артериальным давлением и непостоянными средне- и позднесисолическими щелчками на верхушке рекомендовано проведение эхокардиографии для выявления пролапса митрального клапана.
КЛАССИФИКАЦИЯ
По степени тяжести (по данным эхокардиографии) выделяют:
- пролапс I степени — прогиб створки митрального клапана в полость левого предсердия на 3-5мм
- пролапс II степени — прогиб створки на 6-9мм
- пролапс III степени — прогиб створки более 9мм.
Классификация сопутствующей митральной регургитации по степени тяжести представлена в соответствующем разделе.
ДИАГНОСТИКА
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Пациенты с пролапсом митрального клапана часто жалуются на сердцебиение, боли в грудной клетке, тревожность, повышенную утомляемость. При аускультации можно обнаружить средне- или позднесистолический щелчок в сочетании с позднесистолическим шумом.
ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА
Подтверждающее диагноз пролапса митрального клапана исследование — эхокардиография. При систолическом смещении створок клапана в полость левого предсердия более 2мм (в двухмерном режиме) и толщине стенок 5мм и более устанавливают диагноз пролапса митрального клапана.
Катетеризация сердца показана пациентам с тяжёлой митральной регургитацией и симптомами левожелудочковой недостаточности.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Пролапс митрального клапана чаще всего приходится дифференцировать от митральной регургитации ревматической или ишемической этиологии (см. табл. 57).
ЛЕЧЕНИЕ
ЦЕЛИ ЛЕЧЕНИЯ
Улучшение прогноза и качества жизни.
МЕДИКАМЕНТОЗНАЯ ТЕРАПИЯ
При жалобах на сердцебиение, дискомфорт или боль в грудной клетке эффективна терапия б-блокаторами.
Пациентам, перенёсшим транзиторные ишемические атаки, при сохранённом синусовом ритме рекомендован ежедневный приём аспирина в дозе 75-325мг.
Длительная терапия варфарином рекомендована больным, перенёсшим нарушения мозгового кровообращения и имеющим сопутствующую митральную регургитацию, фибрилляцию предсердий или тромб в левом предсердии. Необходимо поддерживать MHO в интервале 2,0-3,0.
Пациентам с пролапсом митрального клапана и мерцательной аритмией терапия варфарином показана в следующих случаях:
- возраст старше 65лет
- сопутствующая митральная регургитаци
- артериальная гипертензия
- сердечная недостаточность.
Во всех остальных случаях достаточно терапии ацетилсалициловой кислотой.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Хирургическое лечение пролапса митрального клапана показано:
- при разрыве хорд или выраженном их удлинении
- при тяжёлой митральной регургитации, сопровождающейся симптомами сердечной недостаточности.
Самый частый вид хирургического вмешательства — пластика митрального клапана, для которой характерны низкая операционная летальность и хороший долговременный прогноз.
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ БОЛЬНОГО
При пролапсе митрального клапана, сопровождающемся лёгкой митральной регургитацией, повторная эхокардиография необходима только при появлении симптомов. Частота осмотров врача 1р в 3-5лет. При сопутствующей умеренной или тяжёлой регургитации периодичность наблюдения 1р в год.
ПРОГНОЗ
У большинства пациентов с пролапсом митрального клапана прогноз благоприятный. Факторы неблагоприятного прогноза при пролапсе митрального клапана:
- умеренная или тяжёлая митральная регургитация
- фракция выброса ниже 50%
- утолщение створок митрального клапана >5мм.
АОРТАЛЬНЫЙ СТЕНОЗ
Аортальный стеноз — сужение устья аорты, препятствующее нормальному току крови из левого желудочка в аорту.
КОДЫ МКБ-10
I06.0 Ревматический аортальный стеноз
I06.2 Ревматический аортальный стеноз с недостаточностью
I35.0 Аортальный (клапанный) стеноз
I35.2 Аортальный стеноз с недостаточностью.
ЭПИДЕМИОЛОГИЯ
Аортальный стеноз — самый частый порок сердца у взрослых (70-85% случаев среди всех пороков, 2,6-8,9% в популяции). Самая частая причина аортального стеноза — дегенеративный кальциноз врождённого двустворчатого или нормального трёхстворчатого клапана (приблизительно 82% случаев). Хроническую ревматическую болезнь сердца наблюдают в 11% случаев среди всех случаев аортального стеноза (данные исследования Euro Heart Survey, 2003).
ПРОФИЛАКТИКА
У кальцинированного аортального стеноза те же факторы риска, что и у атеросклероза, первый часто сочетается с ишемической болезнью сердца. В связи с этим профилактические мероприятия те же, что и при атеросклеротических сердечно-сосудистых заболеваниях (см. Профилактика сердечно-сосудистых заболеваний). Больным с ревматическим аортальным стенозом показана вторичная профилактика рецидивов ревматической лихорадки. Кроме того, всем больным показана профилактика инфекционного эндокардита.
СКРИНИНГ
Скрининг на наличие аортального стеноза не проводят. Однако при наличии жалоб на повышенную утомляемость, боль в грудной клетке, синкопальные состояния, одышку, особенно у лиц старше 50лет, необходима тщательная аускультация сердца для исключения аортального стеноза.
КЛАССИФИКАЦИЯ
Клапанный аортальный стеноз классифицируют по степени тяжести (табл.59).
Таблица 59. Классификация аортального стеноза по степени тяжести.

Дополнительный признак тяжёлого аортального стеноза — индекс площади аортального клапана менее 0,6 см2/м2 (отношение площади клапана к площади поверхности тела).
ДИАГНОСТИКА
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Основные симптомы аортального стеноза: стенокардия, синкопальные состояния и сердечная недостаточность — чаще появляются у пациентов старше 50лет. Стенокардию наблюдают приблизительно у 2/3 больных с тяжёлым (критическим) аортальным стенозом (у половины из них есть ИБС), она похожа на стенокардию в рамках ИБС. Приступы провоцируются нагрузкой и исчезают в покое. У пациентов без ИБС стенокардия — результат несоответствия между потребностью гипертрофированного миокарда в кислороде и уменьшением его доставки, вызванной чрезмерной компрессией коронарных сосудов. Изредка к стенокардии приводит эмболия кальция в коронарное сосудистое русло.
Синкопальные состояния обычно связаны с уменьшенным мозговым кровотоком во время нагрузки, когда АД уменьшается вследствие фиксированного сердечного выброса. Обмороки также могут быть связаны с дисфункцией барорецепторов и вазодепрессорным ответом на резкое увеличение левожелудочкового систолического давления во время нагрузок. Гипотония при нагрузке может проявляться как «серая пелена» перед глазами или головокружением. Обмороки в покое могут быть следствием транзиторной фибрилляции желудочков, прекращающейся самостоятельно, или транзиторного мерцания предсердий с потерей вклада предсердий в наполнение левого желудочка, что приводит к падению сердечного выброса.
Одышка при нагрузке и ортопноэ, пароксизмальная ночная одышка и отёк лёгких отражают различную степень венозной лёгочной гипертензии. Это относительно поздние симптомы, и их присутствие у больного с ревматическим аортальным стенозом должно навести на мысль о сопутствующем митральном пороке.
Предположительный диагноз тяжёлого аортального стеноза может быть поставлен на основании:
- систолического шума изгнания
- замедления и уменьшения пульса на сонных артериях
- разлитого верхушечного толчка
- уменьшения интенсивности аортального компонента в формировании II тона.
Можно также наблюдать парадоксальное расщепление II тона.
Систолический шум при аортальном стенозе — характерный шум изгнания, который возникает вскоре после Iтона, увеличивается по интенсивности и достигает пика к середине периода изгнания, после чего постепенно уменьшается и исчезает как раз перед закрытием аортального клапана. Шум лучше всего выслушивается в основании сердца, но часто хорошо проводится вдоль сонных артерий и на верхушку сердца. Когда развивается недостаточность левого желудочка и уменьшается сердечный выброс, шум становится мягче или исчезает совсем. В этом случае заболевание трудно распознать: формируется клиническая картина тяжёлой левожелудочковой недостаточности с низким сердечным выбросом. Таким образом, аортальный стеноз может быть причиной рефрактерной сердечной недостаточности, поэтому эхокардиография показана всем больным с тяжёлой сердечной недостаточностью неизвестной причины, так как оперативное лечение может спасти жизнь или обеспечить существенное клиническое улучшение.
ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА
При подозрении на аортальный стеноз необходимо инструментальное обследование, включающее ЭКГ, рентгенографию органов грудной клетки и эхокардиографию.
Показания к эхокардиографии:
- диагностика аортального стеноза и оценка его тяжести
- оценка толщины стенок, размеров и функции левого желудочка
- повторное обследование пациентов с установленным диагнозом аортального стеноза при изменении или появлении симптомов
- повторное обследование бессимптомных пациентов с установленным диагнозом аортального стеноза (каждый год при тяжёлом, каждые 1—2 года при умеренном и каждые 3—5 лет при лёгком аортальном стенозе).
Проведение нагрузочных тестов рекомендовано только бессимптомным пациентам и только в специализированных учреждениях (кардиологический диспансер или консультативно-диагностический центр). Стресс-тесты могут обнаружить пациентов с ограниченной переносимостью нагрузок или выявить симптомы, отсутствующие в покое.
Показания к катетеризации сердца и коронароангиографии:
- пациенты с аортальным стенозом и предполагаемым диагнозом ИБС перед протезированием аортального клапана
- декомпенсированные пациенты, когда имеется расхождение между данными неинвазивных методов и клиническими признаками.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
При подозрении на аортальный стеноз необходимо исключить гипертрофическую кардиомиопатию, стеноз клапана лёгочной артерии, дефект межжелудочковой перегородки. Необходимо исключить митральную недостаточность (см. табл. 57).
ЛЕЧЕНИЕ
ЦЕЛИ ЛЕЧЕНИЯ
Цель лечения — предотвращение внезапной смерти, дисфункции левого желудочка и сердечной недостаточности, облегчение симптомов заболевания.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Декомпенсированным пациентам с тяжёлым аортальным стенозом показано оперативное лечение. Однако медикаментозная терапия может понадобиться пациентам, которые признаны неоперабельными (как правило, вследствие сопутствующей патологии).
Сердечные гликозиды показаны только при увеличении объёма левого желудочка (конечно-систолический объём >50мл) и/или снижении фракции выброса <35%.
Диуретики оказывают положительный эффект при чрезмерном накоплении жидкости, но их следует использовать осторожно, так как гиповолемия, уменьшая конечно-диастолическое давление в левом желудочке, приводит к снижению сердечного выброса и часто вызывает ортостатическую гипотензию.
Б-блокаторы угнетают сократительную функцию миокарда, усугубляют недостаточность левого желудочка и поэтому противопоказаны при тяжёлой степени стеноза (площадь отверстия аортального клапана <1см2). Однако при умеренном или лёгком стенозе назначение этих препаратов в малых дозах и короткими курсами оправдано для профилактики развития стенокардии и внезапной смерти.
В условиях стационара можно назначать вазодилататоры (ингибиторы АПФ, празозин, гидралазин, нитропруссид натрия, нитраты) короткими курсами для уменьшения постнагрузки на левый желудочек сердца, обусловленной самим стенозом и рефлекторным спазмом артериальных сосудов.
Резкое ухудшение состояния у больных с аортальным стенозом могут вызывать предсердные и желудочковые нарушения ритма. Наряду с электрической кардиоверсией показано использование антиаритмических препаратов III класса, в частности амиодарона.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Единственный эффективный метод лечения аортального стеноза — протезирование клапана аорты. Показания к хирургическому лечению:
- появление симптомов при тяжёлом аортальном стенозе
- запланированное коронарное шунтирование при тяжёлом аортальном стенозе
- запланированное вмешательство на аорте или других клапанах при тяжёлом аортальном стенозе
- тяжёлый аортальный стеноз в сочетании с систолической дисфункцией левого желудочка (фракция выброса <50%).
Протезирование аортального клапана целесообразно у пациентов с умеренным аортальным стенозом, если запланировано коронарное шунтирование, вмешательство на аорте или других клапанах сердца.
ОБУЧЕНИЕ ПАЦИЕНТА
Необходимо рассказать пациенту о заболевании, объяснить необходимость немедленно обратиться к врачу при появлении симптомов (стенокардия, обмороки, одышка, ухудшение переносимости физических нагрузок). Пациента необходимо информировать о естественном течении аортального стеноза, преимуществах и возможных осложнениях хирургического лечения.
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ БОЛЬНОГО
Основные факторы, определяющие частоту повторных осмотров врача — тяжесть аортального стеноза и наличие сопутствующих заболеваний. Во время каждого осмотра необходимо тщательно собирать анамнез, проводить физикальное обследование. При тяжёлом аортальном стенозе необходимо ежегодно проводить эхокардиографию. При умеренном аортальном стенозе периодичность эхокардиографии 1р в 1—2года, при лёгком 1р в 3-5лет.
ПРОГНОЗ
Течение аортального стеноза без оперативного вмешательства неблагоприятное. После длительного латентного периода смертельный исход наступает через 2 года при появлении левожелудочковой ХСН, через 3 при появлении обмороков и через 5 при появлении стенокардии.
ХРОНИЧЕСКАЯ АОРТАЛЬНАЯ РЕГУРГИТАЦИЯ
Аортальная регургитация (недостаточность) — заболевание, характеризующееся ретроградным током крови из аорты в левый желудочек через патологически изменённый аортальный клапан.
КОДЫ МКБ-10
I06.1 Ревматическая недостаточность аортального клапана
I35.1 Аортальная (клапанная) недостаточность.
ЭПИДЕМИОЛОГИЯ
Хроническую аортальную регургитацию наблюдают в 10% случаев среди других пороков сердца у взрослых (данные Euro Heart Survey, 2003). Аортальная регургитация может быть следствием поражения створок клапана (инфекционный эндокардит, ревматическая лихорадка, миксоматозная дегенерация) или корня аорты (дилатация корня аорты при АГ, синдром Марфана, системные заболевания, сифилис).
ПРОФИЛАКТИКА
Больным с ревматической аортальной регургитацией показана вторичная профилактика рецидивов ревматической лихорадки. Всем больным показана профилактика инфекционного эндокардита.
СКРИНИНГ
Специального скрининга на аортальную регургитацию не проводят. Однако если есть жалобы на повышенную утомляемость, боль в грудной клетке, синкопальные состояния, одышку, регистрируется высокое пульсовое АД, необходима тщательная аускультация сердца для исключения аортальной регургитации.
КЛАССИФИКАЦИЯ
Классификация аортальной регургитации по степени тяжести представлена в табл. 60
Таблица 60. Допплер-эхокардиографическая оценка тяжести аортальной регургитации.

ДИАГНОСТИКА
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Аортальная регургитация длительное время протекает бессимптомно. При декомпенсации возникают одышка при нагрузках, ортопноэ, пароксизмальное ночное удушье. Стенокардия и синкопальные состояния наблюдают реже, чем при аортальном стенозе. Характерный аускультативный признак аортальной регургитации — дующий протодиастолический шум, который лучше всего слышен по левому краю грудины. Дополнительно можно выслушать диастолический шум Остина—Флинта на верхушке сердца. Этот шум возникает из-за того, что струя регургитирующей из аорты крови вызывает вибрацию створок митрального клапана. Высокий ударный объём, наблюдающийся при аортальной регургитации, приводит к увеличению пульсового давления. Как следствие, возникает большое количество признаков увеличенного пульсового АД.
Основные периферические признаки аортальной регургитации:
- «капиллярный» пульс Квинке (возникает при небольшом нажатии на ногтевое ложе)
- пляска каротид
- симптом Корригена (быстрое нарастание пульсовой волны и резкий её спад на лучевой артерии)
- симптом Мюссе (покачивание головы)
- симптом Хилла (систолическое АД на ногах на 30мм выше, чем на плечах).
Следует отметить, что только симптом Хилла обладает достаточной чувствительностью и специфичностью и отражает тяжесть регургитации.
ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА
Эхокардиография подтверждает диагноз и позволяет оценить функцию левого желудочка и степень регургитации (с этой целью применяют цветное допплеровское картирование).
Показания к эхокардиографии:
- диагностика и оценка тяжести аортальной недостаточности
- установление причины аортальной недостаточности (оценка морфологии клапана и корня аорты)
- оценка размеров, функции левого желудочка и степени выраженности его гипертрофии
- повторное обследование пациентов с установленным диагнозом аортальной регургитации при появлении или изменении симптомов
- повторное обследование бессимптомных пациентов с тяжёлой аортальной недостаточностью.
В специализированных учреждениях при неудовлетворительном результате эхокардиографии возможна радионуклидная ангиография или магнитно-резонансная томография.
Показания к катетеризации сердца и коронароангиографии:
- катетеризация сердца и ангиография корня аорты с измерением давления в левом желудочке показана в случаях, когда есть расхождение между данными неинвазивных методов и клиническими признаками
- коронароангиография показана пациентам с аортальной недостаточностью и предполагаемым диагнозом ИБС перед протезированием аортального клапана.
ДИФФЕРЕНЦИАЛЬНЫЙ ДИАГНОЗ
Необходимо дифференцировать хроническую и острую аортальную регургитацию. Быстрое развитие тяжёлых симптомов, нормальное пульсовое АД и отсутствие периферических признаков позволяют поставить диагноз острой аортальной регургитации.
ЛЕЧЕНИЕ
ЦЕЛИ ЛЕЧЕНИЯ
Цель лечения — увеличение продолжительности жизни и облегчение симптомов заболевания.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Вазодилататоры (нифедипин, гидралазин) снижают систолическое АД, уменьшают постнагрузку и поддерживают нормальное функционирование левого желудочка. Терапия вазодилататорами показана всем декомпенсированным пациентам с тяжёлой аортальной регургитацией или пациентам с дисфункцией левого желудочка, если хирургическое лечение по каким-то причинам противопоказано.
Ингибиторы АПФ могут быть препаратами выбора у больных с аортальной регургитацией и гипертензией, сниженной функцией левого желудочка или явной ХСН.
Терапия вазодилататорами не показана бессимптомным пациентам с аортальной регургитацией и сохранённой функцией левого желудочка.
В дополнение к вазодилататорам больным с признаками ХСН следует назначить диуретики.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Большинству пациентов с тяжёлой аортальной регургитацией и симптомами декомпенсации показано протезирование аортального клапана.
Показания к хирургическому лечению хронической аортальной регургитации:
- симптомы декомпенсации у пациентов с тяжёлой аортальной регургитацией, независимо от систолической функции левого желудочка
- хроническая тяжёлая аортальная регургитация и систолическая дисфункция левого желудочка (фракция выброса менее 50%) при отсутствии симптомов
- запланированное коронарное шунтирование, вмешательство на аорте или других клапанах при тяжёлой аортальной регургитации
- протезирование аортального клапана целесообразно у бессимптомных пациентов с тяжёлой аортальной регургитацией, нормальной функцией левого желудочка (фракция выброса больше 50%), но с его дилатацией (конечно-диастолический размер больше 75мм, конечно-систолический размер больше 55мм).
ОБУЧЕНИЕ ПАЦИЕНТА
Необходимо рассказать пациенту о заболевании, объяснить необходимость немедленного обращения к врачу при появлении симптомов (стенокардия, обмороки, одышка, ухудшение переносимости физических нагрузок). Пациента необходимо информировать о естественном течении аортальной регургитации и о преимуществах и возможных осложнениях хирургического лечения.
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ БОЛЬНОГО
Частота повторного обследования зависит от тяжести регургитации, степени дилатации левого желудочка, его систолической функции.
Бессимптомные пациенты с лёгкой аортальной регургитацией и нормальной систолической функцией левого желудочка должны проходить осмотр ежегодно. Эхокардиографию нужно выполнять каждые 2-3 года.
Бессимптомные пациенты с тяжёлой аортальной регургитацией и нормальной систолической функцией, но с дилатацией левого желудочка нуждаются в осмотре врача каждые 6мс. Эхокардиографию нужно выполнять каждые 6—12мс.
При появлении симптомов и изменении переносимости физических нагрузок повторную эхокардиографию нужно провести раньше запланированного срока.
ПРОГНОЗ
У бессимптомных пациентов с сохранённой функцией левого желудочка частота появления симптомов и/или систолической дисфункции составляет менее 6% в год. Однако при появлении систолической дисфункции у бессимптомных пациентов стенокардия и сердечная недостаточность развиваются с частотой более 25% в год. Прогноз хуже у пожилых больных, при наличии сопутствующей ИБС, тяжёлых симптомов и мерцательной аритмии. На прогноз также влияют фракция выброса, конечно-систолический и конечно-диастолический размеры левого желудочка.
ОСТРАЯ АОРТАЛЬНАЯ РЕГУРГИТАЦИЯ
При острой аортальной регургитации левый желудочек не успевает адаптироваться к перегрузке объёмом. Развивается отёк лёгких или кардиогенный шок. Эхокардиография позволяет поставить точный диагноз и установить причину регургитации. Основные причины острой аортальной регургитации — расслаивающая аневризма аорты и инфекционный эндокардит. В обоих случаях необходимо срочное хирургическое вмешательство. Терапия нитропруссидом натрия в сочетании с инотропными агентами (допамин или добутамин) помогает стабилизировать состояние пациента непосредственно перед хирургическим вмешательством.
ИСТОЧНИКИ
Practice
Guidelines for the Management of Patients With Valvular Heart Disease:
Executive Summary a Report of the American College of Cardiology/American
Heart Association Task Force on Practice Guidelines (Writing Committee to
Revise the 1998 Guidelines for the Management of Patients with Valvular Heart
Disease) Developed in Collaboration with the Society of Cardiovascular Anesthesiologists
Endorsed by the Society for Cardiovascular Angiography and Interventions and
the Society of Thoracic Surgeons / R.O. Bonow, B.A. Carabello, K. Chatterjee et
al. ACC/AHA 2006 // J. Am. Coll. Cardiol. 2006. Vol. 48, N 3. P. 598-675.
A
prospective survey of patients with valvular heart disease in Europe: The Euro
Heart Survey on Valvular Heart Disease / B. lung, G. Baron, E.G. Butchart et
al. // Eur. Heart J. 2003. Vol. 24, N 13. P. 1231-1243.
Working Group Report. Recommendations on the management of the asymptomatic patient with valvular heart disease / B. lung, С Gohlke-B rwolf, P. Tornos et al. // Ibid. 2002. Vol. 23. P. 1253-1266.
НАРУШЕНИЯ РИТМА СЕРДЦА
ФИБРИЛЛЯЦИЯ ПРЕДСЕРДИЙ
Фибрилляция предсердий ФП — разновидность наджелудочковых аритмий, характеризующаяся некоординированной высокочастотной (до 600 в минуту) электрической активностью предсердий с отсутствием их сократительной функции, а также нерегулярностью ритма желудочков.
КОД МКБ-10
I48 Фибрилляция и трепетание предсердий.
ЭПИДЕМИОЛОГИЯ
Наиболее часто встречающаяся форма наджелудочковых тахикардии. Выявляется у 0,5% взрослого населения, у 3% лиц старше 60лет, у 8—9% лиц старше 70лет.
ПРОФИЛАКТИКА
Адекватное лечение различной кардиальной и несердечной патологии, способной обусловить развитие ФП (см. Этиология).
СКРИНИНГ
Единственный метод — ЭКГ, в том числе суточное мониторирование ЭКГ. 30% взрослых больных с ФП, выявленной при скрининговой ЭКГ, не подозревают о наличии у них нарушении ритма сердца, у 40% пациентов ФП выявляют случайно.
КЛАССИФИКАЦИЯ
- постоянная (хроническая) форма ФП
- пароксизмальная ФП:
собственно пароксизмальная — длительность пароксизмов до 48ч, обычно происходит самостоятельное восстановление синусового ритма
- устойчивая пароксизмальная (персистирующая) — длительность пароксизмов от 48ч до 7сут, обычно без лечения самостоятельного восстановления синусового ритма обычно не происходит.
ЭТИОЛОГИЯ
Первичная или идиопатическая ФП (отсутствие сердечно-сосудистой или несердечной патологии как причины ФП) — 15-30%.
Заболевания сердечно-сосудистой системы:
- артериальная гипертензия
- пороки сердца
- ИБС
- кардиомиопатии
- сердечная недостаточность
- миокардиты
- операции на сердце
- травмы сердца.
Внесердечные причины:
- острая и хроническая бронхолёгочная патология
- гипертиреоз
- эмболия лёгочной артерии
- феохромоцитома
- алкогольная интоксикация
- лекарственная интоксикация
- электролитные нарушения.
ДИАГНОСТИКА
Цели диагностики:
- установление диагноза собственно ФП, её длительности, выраженности нарушения гемодинамики
- выяснение причины ФП (см. Этиология)
- оценка риска тромбоэмболических осложнений ФП при проведении лекарственной или электрической кардиоверсии.
Все три позиции должны найти отражение в формулировке диагноза. ФП в значительной части случаев может протекать бессимптомно, и её выявляют случайно при аускультации сердца во время профилактического осмотра с ЭКГ.
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
ЖАЛОБЫ И АНАМНЕЗ
В значительной части случаев клинические проявления ФП могут отсутствовать. Это более характерно для пожилых пациентов с нормосистолической или брадисистолической формой ФП.
Различные клинические проявления более ярко выражены при пароксизмальной форме ФП. Они включают в себя ощущение сердцебиения, перебоев в работе сердца. Пароксизмы ФП могут сопровождаться чувством страха, ознобом, дрожью, полиурией. При высокой частоте сердцебиения могут появляться одышка, развиваться явления острой левожелудочковой недостаточности, особенно у больных с тяжёлым органическим поражением сердца и сниженной сократимостью миокарда. Головокружение и обмороки возможны как при высокой частоте ритма сердца, так и при брадиформе ФП с возникновением продолжительных пауз между систолами желудочков.
Следует уточнить:
- длительность приступов неритмичного сердцебиения
- наличие или отсутствие провоцирующих факторов: физическое и эмоциональное напряжение, приём пищи, употребление алкоголя, кофеинсодержащих продуктов (кофе, чай, тонизирующие газированные напитки), симпатомиметиков, а также кокаина и амфетаминов
- переносимость пароксизмов и сопутствующие симптомы: предобморочные и обморочные состояния (вследствие резкого снижения сердечного выброса или острых нарушений мозгового кровообращения в результате тромбоэмболии), одышка, боли в грудной клетке стенокардитического характера, подъём или снижение артериального давления, толерантность к физической нагрузке
- в какое время суток обычно возникают симптомы, периодичность возникновения пароксизмов ФП (особенно важно для выбора метода контроля лечения ФП)
- опыт купирования аритмии, опыт использования лекарственной терапии с целью профилактики ФП, её эффективность, выполнение больным врачебных рекомендаций.
При постоянной форме ФП высокая частота желудочковых сокращений способствует развитию и прогрессированию симптомов хронической сердечной недостаточности (одышка при нагрузке и в покое, периферические отёки, набухание шейных вен и т.д.), а также развитию вторичной дилатации полостей сердца (тахикардиомиопатии).
Выяснение жалоб и анамнеза для уточнения наличия сопутствующих заболеваний и вероятной причины ФП, а также риска тромбоэмболических осложнений.
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Проводят по стандартной схеме. Характерными, но не специфическими клиническими признаками ФП служат нерегулярность сердечных сокращений и наличие дефицита пульса при сравнении ЧСС во время аускультации и при подсчёте пульса на лучевой артерии. Физикальное обследование пациентов также должно быть направлено на выявление симптомов заболевания сердечно-сосудистой системы и других органов как возможной причины возникновения ФП.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Содержание в крови калия.
Гормоны щитовидной железы: Т3, Т4, ТТГ. У пожилых больных повышение уровня ТТГ может быть единственным лабораторным признаком скрытого тиреотоксикоза, значимого для возникновения ФП.
Концентрация в крови дигоксина в случае его приёма.
Лабораторные маркеры хронического злоупотребления алкоголем, в первую очередь повышение гамма-глютамилтранспептидазы.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
ЭКГ — отсутствие зубцов Р перед каждым комплексом QRS, наличие вместо них волн фибрилляции/(мелкие неодинаковые по амплитуде отклонения от изолинии, лучше всего выявляемые в отведениях V1 и V2), разные по продолжительности интервалы R-R с частотой желудочковых ответов от 40 до 180 и более в минуту.
Суточное (по Холтеру) мониторирование ЭКГ следует назначать больным с проявлениями пароксизмальной ФП, если приступы неритминного сердцебиения возникают ежедневно. При предполагаемой постоянной форме ФП данный метод обследования используют для выявления скрытых эпизодов спонтанного кратковременного купирования приступа мерцательной аритмии, для наличия пауз в работе сердца, а также для контроля ритма сердца как без использования препаратов, влияющих на его частоту, так и на фоне их применения.
ЭхоКГ: выявление признаков различной патологии сердца (перенесённые инфаркты миокарда, патологии структуры и функции клапанов, пороки развития, кардиомиопатии и т.д.), размеры камер сердца (в первую очередь левого предсердия), наличие тромба в ушке левого предсердия, наличие и степень лёгочной гипертензии.
Чреспищеводная эхоКГ выполняют перед проведением плановой кардиоверсии при длительности ФП более 48ч для исключения тромбов в ушках предсердий.
УЗИ щитовидной железы для исключения структурной патологии щитовидной железы, обязательно перед назначением амиодарона.
Чреспищеводная электрокардиостимуляция (неинвазивное электрофизиологическое исследование) как провоцирующее исследование для диагностики нарушений ритма сердца следует назначать больным в том случае, если спонтанные приступы неритмичного сердцебиения возникают не каждый день (реже чем 1—2р в неделю). При положительном диагностическом результате можно использовать этот метод для оценки профилактического действия антиаритмических препаратов (не рекомендуют проводить в амбулаторных условиях при синдроме WPW.)
Другие исследования должны быть направлены на поиск представленных выше причин возникновения ФП и проводиться строго по показаниям, с учётом жалоб, анамнеза пациента и данных клинического осмотра.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Цели:
- подтверждение связи клинических проявлений с ФП (по ЭКГ)
- выявление патологии сердечно-сосудистой системы и других органов, при которой ФП выступает лишь его осложняющим признаком.
По ЭКГ ФП необходимо дифференцировать от следующих состояний:
- выраженной синусовой аритмии (по наличию зубца Р)
- частых наджелудочковых и желудочковых экстрасистол
- трепетания предсердий (по наличию волн трепетания f)
- АВ-узловой реципрокной тахикардии (зубец Р не определяется или выявляется в конце ритмичных комплексов QRS)
- предсердной тахикардии с АВ-блокадой (наличие зубцов Р и изолинии между ними)
- миграции предсердного водителя ритма (наличие зубцов Р различной конфигурации перед комплексами QRS)
- реципрокной тахикардии с участием дополнительных путей проведения (при ортодромной тахикардии зубец Р определяется дискретно после ритмичных комплексов QRS).
ЛЕЧЕНИЕ
ЦЕЛИ ЛЕЧЕНИЯ
Основные принципы лечения ФП:
- по возможности проводят коррекцию состояния, явившегося причиной ФП
- воздействие на собственно аритмию предлагает выбор одной из двух тактик:
контроль частоты ритма желудочков на фоне ФП (т.е. отказ от проведения противоаритмического лечения) или проведение противоаритмического лечения (купирование ФП и профилактика её рецидивов)
- профилактика системных тромбоэмболии (по показаниям).
ТАКТИКА ВЕДЕНИЯ
При выявлении у больного ФП необходимо принять решение о реализации одной из четырёх лечебных стратегий:
- экстренной электрической кардиоверсии при развитии состояний, угрожающих жизни больного, связанных с ФП (острая левожелудочковая недостаточность и др.)
- ранней кардиоверсии (в течение 48ч от начала ФП, электрическая или медикаментозная) с последующей поддержкой синусового ритма
- отсроченной плановой кардиоверсии (электрическая или медикаментозная) с последующей поддержкой синусового ритма
- контроля частоты желудочкового ритма у больного с ФП без восстановления синусового ритма.
Тактика при ФП длительностью менее 48ч. При коротком единичном пароксизме ФП (спонтанное купирование или вследствие кардиоверсии) и отсутствии факторов риска повторных пароксизмов необходимости в противорецидивном лечении нет.
Больным с редкими (менее 1р за 3мс) пароксизмами ФП длительностью до 48ч, сопровождающимися минимальной клинической симптоматикой или её отсутствием, без факторов риска тромбоэмболических осложнений достаточно обеспечение медикаментозного контроля частоты желудочкового ритма во время эпизода ФП. Оптимально назначение б-адреноблокаторов и блокаторов кальциевых каналов.
При пароксизмах ФП, сопровождающихся клиническими проявлениями и длящихся менее 48ч, предпочтительно проведение ранней фармакологической или электрической кардиоверсии. Электрическую кардиоверсию проводят в стационаре.
Больным с частыми пароксизмами ФП (более 1р за 3мс), сопровождающимися клинической симптоматикой, при отсутствии органической патологии сердца показано назначение препаратов IC или III класса (табл. 61), при наличии органической патологии сердца III класса.
Тактика при ФП длительностью более 48ч. Ведение пациентов с ФП длительностью более 48ч можно разделить на 3 этапа:
- подготовка больного к кардиоверсии
- назначение необходимого обследования
- назначение лекарственных средств для контроля частоты желудочковых сокращений
- назначение антикоагулянтов
- проведение кардиоверсии (электрической или медикаментозной)
- назначение длительной (постоянной) профилактической антиаритмической терапии на фоне продолжения антикоагулянтной терапии (в течение 4нед после кардиоверсии), которая у части больных впоследствии может быть заменена на приём дезагрегантов.
Решение о проведении кардиоверсии основывают на клинических проявлениях с учётом анамнеза и обязательного анализа предшествующего опыта профилактической антиаритмической терапии. Окончательное решение о проведении электрической кардиоверсии принимает сам пациент после предоставления ему полной информации о потенциальном риске этой процедуры, связанном с наркозом, электрической травмой сердца, нормализационными эмболиями и т.д. Следует иметь в виду, что у больных с постоянной формой ФП (или с ФП неизвестной продолжительности) стратегия восстановления синусового ритма с помощью кардиоверсии (электрической или медикаментозной) всегда имеет свою альтернативу в виде стратегии лекарственного контроля частоты желудочковых сокращений в условиях сохраняющейся ФП.
Контроль частоты ритма желудочков (урежающая терапия)
Для оценки эффективности контроля чсс следует помнить о необходимости подсчёта чсс больного как в покое, так и после 20—30с ходьбы (целесообразно использование суточного холтеровского ЭКГ мониторирования). При высокой частоте желудочковых сокращений необходимо добиваться их адекватного урежения (60-80 в минуту в покое, и не более 120-130 в минуту при физической нагрузке). При стабильном состоянии больного препараты назначают внутрь в амбулаторных условиях.
Если в результате применения лекарственного средства возникло чрезмерное урежение частоты сокращений желудочков (независимо от наличия .или отсутствия соответствующей симптоматики), следует снизить дозы этих препаратов либо полностью прекратить их приём. В случае сохранения периодов брадикардии и связанных с ней клинических проявлений при невозможности дальнейшего снижения дозы больному показана имплантация электрокардиостимулятора. Только суточное холтеровское ЭКГ-мониторирование позволяет дать объективную оценку эффективности и безопасности урежающей терапии. Последнее имеет принципиальное значение, так как применение средств контроля чсс может приводить к опасной, но при этом бессимптомной брадикардии, нередко возникающей во время ночного сна.
Повышение частоты сокращений желудочков при ФП может быть обусловлено нарастанием сердечной недостаточности. В этом случае только лишь урежения сокращений желудочков недостаточно — необходима коррекция симптомов недостаточности кровообращения с использованием и других лекарственных средств.
КЛАССИФИКАЦИЯ АНТИАРИТМИЧЕСКИХ ПРЕПАРАТОВ Vaughan—Williams—Harrison
Решение о необходимости проведения профилактической антиаритмической терапии и профилактики системных тромбоэмболии основывают на конкретной клинической ситуации - частота и длительность пароксизмов ФП, наличие факторов риска тромбоэмболических осложнений (см. Антитромботическая терапия).
Таблица 61. Выбор антиаритмической терапии при профилактике рецидивов ФП (пароксизмов ФП или постоянной формы ФП после кардиоверсии).

ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Показания для экстренной госпитализации при впервые возникшей ФП:
- нестабильная гемодинамика
- существенное нарушение общего самочувствия: выраженное сердцебиение, слабость, признаки сердечной недостаточности
- высокий риск тромбоэмболических осложнений
- исключение аритмий, которые могут представлять опасность для жизни больного (например, вследствие перехода в фибрилляцию желудочков)
- необходимость экстренной кардиоверсии: инфаркт миокарда, острое нарушение мозгового кровообращения, декомпенсированная застойная сердечная недостаточность, критическая артериальная гипотензия.
Показания для плановой госпитализации:
- проведение электрической кардиоверсии при невозможности адекватного наблюдения за больным в амбулаторных условиях
- необходимость наблюдения за состоянием больного по кардиомонитору в начале терапии некоторыми антиаритмическими ЛС для предотвращения рецидива ФП
- необходимость проведения специализированных процедур: катетеризации сердца, электрофизиологического исследования, радиочастотной катетерной аблации, установки электрокардиостимулятора или имплантируемого дефибриллятора, хирургических вмешательств с целью разрушения аритмогенных зон.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
ПРЕПАРАТЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ КОНТРОЛЯ ЧАСТОТЫ РИТМА ЖЕЛУДОЧКОВ
В целях контроля частоты ритма желудочков используют лекарственные средства, угнетающие проведение в АВ-узле: дигоксин, б-адреноблокаторы, блокаторы кальциевых каналов (дилтиазем, верапамил). Выбор между ними нужно проводить с учётом особенностей действия.
Дигоксин обеспечивает урежающий эффект благодаря холиномиметическому действию и потому способен регулировать чсс только в состоянии покоя. Поэтому применение дигоксина может быть достаточным только у пожилых, малоактивных, соматически тяжелобольных. Дигоксин назначают внутрь или в/в 0,25—0,5мг однократно, затем по 0,25мг каждые 6ч до общей дозы 1,0—1,5мг. Затем переходят на поддерживающую дозу 0,125-0,375мг 1р в сутки под контролем ЭКГ.
Б-адреноблокаторы позволяют контролировать чсс как в состоянии покоя, так и при физической активности:
атенолол внутрь по 25—100мг 1—2р в сутки
бисопролол внутрь по 2,5-10мг 1р
метопролол внутрь по 50-100мг 2р
пиндолол внутрь по 5-30мг 2р
пропранолол внутрь по 10—40мг 2-4р
тимолол внутрь по 10—30мг 2р.
Высокоэффективно комбинирование б-адреноблокаторов с дигоксином.
Верапамил в/в медленно 2,5—10мг в течение 10мин однократно (при необходимости быстрого снижения чсс), или верапамил внутрь по 40—80мг 3—4р в сутки или дилтиазем внутрь по 60-180мг 2р в сутки длительно.
Предостережение
У пациентов с исходно сниженной насосной функцией сердца назначение верапамила и дилтиазема требует осторожности в силу выраженного отрицательного инотропного действия этих препаратов.
При ФП у больных с синдромом WPW верапаиил и дигоксин противопоказаны, так как способны вызвать резкое нарастание частоты ритма желудочков.
ВОССТАНОВЛЕНИЕ СИНУСОВОГО РИТМА (КАРДИОВЕРСИЯ)
Кардиоверсия может быть лекарственной и электрической.
Показания к экстренному восстановлению синусового ритма:
- выраженные нарушения гемодинамики (коллапс, отёк лёгких, шок, затянувшийся приступ стенокардии)
- инфаркт миокарда с нарушением гемодинамики
- синдром WPW.
Предпочтительна экстренная электрическая кардиоверсия.
Показания к плановому восстановлению синусового ритма:
- впервые возникший эпизод ФП
- при редких пароксизмах ФП и возможности дальнейшего медикаментозного удержания синусового ритма
- возникновение или усиление признаков хронической сердечной недостаточности, связанное с ФП
- ФП после хирургического лечения митрального стеноза (спустя не менее 2мс после операции)
- выраженная субъективная плохая переносимость аритмии (при отсутствии противопоказаний).
Относительные противопоказания к плановой кардиоверсии:
- интоксикация препаратами наперстянки или терапевтическое насыщение
- признаки синдрома слабости синусового узла в условиях синусового ритма, предшествовавшего возникновению ФП
- системные тромбоэмболии в последние 2мс
- продолжительность непрерывной ФП более 2-3лет
- данные анамнеза, указывающие на неустойчивость удержания синусового ритма после его восстановления на фоне адекватной антиаритмической терапии
- левое предсердие более 4,5см в диаметре (по данным трансторакальной эхоКГ)
- некомпенсированный тиреотоксикоз
- хроническая сердечная недостаточность на фоне тяжёлых нарушений насосной функции сердца.
Наиболее эффективными средствами лекарственной кардиоверсии служат антиаритмические препараты IA, IC и III классов:
амиодарон в/в 5мг/кг однократно медленно под контролем ЭКГ
прокаинамид в/в 500-1000мг однократно медленно под контролем ЭКГ и АД
пропафенон в/в 500-1000мкг/кг однократно медленно под контролем ЭКГ
соталол в/в 20мг однократно медленно под контролем ЭКГ и АД (при необходимости через 20мин можно повторить введение лекарственного средства в той же дозе)
хинидин (непролонгированные формы!) внутрь по 200мг через каждые 2—3ч до суммарной дозы 1000мг или до купирования пароксизма.
Чем меньше длительность пароксизма, тем выше эффективность медикаментозной кардиоверсии. При продолжительности пароксизма менее 48ч эффективность лекарственных средств варьирует от 70 до 90%, если пароксизм продолжается более 48ч 30%. Исключение составляет нибентан, эффективность которого не только при пароксизмальной, но и при постоянной форме ФП сопоставима с эффективностью электрической кардиоверсии. Введение нибентана проводят только в условиях палат и отделений интенсивной терапии.
При нарастании явлений острой сердечной недостаточности на фоне пароксизма ФП, неэффективности или невозможности проведения лекарственной кардиоверсии проводят электрическую кардиоверсию.
ПРОФИЛАКТИКА РЕЦИДИВОВ
С целью предотвращения пароксизмов ФП и поддержания синусового ритма применяют препараты IC и III классов:
лаппаконитина гидробромид внутрь по 25—50мг 3—4р в сутки
дизопирамид внутрь по 100—300мг 3—4р в сутки
прокаинамид внутрь по 500мг 3—4р в сутки
пропафенон внутрь по 150—300мг 3р в сутки
хинидин внутрь по 200-300мг 3-4р в сутки
диэтиламинопропионилэтоксикарбониламинофенотиазин внутрь по 50мг 3—4р в сутки
морацизин внутрь по 200мг 3-4р в сутки
амиодарон внутрь по 600мг 1р в сутки в 1-ю неделю, 400мг 1р в сутки во 2-ю неделю, 200мг 1р в сутки с 3-й недели
соталол внутрь по 80-160мг 2р в сутки постоянно.
В связи с имеющимся риском развития аритмогенного действия антиаритмических препаратов с позиции безопасности лечения выбор профилактического антиаритмического средства зависит в первую очередь от наличия органического поражения сердца. При снижении фракции выброса левого желудочка менее 50%, наличии постинфарктных изменений миокарда, гипертрофии миокарда более 1,4мм (по данным эхоКГ), увеличении размеров полостей желудочков в качестве антиаритмической терапии можно использовать только препараты III класса (амиодарон и соталекс). Во всех остальных случаях возможно применение лекарственных средств как I, так и III класса. Эффективно также комбинированное применение антиаритмических препаратов I класса и б-адреноблокаторов.
АНТИКОАГУЛЯНТНАЯ ТЕРАПИЯ
Профилактика системных тромбоэмболии у больных с ФП. К факторам риска, повышающим вероятность развития эндокардиального тромбоза и системных тромбоэмболии у больных с ФП, относят следующие:
- рецидивирующие затяжные (более 48ч) пароксизмы ФП и постоянная форма ФП
- ревматический порок сердца
- возраст старше 65лет
- артериальная гипертензия
- инфаркт миокарда в анамнезе
- сахарный диабет
- кардиомегалия, сниженная фракция выброса левого желудочка, застойная сердечная недостаточность,
дилатация левого предсердия (более 50 м по данным трансторакальной эхоКГ), тромбоз ушка левого предсердия или феномен спонтанного эхоконтрастирования в полости левого предсердия (по данным ЧПЭКГ).
Антикоагулянты показаны пациентам старше 65лет с затяжными (более 48ч) пароксизмами или постоянной формой ФП, а также лицам более молодого возраста, имеющим другие факторы риска развития тромбоэмболии. Антикоагулянты показаны всем больным с постоянной ФП, которым планируют проведение лекарственной или электрической кардиоверсии. Пероральные антикоагулянты должны применяться только под контролем международного нормализованного отношения (MHO).
Рекомендуемый уровень MHO:
- в отсутствие ревматического поражения сердца 2,0—3,0
- при наличии ревматического поражения сердца 3,0—4,0.
Варфарин внутрь 5-10мг/сут в 1—2приёма 2-4дня под ежедневным контролем MHO. При достижении требуемого уровня MHO переходят на длительный приём поддерживающей дозы, которая обычно составляет 2—10мг/сут и определяется индивидуально по величине MHO. При стабилизации MHO на отработанной дозе контроль свёртываемости проводят еженедельно, затем 1р в месяц.
Аценокумарол внутрь 8—12мг в 1-е сутки с последующим переходом на поддерживающую дозу 4—8мг/сут в зависимости от уровня MHO.
Фенилин внутрь 90-120мг в 1-е сутки, 90-150мг во 2-е сутки под ежедневным контролем MHO с последующим переходом на поддерживающую дозу 30-90мг/сут в зависимости от уровня MHO.
Ацетилсалициловая кислота внутрь 300мг/сут после еды. Ацетилсалициловую кислоту можно применять у лиц моложе 65лет, не имеющих факторов риска развития тромбоэмболии, а также при наличии противопоказаний к использованию антикоагулянтов.
ПРОФИЛАКТИКА СИСТЕМНЫХ ТРОМБОЭМБОЛИИ ПОСЛЕ НОРМАЛИЗАЦИИ РИТМА СЕРДЦА
Риск развития системных эмболии особенно высок у больных с затяжными эпизодами ФП более 48ч или постоянной формой ФП, которым проводят плановую кардиоверсию (лекарственную или электрическую). Этот показатель может превышать 5% в отсутствие антикоагулянтной подготовки и сохраняться на протяжении 1мс после восстановления синусового ритма. Причиной тому служит феномен «оглушённых предсердий», которые, несмотря на восстановленную нормальную электрическую активность, практически не сокращаются и длительное время не восстанавливают свою насосную функцию. В результате могут развиться тромбоз ушек предсердий и эмболия. Считается, что причиной этого явления служит длительная ФП и, возможно, электротравма при электрической кардиоверсии. В связи с этим антикоагулянты нужно применять в течение минимум 3нд до кардиоверсии и 4нд после неё.
Варфарин внутрь 5-10мг/сут в 1-2приёма 2-4дня под ежедневным контролем MHO. При достижении требуемого уровня MHO переходят на длительный приём поддерживающей дозы, которая обычно составляет 2—10мг/сут и определяется индивидуально по величине MHO. При стабилизации MHO на отработанной дозе контроль свёртываемости проводят еженедельно, затем 1р в месяц.
Аценокумарол внутрь 8-12 мг в 1-е сутки с последующим переходом на поддерживающую дозу 4-8мг/сут в зависимости от уровня MHO.
Фенилин внутрь 90-120мг в 1-е сутки, 90-150мг во 2-е сутки под ежедневным контролем MHO с последующим переходом на поддерживающую дозу 30-90мг/сут в зависимости от уровня MHO.
Длительность применения антикоагулянтов перед кардиоверсией может быть существенно сокращена у значительной части больных при наличии данных ЧПЭКГ, исключающих наличие тромбоза ушек предсердий. В таких случаях кардиоверсию можно проводить через 3-5дней после достижения стабильного уровня MHO от 2,0 до 3,0 на фоне применения пероральных антикоагулянтов либо на фоне использования гепарина в/в в дозе, обеспечивающей сдвиг тромбопластинового времени в 1,5—2 раза относительно контрольных значений.
При наличии тромбоза ушек предсердий по данным ЧПЭКГ решение о возможности проведения кардиоверсии принимают только после проведения антикоагулянтной терапии на протяжении минимум 6нд с обязательным повторением ЧПЭКГ для подтверждения достигнутого лизиса тромба. Лизирование тромба в ряде случаев требует нескольких месяцев постоянного применения антикоагулянтов и достигается не во всех случаях.
ВОССТАНОВЛЕНИЕ СИНУСОВОГО РИТМА С ПОМОЩЬЮ ЛЕКАРСТВЕННЫХ СРЕДСТВ
ВЫБОР АНТИАРИТМИЧЕСКОГО ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Амиодарон — препарат выбора у больных с ИБС, в том числе переживших инфаркт миокарда с дисфункцией левого желудочка (при снижении фракции выброса левого желудочка), с другими формами органической патологии сердца, приводящей к снижению насосной функции сердца и развитию недостаточности кровообращения. Амиодарон по сравнению с другими средствами антиаритмической терапии характеризуется минимальной частотой развития аритмогенного действия.
Пропафенон. Его назначения следует избегать у больных с ИБС, особенно после перенесённого инфаркта миокарда, а также при других видах сердечно-сосудистой патологии, протекающей с дисфункцией левого желудочка (фракция выброса менее 40%). Необходима осторожность в использовании этого препарата у лиц с анамнезом устойчивых пароксизмов желудочковой тахикардии. Осложнения в виде тахикардии типа «torsade de pointes» редко возникают при использовании пропафенона. Тем не менее, как и при использовании других антиаритмических препаратов I класса, применение пропафенона может сопровождаться развитием тяжёлых и угрожающих жизни тахиаритмий: трепетания предсердий с проведением 1:1, мономорфной желудочковой тахикардии с высокой чсс и риском трансформации в фибрилляцию желудочков. Всё это делает необходимым кардиомониторный контроль за применением пропафенона.
Прокаинамид — высокоэффективное средство устранения ФП, в том числе у больных с синдромом WPW. Ограничения к применению и контроль за безопасностью использования такие же, как и у пропафенона.
Хинидин. Применяют только внутрь, поэтому восстановление синусового ритма может произойти через несколько дней приёма лекарственного средства. Ограничение к применению и контроль за безопасностью использования такие же, как для пропафенона и прокаинамида. Особое значение имеет наблюдение за динамикой (увеличением) интервала Q-T на ЭКГ.
Соталол сравним по эффективности с хинидином, но реже вызывает аритмогенные и другие побочные эффекты. Хорошо контролирует чсс благодаря сопутствующей б-адреноблокирующей активности.
Нибентан — препарат III класса, который можно использовать у больных с ИБС, в том числе после перенесённого инфаркта миокарда. Учитывая возможность развития осложнения в виде тахикардии типа «torsade de pointes», вводить нибентан можно только в условия палаты интенсивной терапии.
Дигоксин не следует назначать для восстановления синусового ритма у больных с ФП, так как его эффективность не выше, чем у плацебо.
Блокаторы кальциевых каналов (верапамил и дилтиазем) неэффективны как средства восстановления синусового ритма.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Хирургическую аблацию (разрушение аритмогенных зон) рекомендуют в следующих ситуациях:
- пациенту проводят хирургическое вмешательство по поводу порока сердца или ИБС
- при тромбозе левого предсердия, рефрактерном к тромболитической терапии, несмотря на предшествующую терапию антикоагулянтами.
Радиочастотную катетерную аблацию рекомендуют при рецидивирующей пароксизмальной ФП.
ОБУЧЕНИЕ ПАЦИЕНТА
Больному с ФП следует разъяснить суть патологического процесса, рассказать об ожидаемом эффекте проводимого лечения, побочных эффектах лекарственных средств, а также о чрезвычайной важности тщательного соблюдения режима приёма лекарственных средств (необходимо стремиться к достижению высокой приверженности больного к лечению).
В ходе бесед следует разъяснить больному, что ФП — форма нарушений ритма сердца, характеризующаяся хроническим течением, которая может потребовать длительного лечения, в том числе в течение всей жизни. Разъясняют, что ожидаемые эффекты от проводимого лечения в случае назначения антиаритмической терапии при пароксизмальной ФП или после успешной кардиоверсии у больных с постоянной ФП. Особый акцент необходимо сделать на том, что лекарственная терапия направлена на уменьшение риска рецидивирования ФП, снижение частоты эпизодов аритмии, возникновение которых, однако, возможно. Разъясняют, что при назначении терапии, контролирующей (урежающей) чсс при постоянной форме ФП, цель лечения заключается в урежении ЧСС в определённых пределах, в связи с чем важно объяснить больному, что неритмичность работы сердца будет сохраняться, и обучить его, как считать чсс в условиях неритмичного пульса. Указывают, что любые изменения в самочувствии необходимо фиксировать: эпизоды сердцебиения, головокружения, ухудшение переносимости нагрузок (постепенное или внезапное), образование синяков, склонность к кровоточивости (признак избыточной антикоагуляции). Нужно обязательно разъяснять больному цель при назначении любого лекарственного средства: например, варфарин необходим только для профилактики инсульта и других тромбоэмболии, при этом он не оказывает никакого влияния на клинические проявления, характер течения собственно ФП и частоту возникновения пароксизмов. Больного следует ознакомить с вероятными побочными эффектами назначенных лекарственных средств с учётом его индивидуальных особенностей. Необходимо ограничить употребление кофе, крепкого чая, приём алкоголя и исключить курение.
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ
Задачи врачебного наблюдения включают оценку эффективности проводимой терапии, её коррекцию, а также определение приверженности больного к лечению.
Постоянная ФП с медикаментозным контролем ЧСС.
Врачебный контроль каждые 3—6мс, при необходимости чаще. При сборе анамнеза следует уточнить, насколько легко больной переносит физическую нагрузку, нет ли повышенной утомляемости, не возникает ли одышка, наличие жалоб, характерных для сердечной недостаточности, при артериальной гипертензии оцените профиль АД по дневнику больного, жалобы и проявления неврологического дефицита, при необходимости направьте больного на консультацию невролога. ЧСС и пульс подсчитывают в течение 60с, при постоянной форме ФП также через 20—30с ходьбы (чсс не должна превышать 80 в покое и 120 в минуту после нагрузки). Уточняют наличие отёков, оценивают размеры печени, границы сердца, исключают (или подтверждают) наличие других признаков сердечной недостаточности.
При длительной терапии варфарином следует регулярно и длительно контролировать MHO (необходимый уровень 2,0-3,0 при отсутствии порока сердца и протезов клапанов, 3,0-4,0 при их наличии). При стабильном состоянии и адекватно подобранной дозе контроль MHO необходим 1р в месяц.
Дополнительно - ЭКГ и суточное ЭКГ-мониторирование каждые 3-6мс, при необходимости чаще, оценка наличия или отсутствия ожидаемых побочных эффектов назначенных препаратов.
Медикаментозное поддержание синусового ритма.
Врачебный контроль каждые 3—6 мес, при необходимости чаще. Следует расспрашивать о наличии жалоб, характерных для эпизода ФП или неврологического дефицита вследствие вероятных тромбоэмболических осложнений. Определение MHO при лечении варфарином. Побочные эффекты антиаритмических средств, особенно влияние на функцию синусового узла — возможны хронотропная недостаточность, снижение толерантности к физической нагрузке и синкопальные эпизоды как проявления дисфункции синусового узла. ЭКГ — на начальных этапах антиаритмической терапии её проводят каждые 2-4нд. При назначении антиаритмических лекарственных средств IA и III классов оценивают динамику длительности интервала Q-T и комплекса QRS. При использовании препаратов класса IA и IC уширение комплекса QRS (более чем на 20% от исходного или более 120мс) может быть сопряжено с вероятностью возникновения желудочковых аритмий. Один раз в 3-6мс проводят амбулаторное мониторирование ЭКГ с целью выявления бессимптомных пароксизмов ФП (они возникают в 12 раз чаще симптоматичных), а также оценивают влияние антиаритмических препаратов на функцию синусового узла и проводящую систему сердца.
При пароксизмах, возникающих реже 1р в месяц, профилактической антиаритмической терапии не назначается. Лечение ограничивают проведением купирующих мероприятий.
Особые ситуации. Лечение амиодароном в отдельных случаях может вызвать серьёзные несердечные побочные эффекты, поэтому в поле зрения терапевта должны быть состояние роговицы глаз, щитовидная железа, печень, лёгкие, пигментация кожи. Необходимо проводить расспрос пациента (кашель, одышка при нагрузке), осмотр (признаки пигментного фотодерматоза), рентгенографию органов грудной клетки (ежегодно), осмотр окулиста (каждые 6мс), функциональные пробы печени (каждые 6мс), оценку функций щитовидной железы (УЗИ, гормоны каждые 6мс).
При отсутствии контроля за частотой ритма желудочков и проведения профилактики системных тромбоэмболии у больных с заболеваниями сердечно-сосудистой системы относительный риск смерти увеличивается в 2 раза после возникновения хронической ФП. Основное осложнение ФП, приводящее к летальному исходу — кардиоэмболический инсульт. Ежегодный риск инсульта составляет 5% у больных с ФП без клапанной патологии сердца. Риск инсульта и других системных тромбоэмболии особенно высок у лиц старше 75лет.
ТРЕПЕТАНИЕ ПРЕДСЕРДИЙ
Трепетание предсердий ТП — разновидность наджелудочковых аритмий, в основе которых лежит механизм повторного входа волны возбуждения внутри предсердий по анатомически определенному пути (reentry).
КЛАССИФИКАЦИЯ
- трепетание предсердий I типа (частота волн от 240 до 340 в минуту)
- трепетание предсердий II типа (частота волн от 340 до 430 в минуту).
При ТП I типа может быть эффективна радиочастотная катетерная аблация (деструкция). В остальном диагностика, выбор стратегии и тактики лечения и наблюдения пациентов такие же, как и при фибрилляции предсердий.
НАДЖЕЛУДОЧКОВЫЕ (СУПРАВЕНТРИКУЛЯРНЫЕ) АРИТМИИ
Наджелудочковыми (суправентрикулярными) аритмиями называют нарушения сердечного ритма, источники которых могут располагаться в синусовом узле, предсердиях, атриовентрикулярном АВ узле или общем стволе пучка Гиса. Они могут быть представлены в виде единичных преждевременных импульсов (наджелудочковая экстрасистолия), в виде эпизодов тахикардии различного происхождения (синусового, предсердного, в том числе фибрилляция и трепетание предсердий), а также в виде постоянного патологического суправентрикулярного ритма.
КОДЫ МКБ-10
I47.1 Наджелудочковая тахикардия
I47.9 Пароксизмальная тахикардия неуточнённая
I49.1 Преждевременная деполяризация предсердий
I49.2 Преждевременная деполяризация, исходящая из АВ-соединения.
СИНУСОВАЯ ТАХИКАРДИЯI
О синусовой тахикардии СТ говорят при чсс более 100 в минуту в состоянии покоя.
ЭПИДЕМИОЛОГИЯ
Распространённость высокая в любом возрасте. СТ встречают у здоровых людей и у лиц с различными сердечными и несердечными заболеваниями.
ПРОФИЛАКТИКА
Исключение преходящих факторов, влияющих на возникновение СТ. Адекватное лечение различной патологии, способной обусловить возникновение СТ (см. Этиология).
СКРИНИНГ
ЭКГ. Больные могут ощущать ритмичное сердцебиение. Физиологическая СТ почти всегда протекает бессимптомно.
КЛАССИФИКАЦИЯ
Физиологическая СТ: у детей младшего возраста, у взрослых лиц при физической и эмоциональной нагрузке.
Патологическая СТ: при различных патологических состояниях (см. Этиология).
Пароксизмальная синусовая тахикардия.
ЭТИОЛОГИЯ
Физиологическую СТ отмечают:
- у детей младшего возраста
- при физической и эмоциональной нагрузке у взрослых.
Патологическая СТ возникает на фоне:
- лихорадочных состояний
- гипертиреоза
- анемии
- гипоксии
- сердечной недостаточности
- шока
- дыхательной недостаточности
- гиперкинетического синдрома (повышение активности симпатической нервной системы, приводящее к тахикардии с резким возрастанием чсс при нагрузке, систолической артериальной гипертензии)
- чрезмерного употребления алкоголя, кофе, чая
- приёма симпатомиметиков, производных атропина (например, ипратропия бромида при хронической обструктивной болезни лёгких).
ДИАГНОСТИКА
Цели диагностики следующие: установление диагноза собственно СТ, её связь с возможными патологическими причинами.
СТ может протекать бессимптомно, и её выявляют случайно — при аускультации сердца во время профилактического осмотра врача и последующей записи ЭКГ.
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
ЖАЛОБЫ И АНАМНЕЗ
В значительной части случаев клинические проявления СТ могут отсутствовать. Пациентов может беспокоить сердцебиение. Следует уточнить:
- длительность эпизодов перебоев
- провоцирующие факторы - физическая и эмоциональная нагрузка, приём пищи, употребление алкоголя, кофеинсодержащих продуктов (кофе, чай, тонизирующие газированные напитки), симпатомиметиков и др., переносимость перебоев в работе сердца и сопутствующие им симптомы (одышка, боли в грудной клетке стенокардитического характера, подъём или снижение артериального давления, толерантность к физической нагрузке, головокружение и т.д.), в какое время суток обычно появляются симптомы, опыт использования лекарственной терапии с целью облегчения состояния, её эффективность, выполнение больным врачебных рекомендаций.
Необходимо выяснение жалоб и анамнеза для уточнения возможного наличия сопутствующих заболеваний и вероятной причины СТ.
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Проводится по стандартной схеме. Основным клиническим признаком СТ служит чсс во время аускультации и при подсчёте пульса на лучевой артерии — более 100 в минуту. Физикальное обследование пациентов также должно быть направлено на выявление симптомов заболевания сердечно-сосудистой системы и других органов как возможной причины, возникновения СТ.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Общий анализ крови (для выявления или исключения анемии, признаков воспаления и т.д.).
Гормоны щитовидной железы и ТТГ. У пожилых больных повышение уровня ТТГ может быть единственным лабораторным признаком скрытого тиреотоксикоза.
Лабораторные маркёры хронического злоупотребления алкоголем, в первую очередь повышение гамма-глютамилтранспептидазы.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
ЭКГ — зубцы Р перед каждым комплексом QRS синусового происхождения, чсс более 100 в минуту в покое.
Суточное (по Холтеру) мониторирование ЭКГ проводят при необходимости уточнения длительности СТ, её связи с физической нагрузкой, оценки ритма в ночное время, а также для контроля ритма и на фоне проведения лечения.
ЭхоКГ: выявление или исключение признаков патологии сердца (наличие зон нарушенной сократимости миокарда, изменения клапанов, пороки развития, изменения размеров камер сердца и т.д.), способной приводить к возникновению СТ.
УЗИ щитовидной железы — для исключения структурной патологии щитовидной железы.
Остальные исследования должны быть направлены на поиск представленных выше причин возникновения СТ и проводиться строго по показаниям, на основании жалоб, анамнеза пациента и клинического осмотра.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Цель — подтверждение связи возникающих клинических проявлений именно с СТ (по ЭКГ).
Дифференциальной диагностики чаще всего не требуется. По ЭКГ СТ в редких случаях необходимо дифференцировать от следующих состояний:
- ритмичной фибрилляции предсердий или трепетания предсердий (по морфологии зубца Р)
- АВ-узловой реципрокной тахикардии (зубец Р не определяется или выявляется в конце комплекса QRS)
- предсердной тахикардии (зубцы Р перед комплексом QRS имеют морфологию, отличающуюся от синусового ритма)
- реципрокной ортодромной тахикардии с участием дополнительных путей проведения (при ортодромной тахикардии ретроградный, инвертированный зубец Р определяется после комплекса QRS).
ЛЕЧЕНИЕ
ЦЕЛИ ЛЕЧЕНИЯ
По возможности проводят коррекцию состояния, явившегося причиной СТ.
Воздействие на собственно аритмию.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Госпитализации по поводу физиологической СТ не требуется. При патологической СТ показания к госпитализации определяются основным заболеванием.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
При физиологической СТ лечения не требуется.
При патологической тахикардии, вызванной анемией, гипертиреозом, гиповолемией и т.д., необходимо устранение причины СТ. В противном случае лечение, направленное на уменьшение чсс, может привести к резкому снижению АД и усугублению гемодинамических расстройств (например, при гиповолемии или СН).
В случае, если СТ проявляет себя как патогенетический фактор, вызывая стенокардию, сердечную недостаточность, а также при гиперкинетическом синдроме и гипертиреозе используют б-адреноблокаторы, а при наличии противопоказаний к ним блокаторы кальциевых каналов (верапамил, дилтиазем):
атенолол внутрь по 25-100мг 1-2р в сутки
бисопролол внутрь по 2,5—10мг 1р в сутки
метопролол внутрь по 50-100мг 2р в сутки
пиндолол внутрь по 5-30мг 2р в сутки
пропранолол внутрь по 10-40мг 2-4р в сутки
тимолол внутрь по 10-30мг 2р в сутки
эсмолол в/в 500мкг/кг/мин в течение 4мин, затем 50—300мкг/кг/мин (скорость введения зависит от чсс) в случае гемодинамически значимой тахикардии
верапамил в/в медленно 2,5-5мг в случае гемодинамически значимой тахикардии
верапамил внутрь по 40-80мг 3-4р в сутки
дилтиазем внутрь по 60-180мг 2р в сутки.
Об эффективности лечения свидетельствуют нормализация чсс, отсутствие приступов стенокардии и признаков сердечной недостаточности.
ОБУЧЕНИЕ ПАЦИЕНТА
Пациенту с СТ следует разъяснить суть данного нарушения ритма, рассказать об ожидаемом эффекте проводимого лечения, побочных эффектах лекарственных средств, а также о чрезвычайной важности тщательного соблюдения режима жизни и приёма лекарственных средств. В ходе бесед следует обязательно разъяснить больному, что СТ не опасна, для жизни.
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ
Диспансерного наблюдения непосредственно по поводу СТ не требуется.
ПРОГНОЗ
При адекватном лечении причины СТ благоприятный.
НАДЖЕЛУДОЧКОВАЯ ЭКСТРАСИСТОЛИЯ
Наджелудочковые экстрасистолы НЖЭС — преждевременные эктопические импульсы (электрокардиографические комплексы), одиночные, парные и групповые, с расположением источника в предсердиях и АВ-соединении.
ЭПИДЕМИОЛОГИЯ
Единичные НЖЭС когда-либо возникают у всех людей. НЖЭС нередко сопровождают течение различных заболеваний сердца (миокардиты, кар-диомиопатии, ИБС и т.д.).
ПРОФИЛАКТИКА
Профилактика НЖЭС заключается в исключении преходящих факторов, влияющих на возникновение НЖЭС. Необходимо также адекватное лечение различной патологии, способной обусловить возникновение экстрасистолии (см. Этиология).
СКРИНИНГ
ЭКГ. Большинство больных ощущают наличие перебоев в работе сердца.
КЛАССИФИКАЦИЯ
По происхождению:
- предсердная
- АВ-узловая.
НЖЭС могут быть одиночными и парными.
ЭТИОЛОГИЯ
Преходящие факторы:
- физическая и эмоциональная нагрузка
- повышенное утомление
- приём алкоголя
- курение
- злоупотребление кофеинсодержащими напитками.
Органические заболевания сердца:
- ИБС, в том числе инфаркт миокарда
- артериальная гипертензия
- кардиомиопатии
- хронический миокардит
- сердечная недостаточность
- пороки сердца.
Несердечные заболевания и патологические состояния:
- гипокалиемия (в том числе при лечении диуретиками)
- приём лекарственных препаратов (сердечных гликозидов, симпатомиметиков, антиаритмических лекарственных средств, трициклических антидепрессантов)
- различные эндокринные заболевания (прежде всего гипертиреоз, феохромоцитома)
- желчекаменная болезнь.
Идиопатическая - до 40% пациентов с НЖЭС не имеют признаков заболевания сердечно-сосудистой системы и других органов как причины развития этой аритмии.
ДИАГНОСТИКА
Цели диагностики заключаются в установлении диагноза собственно НЖЭС, её связи с возможными патологическими причинами.
НЖЭС может протекать бессимптомно. В таких случаях её выявляют случайно во время профилактического осмотра и последующей записи ЭКГ.
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
ЖАЛОБЫ И АНАМНЕЗ
В значительной части случаев клинические проявления НЖЭС могут отсутствовать. Чаще всего пациентов беспокоят перебои в работе сердца. Следует уточнить длительность эпизодов перебоев, провоцирующие факторы — физическая и эмоциональная нагрузка, приём пищи, употребление алкоголя, кофеинсодержащих продуктов (кофе, чай, тонизирующие газированные напитки), симпатомиметиков и др., переносимость перебоев в работе сердца и сопутствующие им симптомы (одышка, боли в грудной клетке стенокардитического характера, подъём или снижение артериального давления, толерантность к физической нагрузке, головокружение и т.д.), в какое время суток обычно появляются симптомы, опыт использования лекарственной терапии с целью облегчения состояния, её эффективность, выполнение больным врачебных рекомендаций.
Выяснение жалоб и анамнеза для уточнения наличия сопутствующих заболеваний и вероятной причины НЖЭС.
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Проводится по стандартной схеме. Основным неспецифическим клиническим признаком НЖЭС служит неритмичность ЧСС во время аускультации и при подсчёте пульса на лучевой артерии. Физикальное обследование пациентов также должно быть направлено на выявление симптомов заболевания сердечно-сосудистой системы и других органов как возможной причины возникновения НЖЭС.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Биохимический анализ крови (для выявления гипокалиемии, гипомагниемии и т.д.).
Гормоны щитовидной железы и ТТГ. У пожилых больных повышение уровня ТТГ может быть единственным лабораторным признаком скрытого тиреотоксикоза.
Лабораторные маркеры хронического злоупотребления алкоголем, в первую очередь повышение гамма-глютамилтранспептидазы.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
ЭКГ — зубцы Р несинусового происхождения перед преждевременным комплексом QRS.
Суточное мониторирование ЭКГ назначают больным для уточнения количества НЖЭС, их связи с физической нагрузкой, суточного распределения, для оценки разброса частоты синусового ритма, а также для контроля результатов на фоне проводимого лечения.
ЭхоКГ: выявление признаков патологии мышцы и клапанов сердца (зоны нарушенной сократимости миокарда, изменения клапанов, пороки развития, размеры полостей сердца, в первую очередь предсердий).
УЗИ щитовидной железы — для исключения структурной патологии щитовидной железы.
Другие исследования должны быть направлены на поиск представленных выше причин возникновения НЖЭС и проводиться строго по показаниям, исходя из жалоб, анамнеза и клинического осмотра пациента.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Целью является подтверждение связи возникающих клинических проявлений именно с НЖЭС (по ЭКГ).
Дифференциальная диагностика чаще всего не требуется.
По ЭКГ НЖЭС в редких случаях необходимо дифференцировать от следующих состояний:
- фибрилляции предсердий или трепетания предсердий (по морфологии зубца Р)
- наджелудочковой тахикардии с АВ-блокадой (наличие зубцов Р и изолинии между ними)
- желудочковой экстрасистолии (при аберрантных наджелудочковых комплексах) по отсутствию или наличию зубцов Р и их связи с комплексами QRS.
ЛЕЧЕНИЕ
ЦЕЛИ ЛЕЧЕНИЯ
Основные принципы лечения НЖЭС:
- по возможности проводят коррекцию преходящих состояний, явившихся причиной НЖЭС (если таковые имеются)
- лечение основного заболевания сердечно-сосудистой системы (коррекция уровня артериального давления, проявлений коронарной недостаточности, недостаточности кровообращения и т.д.)
- воздействие на собственно аритмию.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Показания к госпитализации определяются состояниями, явившимися причиной НЖЭС.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
В отсутствие клинических проявлений НЖЭС не требует лечения.
При НЖЭС, развившейся на фоне болезни сердца или несердечного заболевания, необходима терапия основного заболевания или состояния (лечение эндокринных расстройств, коррекция электролитного баланса, лечение ИБС или миокардита, отмена лекарственных средств, способных вызвать аритмию, отказ от алкоголя, курения, избыточного потребления кофе).
При НЖЭС, ухудшающей самочувствие пациентов в отсутствие органической патологии сердца, в качестве лекарственных средств выбора назначают б-адреноблокаторы:
атенолол внутрь по 25-100мг 1-2р в сутки
бисопролол внутрь по 2,5—10мг 1р в сутки
метопролол внутрь по 50—100мг 2р в сутки
пиндолол внутрь по 5-30мг 2р в сутки
пропранолол внутрь по 10-40мг 2-4р в сутки
тимолол внутрь по 10-30мг 2р в сутки длительно или до устранения причины НЖЭС.
При наличии противопоказаний к приёму б-адреноблокаторов в качестве альтернативных средств назначают блокаторы кальциевых каналов:
верапамил внутрь по 40-80мг 3—4р в сутки
дилтиазем внутрь по 60-180мг 2р в сутки длительно или до устранения причины НЖЭС.
Реже в таких случаях назначают антиаритмические препараты IA и IC классов:
лаппаконитина гидробромид внутрь по 25-50мг 3-4р в сутки
постоянно длительно или до устранения причины НЖЭС), или
дизопирамид внутрь по 100-300мг 3-4р в сутки
прокаинамид внутрь по 500мг 3—4р в сутки
пропафенон внутрь по 150-300мг 3р в сутки
хинидин внутрь по 200-300мг 3—4р в сутки
диэтиламинопропионилэтоксикарбониламинофенотиазин внутрь по 50мг 3-4р в сутки
морацизин внутрь по 200мг 3-4р в сутки постоянно длительно или до устранения причины НЖЭС.
Не стоит использовать препараты IA и IC классов в лечении пациентов с НЖЭС, как и с другими формами аритмий сердца; у больных, перенёсших инфаркт миокарда, а также при прочих видах органического поражения сердца (особенно протекающего со снижением сократительной функции и гипертрофии миокарда левого желудочка). Это связано с высоким риском проаритмического действия лекарственных средств и, как следствие, ухудшения прогноза жизни у данной категории больных.
ОБУЧЕНИЕ ПАЦИЕНТА
Пациенту с НЖЭС следует разъяснить суть данного нарушения ритма, рассказать об ожидаемом эффекте проводимого лечения, побочных эффектах лекарственных средств, а также о чрезвычайной важности тщательного соблюдения режима жизни и приёма препаратов. В ходе бесед следует обязательно разъяснить больному, что НЖЭС не опасны для жизни.
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ
Диспансерное наблюдение необходимо в тех случаях, когда НЖЭС служит симптомом сердечного или несердечного заболевания, и должно выполняться в рамках требований к проведению наблюдения за пациентами с соответствующими видами патологии.
Назначение антиаритмической терапии больным с НЖЭС требует отдельного контроля, включающего в себя, помимо периодического осмотра, ЭКГ, суточное мониторирование ЭКГ, эхоКГ 1р в год.
ПРОГНОЗ
НЖЭС самостоятельного значения для прогноза жизни пациентов не имеет. Последний определяется характером основного заболевания (если таковое имеется), послужившего причиной возникновения НЖЭС. В ряде случаев у больных с НЖЭС может возникнуть фибрилляция предсердий, появление которой также в значительной степени определяется основным заболеванием.
ПАРОКСИЗМАЛЬНАЯ АВ-УЗЛОВАЯ РЕЦИПРОКНАЯ ТАХИКАРДИЯ
Пароксизмальная АВ-узловая реципрокная тахикардия ПАВУРТ — пароксизмальная наджелудочковая тахикардия, возникающая на основе врождённой аномалии проводящей системы сердца — продольной диссоциации (разделения) АВ-узла.
ЭПИДЕМИОЛОГИЯ
Наиболее часто встречающаяся среди всех форм наджелудочковых пароксизмальных тахикардии (около 60% случаев).
ПРОФИЛАКТИКА
Специфической профилактики не существует.
СКРИНИНГ
ЭКГ во время приступа ритмичного сердцебиения, которое ощущают практически все пациенты с ПАВУРТ.
ЭТИОЛОГИЯ
ПАВУРТ возникает у лиц, не имеющих заболевания сердца, нередко в молодом и даже детском возрасте. Тахикардия развивается на основе врождённой аномалии проводящей системы сердца — продольной диссоциации АВ-узла (наличие в АВ-узле двух путей проведения — а и б, отличающихся друг от друга свойствами проведения электрического импульса). Это создаёт условия для возникновения в АВ-узле феномена повторного входа волны возбуждения reentry как механизма тахикардии.
ДИАГНОСТИКА
Цель диагностики — установление диагноза собственно ПАВУРТ, а также выявление связи клинической симптоматики с данным нарушением ритма сердца.
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
ЖАЛОБЫ И АНАМНЕЗ
У пациентов с ПАВУРТ наиболее часто распространены жалобы на чувство ритмичного сердцебиения, внезапно начинающегося и так же внезапно заканчивающегося. Следует уточнить длительность эпизодов перебоев, провоцирующие факторы, если таковые имеются, переносимость приступов сердцебиения и сопутствующие им симптомы (одышка, боли в грудной клетке стенокардитического характера, подъём или снижение артериального давления, толерантность к физической нагрузке, головокружение и т.д.),
в какое время суток обычно появляются симптомы, опыт использования «вагусных» проб (натуживание, вызывание рвотного рефлекса и т.п.) или лекарственной терапии с целью прерывания приступа сердцебиения, опыт использования лекарственных средств с профилактической целью.
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Основным клиническим признаком ПАВУРТ служит ритмичность чсс во время приступа при аускультации и при подсчёте пульса на лучевой артерии. Физикальное обследование пациентов проводят по стандартной схеме.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
ЭКГ: на электрокардиограмме выявляют тахикардию с узкими комплексами QRS при чсс 140-180 в минуту (иногда и более). Зубцы Р не идентифицируются. В момент развития приступа регистрируется резкое удлинение в 2-3 раза интервала P—Q — феномен «скачка».
Чреспищеводная электростимуляция: проводят для дифференциальной, диагностики ПАВУРТ с другими видами СТ.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальная диагностика требуется с реципрокными тахикардия-и при синдроме Вольфа—Паркинсона-Уайта WPW, с пароксизмальной предсердной тахикардией, с правильной формой трепетания предсердий.
ЛЕЧЕНИЕ
ЦЕЛИ ЛЕЧЕНИЯ
Основные принципы лечения ПАВУРТ:
- купирование приступа тахикардии
- предупреждение пароксизмов реципрокной тахикардии.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Госпитализация показана при нестабильной гемодинамике и частом рецидивировании ПАВУРТ.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Купирование приступа ПАВУРТ
В случае острых нарушений гемодинамики необходима неотложная электрическая кардиоверсия.
В отсутствие тяжёлых нарушений гемодинамики синусовый ритм может быть восстановлен с помощью вагусных проб: пробы Вальсальвы, пробы Ашнера, умывания ледяной водой, попытки вызвать рвотный рефлекс. При неэффективности этих мер проводят медикаментозное купирование пароксизма. С целью прекращения приступа используют:
аденозина фосфат АТФ в/в 36мг быстро, в отсутствие эффекта через 3мин 6-12мг
верапамил в/в 5-10мг медленно (в течение 10мин).
В отсутствие эффекта:
прокаинамид в/в медленно 500-1000мг однократно
пропафенон в/в медленно 500—1000мкг/кг однократно.
Пароксизм может быть купирован с помощью чреспищеводной электростимуляции.
Предупреждение приступов ПАВУРТ
При редких пароксизмах, протекающих без нарушений гемодинамики, можно ограничиться только средствами купирования.
При частых пароксизмах, особенно сопровождающихся расстройствами гемодинамики, целесообразна радиочастотная катетерная деструкция (аблация).
При частых пароксизмах возможен профилактический приём препаратов, угнетающих проведение в АВ-узле:
верапамила внутрь по 40-80мг 3—4р в сутки
дилтиазема внутрь по 60—180мг 2р в сутки
атенолола внутрь по 25-100мг 1-2р в сутки
бисопролола внутрь по 2,5—10мг 1р в сутки
метопролола внутрь по 50-100мг 2р в сутки
пиндолола внутрь по 5-30мг 2р в сутки
пропранолола внутрь по 10—40мг 2—4р в сутки
тимолола внутрь по 10-30мг 2р в сутки длительно.
В случае отсутствия у пациента органической патологии миокарда (признаки перенесённого инфаркта миокарда, сниженной фракции выброса левого желудочка, гипертрофии миокарда желудочков и т.д.) возможно применение лекарственных средств I класса:
диэтиламинопропионилэтоксикарбониламинофенотиазина внутрь по 50мг 3-4р в сутки
морацизина внутрь по 200мг 3—4р в сутки
лаппаконитина гидробромида внутрь по 25—50мг 3-4р в сутки постоянно, длительно, или
прокаинамида внутрь по 500мг 3-4р в сутки
пропафенона внутрь по 150—300мг 3р в сутки
дизопирамида внутрь по 100—300мг 3-4р в сутки
хинидина внутрь по 200-300мг 3-4р в сутки постоянно длительно.
Оценка эффективности проводимого лечения — успешное купирование тахикардии и профилактика рецидивов.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
При частых пароксизмах, особенно сопровождающихся расстройствами гемодинамики, целесообразна радиочастотная катетерная деструкция (аблация).
ОБУЧЕНИЕ ПАЦИЕНТА
Пациенту с ПАВУРТ следует разъяснить суть данного нарушения ритма, рассказать о том, что такие приступы тахикардии не опасны для жизни.
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ
При необходимости лечения ПАВУРТ желательно наблюдение для оценки необходимости и эффективности проводимой терапии. Оно должно включать в себя опрос, осмотр пациента при каждом посещении, ЭКГ 1— 2р в 3мс, суточное мониторирование ЭКГ и эхоКГ 1р в год либо, при необходимости, изменение антиаритмической терапии.
ПРОГНОЗ
Прогноз благоприятный.
СИНДРОМ ВОЛЬФА-ПАРКИНСОНА-УАЙТА WPW
Синдром WPW — сочетание электрокардиографического феномена преждевременного возбуждения желудочков (укорочение интервала Р—Q, расширение желудочкового комплекса за счёт дельта-волны на восходящем колене зубца) и возникновения пароксизмальных наджелудочковых тахикардии НЖТ и/или мерцания и трепетания предсердий.
КОД МКБ-10
I45.6 Синдром преждевременного возбуждения.
ЭПИДЕМИОЛОГИЯ
Феномен WPW (наличие дельта-волны и укороченного РQ) на ЭКГ обнаруживают у 0,2-0,4% населения. При этом пароксизмы тахикардии (синдром WPW) возникают у 75% лиц, имеющих феномен WPW. В 80% таких случаев регистрируют реципрокные тахикардии, в 15-30% фибрилляцию предсердий, в 5% трепетание предсердий.
ПРОФИЛАКТИКА
Специфической профилактики не существует.
СКРИНИНГ
ЭКГ — выявляет феномен WPW.
ЭТИОЛОГИЯ
Синдром WPW возникает на основе врождённой аномалии проводящей системы сердца и обычно проявляется в молодом возрасте. В основе феномена WPW лежит проведение волны возбуждения от предсердия к миокарду желудочков по дополнительным проводящим путям. Анатомическим субстратом служит аномальный мышечный пучок, соединяющий предсердия и желудочки (пучок Кента).
В норме электрический импульс распространяется от предсердий на желудочки через АВ-узел, обеспечивающий задержку проведения возбуждения, необходимую для координации работы предсердий и желудочков. При синдроме WPW в результате опережающего проведения импульса на желудочки по дополнительному проводящему пути параллельно с более медленным проведением через АВ-узел происходит преждевременное возбуждение миокарда одного из желудочков, проявляющееся на ЭКГ укороченным интервалом P—Q и образованием дельта-волны. Наличие двух путей проведения электрического импульса от предсердий к желудочкам обеспечивает создание условий для возникновения тахикардии по механизму повторного входа волны возбуждения reentry. При синдроме WPW чаще всего встречают ортодромную реципрокную НЖТ, при которой импульс проводится в антероградном направлении (от предсердий к желудочкам) по АВ-узлу, а ретроградно (от желудочков к предсердиям) по дополнительному пути проведения. При данном виде тахикардии на ЭКГ регистрируют нормальные, «узкие» комплексы QRS. При редко встречающейся антидромной НЖТ импульс циркулирует между предсердиями и желудочками в противоположном направлении: антероградно по пучку Кента, ретроградно через АВ-узел. Во время антидромной НЖТ желудочки активируются только через дополнительный путь проведения, поэтому на ЭКГ регистрируются уширенные более 120мс комплексы QRS.
ДИАГНОСТИКА
Цель диагностики — определение электрокардиографического феномена WPW, а также выявление возможных вариантов НЖТ.
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
ЖАЛОБЫ И АНАМНЕЗ
При наличии феномена WPW жалоб, связанных с предвозбуждением желудочков, нет.
У пациентов с синдромом WPW наиболее часто распространены жалобы на чувство ритмичного сердцебиения, внезапно начинающегося и так же внезапно заканчивающегося.
Следует уточнить длительность приступов неритмичного сердцебиения, провоцирующие факторы, если таковые имеются, переносимость приступов сердцебиения и сопутствующие им симптомы, возможны слабость, одышка, боли в грудной клетке, у пациентов с сопутствующим заболеванием сердца высокая чсс при НЖТ может обусловить развитие приступа стенокардии, выраженную артериальную гипотонию, утяжеление сердечной недостаточности (вплоть до отёка лёгких и аритмического шока), возможны появление головокружения, развитие потери сознания, при фибрилляции или трепетании предсердий на фоне синдрома WPW в результате антероградного проведения по дополнительному пути большого числа предсердных импульсов чсс иногда превышает 300 в минуту, у таких больных могут возникать резкие нарушения гемодинамики с исходом в фибрилляцию желудочков, в какое время суток обычно появляются симптомы, опыт использования «вагусных» проб (натуживание, вызывание рвотного рефлекса и т.п.) или лекарственной терапии с целью прерывания приступа сердцебиения, опыт использования лекарственных средств с профилактической целью.
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Физикальное обследование пациентов проводится по стандартной схеме.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
ЭКГ: на фоне синусового ритма выявляют укорочение интервала Р—Q, наличие дельта-волны. При ортодромной тахикардии на электрокардиограмме выявляют тахикардию с нормальными, «узкими» ритмичными комплексами QRS с чсс 140-180 в минуту (иногда и более). Зубцы Р идентифицируются на расстоянии более 100мс после каждого комплекса QRS. При антидромной тахикардии на ЭКГ определяются ритмичные, существенно расширенные за счёт выраженной дельта-волны комплексы QRS (ЭКГ напоминает таковую при желудочковой тахикардии).
Электрофизиологическое исследование (инвазивное или чреспищеводное ЧПЭС): в отсутствие пароксизмов (при наличии феномена WPW) проводят только представителям отдельных профессий, связанных с личным и общественным риском (лётчикам, водолазам, водителям общественного транспорта) с целью определения оценки вероятности развития тахиаритмий и их характера. При наличии пароксизмов тахикардии электрофизиологическое исследование позволяет оценить, характер нарушений ритма сердца и эффективность медикаментозных средств, а также провести топическую диагностику (только при инвазивном электрофизиологическом исследовании) дополнительного, пучка перед его деструкцией. Исследования проводят в специализированном стационаре.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальную диагностику ортодромной тахикардии проводят с реципрокной АВ-узловой тахикардией, с пароксизмальной предсердной тахикардией, при антидромной тахикардии с желудочковой тахикардией. При феномене WPW интервал ST и зубец Т дискордантны по отношению к комплексу QRS, это может быть причиной ошибочной диагностики ИБС, включая инфаркт миокарда.
ЛЕЧЕНИЕ
ЦЕЛИ ЛЕЧЕНИЯ
Основные принципы лечения тахикардии при синдроме WPW:
- купирование приступа тахикардии
- предупреждение пароксизмов тахикардии.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Госпитализация показана при пароксизме НЖТ, сопровождающемся симптомами стенокардии и/или сердечной недостаточности.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
В отсутствие пароксизмов тахикардии лечения феномена WPW не требуется, но необходимо наблюдение, так как нарушения ритма сердца могут проявиться в любом возрасте. Выбор тактики купирования и профилактического лечения зависит от вида тахикардии, выявленной у больного с синдромом WPW.
Пароксизмальная ортодромная реципрокная тахикардия.
Купирование приступа. В случае острых нарушений гемодинамики необходима неотложная электрическая кардиоверсия. В отсутствие тяжёлых нарушений гемодинамики синусовый ритм может быть восстановлен с помощью вагусных проб: пробы Вальсальвы, пробы Ашнера, умывания ледяной водой, попытки вызвать рвотный рефлекс. Медикаментозное купирование пароксизма проводят при неэффективности указанных мер. С целью прекращения приступа используют:
аденозина фосфат АТФ в/в 36мг быстро, в отсутствие эффекта через 3мин 6-12мг
верапамил в/в 5-10мг медленно (в течение 10 мин)
прокаинамид в/в медленно 500-1000мг однократно
пропафенон в/в медленно 500—1000мкг/кг однократно.
Пароксизм может быть купирован с помощью чреспищеводной электростимуляции.
Предупреждение приступов. При редких пароксизмах, протекающих без нарушений гемодинамики, можно ограничиться только средствами купирования. При частых пароксизмах, особенно сопровождающихся расстройствами гемодинамики, целесообразна радиочастотная катетерная деструкция (аблация) дополнительного пути проведения. При частых пароксизмах возможен профилактический приём препаратов, угнетающих проведение в АВ-узле:
атенолола внутрь по 25-100мг 1—2р в сутки
бисопролола внутрь по 2,5-10мг 1р в сутки
метопролола внутрь по 50-100мг 2р в сутки
пиндолола внутрь по 5-30мг 2р в сутки
пропранолола внутрь по 10-40мг 2-4р в сутки
тимолола внутрь по 10-30мг 2р в сутки длительно.
В отсутствие фибрилляции и трепетания предсердий — блокаторы кальциевых каналов:
верапамил внутрь по 40—80мг 3-4р в сутки
дилтиазем внутрь по 60-180мг 2р в сутки длительно.
При отсутствии у пациента органической патологии миокарда (признаков перенесённого инфаркта миокарда, сниженной фракции выброса левого желудочка, гипертрофии миокарда желудочков и т.д.) возможно применение лекарственных средств I класса:
диэтиламинопропионилэтоксикарбониламинофенотиазина внутрь по 50мг 3-4р в сутки
морацизина внутрь по 200мг 3-4р в сутки
лаппаконитина гидробромида внутрь по 25-50мг 3-4р в сутки
пропафенона внутрь по 150—300мг 3р в сутки
хинидина внутрь по 200-300мг 3—4р в сутки постоянно длительно.
При наличии органической патологии сердца возможно применение антиаритмических препаратов III класса:
амиодарона внутрь по 200-400мг 1р в сутки
соталола внутрь по 80-160мг 2ра в сутки постоянно длительно.
Пароксизмальная антидромная реципрокная тахикардия.
Купирование приступа. В случае острых нарушений гемодинамики необходима неотложная электрическая кардиоверсия. В отсутствие тяжёлых нарушений гемодинамики синусовый ритм может быть восстановлен с помощью вагусных проб: пробы Вальсальвы, пробы Ашнера, умывания ледяной водой, попытки вызвать рвотный рефлекс. Медикаментозное купирование пароксизма проводят при неэффективности указанных мер. С целью прекращения приступа используют:
прокаинамид в/в медленно 500-1000мг однократно
пропафенон в/в медленно 500—1000мкг/кг однократно.
Пароксизм может быть купирован с помощью чреспищеводной электростимуляции.
Предупреждение приступов. При редких пароксизмах, протекающих без нарушений гемодинамики, можно ограничиться только средствами купирования. При частых пароксизмах, особенно сопровождающихся расстройствами гемодинамики, целесообразна радиочастотная катетерная деструкция (аблация) дополнительного пути проведения. В случае отсутствия у пациента органической патологии миокарда (признаков перенесённого инфаркта миокарда, сниженной фракции выброса левого желудочка, гипертрофии миокарда желудочков и т.д.) возможно применение лекарственных средств I класса:
диэтиламинопропионилэтоксикарбониламинофенотиазина внутрь по 50мг 3-4р в сутки
морацизина внутрь по 200мг 3—4р в сутки
лаппаконитина гидробромида внутрь по 25-50мг 3—4р в сутки
пропафенона внутрь по 150—300мг 3р в сутки
хинидина внутрь по 200-300мг 3-4р в сутки постоянно длительно.
При наличии органической патологии сердца возможно применение антиаритмических препаратов III класса:
амиодарона внутрь по 200—400мг 1р в сутки
соталола внутрь по 80-160мг 2ра в сутки постоянно длительно.
Фибрилляция или трепетание предсердий при синдроме WPW.
Купирование приступа. В случае острых нарушений гемодинамики необходима неотложная электрическая кардиоверсия. С целью прекращения приступа используют
прокаинамид в/в медленно 500-1000мг однократно
пропафенон в/в медленно 500-1000мкг/кг однократно.
Верапамил, дигоксин и, по-видимому, аденозина фосфат противопоказаны при фибрилляции и трепетании предсердий у больных с синдромом WPW, так как эти препараты могут улучшать проведение по дополнительному пути, что приводит к увеличению чсс, при этом возможна прямая трансформация фибрилляции предсердий в фибрилляцию желудочков.
Предупреждение приступов. При редких пароксизмах, протекающих без нарушений гемодинамики, можно ограничиться только средствами купирования. При частых пароксизмах, особенно сопровождающихся расстройствами гемодинамики, целесообразна радиочастотная катетерная деструкция (аблация) дополнительного пути проведения. Проведение данной процедуры возможно с последующей профилактической антиаритмической терапией в отношении фибрилляции или трепетания предсердий (см. соответствующие главы), а также в сочетании с аблацией истмусзависимого трепетания предсердии. В случае отсутствия у пациента органической патологии миокарда (признаков перенесённого инфаркта миокарда, сниженной фракции выброса левого желудочка, гипертрофии миокарда желудочков и т.д.) возможно применение лекарственных средств I класса:
диэтиламинопропионилэтоксикарбониламинофенотиазина внутрь по 50мг 3-4р в сутки
морацизина внутрь по 200мг 3—4р в сутки
лаппаконитина гидробромида внутрь по 25—50мг 3—4р в сутки
пропафенона внутрь по 150—300мг 3р в сутки
хинидина внутрь по 200—300мг 3-4р в сутки постоянно длительно.
При наличии органической патологии сердца возможно применение антиаритмических препаратов III класса:
амиодарона внутрь по 200-400мг 1р в сутки
соталола внутрь по 80-160мг 2р в сутки постоянно длительно.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Альтернативным лекарственной терапии служит метод катетерной аблации (деструкции) дополнительного пути проведения. Катетерная деструкция в наибольшей степени показана при опасном для жизни увеличении чсс во время пароксизмов фибрилляции и трепетания предсердий, неэффективности или непереносимости антиаритмических лекарственных средств, а также при нежелании пациентов принимать пожизненную антиаритмическую терапию.
Оценка эффективности проводимого лечения — успешное купирование тахикардии и профилактика рецидивов.
ОБУЧЕНИЕ ПАЦИЕНТА
Пациенту с синдромом WPW следует разъяснить суть данного нарушения ритма, рассказать о том, какие приступы тахикардии опасны для жизни, объяснить возможности немедикаментозного лечения (радиочастотная катетерная аблация).
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ
При наличии феномена WPW желательно ежегодное наблюдение пациента, так как пароксизмальные тахикардии могут возникать в любом возрасте.
При проведении лекарственного антиаритмического лечения больных с синдромом WPW необходимо наблюдение с целью оценки эффективности и безопасности проводимой терапии. Оно должно включать в себя опрос, осмотр пациента при каждом посещении, ЭКГ 1-2р в 3мс, суточное мониторирование ЭКГ и эхоКГ 1р в год, а также, при необходимости, изменения антиаритмической терапии.
ПРОГНОЗ
У пациентов без фибрилляции или трепетания предсердий прогноз благоприятный. При возникновении фибрилляции или трепетания предсердий на фоне синдрома WPW существует угроза развития жизнеопасных нарушений ритма сердца (фибрилляции желудочков).
ЖЕЛУДОЧКОВЫЕ АРИТМИИ
КОДЫ МКБ-10
I49.3 Преждевременная деполяризация желудочков
I47.0 Возвратная желудочковая аритмия
I47.2 Желудочковая тахикардия.
ЖЕЛУДОЧКОВАЯ ЭКСТРАСИСТОЛИЯ
Желудочковые экстрасистолы ЖЭС — преждевременные эктопические импульсы (электрокардиографические комплексы) с расположением источника в миокарде желудочков или в разветвлениях Пуркинье. Они могут быть одиночными и парными.
ЭПИДЕМИОЛОГИЯ
Единичные ЖЭС когда-либо возникают у всех людей. Экстрасистолия нередко сопровождает течение различных заболеваний сердца (ИБС, миокардиты, кардиомиопатии и т.д.).
ПРОФИЛАКТИКА
Исключение преходящих факторов, влияющих на возникновение ЖЭС. Адекватное лечение различной патологии, способной обусловить возникновение экстрасистолии (см. Этиология).
СКРИНИНГ
ЭКГ, а также суточное ЭКГ-мониторирование по Холтеру. Примерно 30% людей ощущают ЖЭС как перебои в работе сердца или «остановку сердца».
КЛАССИФИКАЦИЯ
Экстрасистолия, исходящая из одного источника, называется монотонной и характеризуется одинаковой морфологией электрокардиографических комплексов, одинаковым интервалом сцепления с предшествующими комплексами основного ритма сердца (одинаковой степенью преждевременности). Политопная экстрасистолия происходит из различных эктопических очагов и вследствие этого имеет различную ЭКГ-морфологию и различающиеся интервалы сцепления.
Существует градационная классификация желудочковой эктопической активности (табл. 62).
Таблица 62. Классификация желудочковой эктопической активности по В. Lown

ЭТИОЛОГИЯ
Преходящие факторы:
- физическая и эмоциональная нагрузка
- повышенное утомление
- приём алкоголя
- курение
- злоупотребление кофеинсодержащими напитками
- электрическая травма сердца
- острая ишемия
- острые заболевания сердца (острый миокардит, перикардит).
Органические заболевания сердца:
- ИБС, в том числе инфаркт миокарда
- артериальная гипертензия
- кардиомиопатии
- хронический миокардит
- сердечная недостаточность
- пороки сердца
- аритмогенная дисплазия правого желудочка.
Несердечные заболевания и патологические состояния:
- гипокалиемия (в том числе при лечении диуретиками)
- гипомагниемия
- приём лекарственных препаратов (сердечных гликозидов, симпатомиметиков, антиаритмических лекарственных средств, психотропных препаратов, некоторых антибиотиков и др.)
- различные эндокринные заболевания.
ДИАГНОСТИКА
Цель диагностики заключается в подтверждении именно ЖЭС и её возможной связи с патологическими сердечными и несердечными причинами.
ЖЭС может протекать бессимптомно, и её выявляют случайно во время профилактического осмотра и последующей записи ЭКГ.
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
ЖАЛОБЫ И АНАМНЕЗ
В значительной части случаев клинические проявления ЖЭС могут отсутствовать.
Чаще всего пациентов беспокоят перебои в работе сердца, ощущение «остановки сердца», иногда возникают немотивированная слабость и снижение толерантности к физической нагрузке (при гемодинамически неэффективных экстрасистолических сокращениях).
Следует уточнить длительность эпизодов перебоев, провоцирующие факторы — физическая и эмоциональная нагрузка, приём пищи, употребление алкоголя, кофеинсодержащих продуктов (кофе, чай, тонизирующие газированные напитки), симпатомиметиков и др., переносимость перебоев в работе сердца и сопутствующие им симптомы: одышка, боли в грудной клетке стенокардитического характера, подъём или снижение артериального давления, толерантность к физической нагрузке, головокружение и т.д., в какое время суток обычно появляются симптомы, опыт использования лекарственной терапии с целью облегчения состояния, её эффективность, выполнение больным врачебных рекомендаций.
Выяснение жалоб и анамнеза для уточнения наличия сопутствующих заболеваний и вероятной причины ЖЭС.
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Основным неспецифичным клиническим признаком ЖЭС служит неритмичность чсс во время аускультации и при подсчёте пульса на лучевой артерии, также может наблюдаться феномен дефицита пульса. Физикальное обследование пациентов также должно быть направлено на выявление симптомов заболевания сердечно-сосудистой системы и других органов как возможной причины возникновения ЖЭС.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Биохимический анализ крови (для выявления гипокалиемии, гипомагниемии и т.д.).
Лабораторные маркёры хронического злоупотребления алкоголем, в первую очередь повышение гамма-глютамилтранспептидазы.
Маркёры острого и хронического воспаления.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
ЭКГ — зубцы Р перед преждевременным комплексом QRS отсутствуют, комплекс QRS расширен (обычно более 120мс) с дискордантным направлением начальной и конечной его части. После экстрасистолы чаще всего отмечают полную компенсаторную паузу, которая следует за ЖЭС (равна по продолжительности двум синусовым циклам).
Суточное мониторирование ЭКГ позволяет не только диагностировать ЖЭС, но и дать их количественную оценку, определить периодичность возникновения в различные интервалы суток, а также оценить связь экстрасистолии с физической нагрузкой, временем суток, подъёмами артериального давления, эпизодами ишемии миокарда и другими факторами.
ЭхоКГ: направлено на выявление признаков патологии сердца,
способной приводить к возникновению ЖЭС (наличие зон нарушенной сократимости
миокарда, изменения клапанов, пороки развития, размеры
камер сердца и др.).
Остальные исследования должны быть направлены на поиск перечисленных причин возникновения ЖЭС, и их проводят строго по показаниям на основании жалоб, анамнеза пациента и клинического осмотра.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Цель — подтверждение связи клинических проявлений с ЖЭС (по ЭКГ, данным суточного ЭКГ-мониторирования).
По ЭКГ ЖЭС в некоторых случаях необходимо дифференцировать от наджелудочковой экстрасистолии (при аберрантных наджелудочковых комплексах) по отсутствию или наличию зубцов Р и их соотношению с комплексами QRS.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Направление к кардиологу в кардиодиспансер или окружной клинико-диагностический центр для уточнения причины ЖЭС и дифференциальной диагностики.
ЛЕЧЕНИЕ
ЦЕЛИ ЛЕЧЕНИЯ
Основные принципы лечения ЖЭС:
- коррекция состояния, явившегося причиной ЖЭС
- воздействие на основное заболевание сердечно-сосудистой системы (коррекция артериальной гипертензии, ишемических проявлений, пороков сердца и т.д.)
- воздействие на собственно аритмию.
Основные показания к проведению антиаритмического лечения при экстрасистолии:
- возникновение ЖЭС на фоне органического поражения сердца, что относится к факторам ухудшения прогноза жизни
- наличие у пациентов неприятных субъективных симптомов, сопровождающих экстрасистолию
- наличие экстрасистолии высоких градаций III—V как возможного предвестника более опасных желудочковых нарушений ритма сердца.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Госпитализация показана по поводу состояний, явившихся причиной ЖЭС.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
В отсутствие клинических проявлений ЖЭС не требует лечения. Целесообразен отказ от курения, приёма алкоголя, избыточного потребления кофе и других провоцирующих факторов.
При ухудшающей самочувствие пациентов ЖЭС в отсутствие органической патологии сердца назначают антиаритмические препараты IA и IC классов (с осторожностью, под контролем ЭКГ из-за возможного угнетения процессов проведения сердечного импульса):
лаппаконитина гидробромид (аллапинин) внутрь по 25—50мг 3-4р в сутки
дизопирамид внутрь по 100-300мг 3-4р в сутки
прокаинамид внутрь по 500мг 3-4р в сутки
пропафенон внутрь по 150—300мг 3р в сутки
хинидина сульфат внутрь по 200-300мг 3-4р в сутки
этацизин внутрь по 50мг 3—4р в сутки
этмозин внутрь по 200мг 3-4р в сутки постоянно длительно.
Также можно использовать в качестве антиаритмических средств б-адреноблокаторы, особенно при наличии данных, указывающих на увеличение числа ЖЭС во время возрастания частоты синусового ритма (тахизависимая ЖЭС):
атенолол внутрь по 25-100мг 1-2р в сутки
бисопролол внутрь по 2,5-10мг 1р в сутки
метопролол внутрь по 50-100мг 2р в сутки
пиндолол внутрь по 5-30мг 2р в сутки
пропранолол внутрь по 10-40мг 2-4р в сутки
тимолол внутрь по 10-30мг 2р длительно.
При наличии противопоказаний к приёму б-адреноблокаторов в качестве альтернативных средств назначают блокаторы кальциевых каналов:
верапамил внутрь по 40-80мг 3-4р в сутки
дилтиазем внутрь по 60-180мг 2р в сутки длительно.
При неэффективности препаратов I класса можно использовать лекарственные средства III класса (принципы безопасного применения данных средств см. ниже):
амиодарон внутрь по 200мг 1р в сутки
соталол внутрь по 80-160мг 2р в сутки постоянно длительно.
Антиаритмические лекарственные средства IA и IC классов ухудшают прогноз жизни у больных с органическим поражением сердца (инфаркт миокарда, кардиомиопатия и другие формы сердечной патологии, протекающей со снижением фракции выброса левого желудочка), поэтому их не назначают для лечения ЖЭС у этой категории пациентов.
Назначение антиаритмических препаратов следует проводить в условиях максимально достижимой коррекции основного заболевания, устранения гипокалиемии, гипомагниемии, гликозидной интоксикации. При заболеваниях, протекающих с нарушением насосной функции сердца, необходимо назначение б-адреноблокаторов, которые даже при отсутствии влияния на число ЖЭС снижают риск возникновения желудочковой тахикардии и фибрилляции желудочков, улучшая прогноз жизни.
Медикаментозное лечение ЖЭС, возникшей вследствие гипокалиемии, калия хлорид в/в до 4-5мэкв/кг/сут до достижения верхней границы сывороточного калия. Кратность введения и продолжительность лечения определяют по уровню калия в крови.
Медикаментозное лечение ЖЭС, возникшей вследствие гипомагниемии, магния сульфат в/в по 1000мг 4р в сутки (дозу рассчитывают по магнию) до достижения верхней границы сывороточного магния. При тяжёлой гипомагниемии суточная доза может достигать 8-12г/сут (дозу рассчитывают по магнию).
Медикаментозное лечение ЖЭС, возникшей вследствие гликозидной интоксикации, димеркапрол в/в по 5мг/кг 3-4р в 1-е сутки, 2р во 2-е сутки, затем 1р в сутки до устранения симптомов интоксикации в сочетании с калия хлоридом в/в до 4-5 мэкв/кг/сут) до достижения верхней границы сывороточного калия. Кратность введения и продолжительность лечения хлоридом калия определяют по уровню калия в крови.
Медикаментозное лечение ЖЭС высоких градаций III-V по В. Lown:
лидокаин в/в по 1мг/кг, затем по 0,5мг/кг каждые 3-5мин до получения эффекта или до общей дозы 3мг/кг, после чего начинают непрерывную инфузию со скоростью 2-4мг/мин (20-50мкг/кг/мин))
фенитоин в/в 250мг в течение 10мин, затем по 100мг каждые 5мин (при необходимости до общей дозы 1000мг).
Терапию лидокаином или фенитоином используют дополнительно к лечению причины экстрасистолии.
Медикаментозное лечение ЖЭС высоких градаций III-V по В. Lown у больных с органическим поражением сердца:
амиодарон (препарат III класса) одновременно подавляет ЖЭС и улучшает прогноз жизни у больных с органическим поражением мышцы сердца, в том числе перенёсших инфаркт миокарда. Препарат назначают по насыщающей схеме. Начинают амиодарон внутрь по 200мг 3р в сутки (1-я неделя), 2р в сутки (2-я неделя). Лечение проводят под контролем ЭКГ (1р в 2-3сут). После достижения признаков насыщения амиодароном (увеличение продолжительности интервала Q-T нa 20% от исходного) назначают препарат в поддерживающей дозе амиодарон внутрь по 200мг 1р в сутки длительно (обычно с 3-й недели). Лечение проводят под контролем ЭКГ (1р в 4-6нд). При увеличении продолжительности интервала Q-Т на 500мс или на 25% от исходного, требуются временная отмена препарата и в дальнейшем применение его в уменьшенной дозе 100мг/сут. Перед назначением амиодарона, учитывая вероятность развития несердечных побочных эффектов (повышение активности печёночных трансаминаз, при длительном применении - токсический гепатит, холестаз, желтуха, периферическая нейропатия, альвеолит, гипотиреоз или гипертиреоз и др.), необходимо провести дополнительное обследование щитовидной железы (УЗИ, гормоны), консультацию окулиста, рентгенографию органов грудной клетки, получить результаты печёночных проб. В последующем наблюдение за состоянием роговицы глаз, щитовидной железы и печени должно осуществляться не реже чем 1р в 6мс, за состоянием лёгких ежегодно.
У пациентов с органическим поражением сердца возможно использование и другого препарата III класса соталола внутрь по 80-160мг 2р в сутки постоянно, длительно. Дозу лекарственного средства подбирают индивидуально с учётом переносимости, уровня АД и чсс. При назначении необходим контроль ЭКГ на 2-3-й день от начала приёма, затем каждые 4-6нд. Необходимо оценивать чсс, длительность интервалов P-Q и Q-T. Как и при назначении амиодарона, в случае увеличения продолжительности интервала Q-T до 500мс или на 25% от исходного требуются временная отмена препарата и в дальнейшем попытка его назначения в уменьшенной дозировке при условии сохранения эффективности.
Критерии эффективности проводимого лечения. Наиболее объективно оценить эффективность назначаемой терапии позволяет суточное мониторирование ЭКГ по Холтеру. Препарат считают эффективным, если отмечают уменьшение общего числа экстрасистол на 50% и более, парных экстрасистол на 90% и полное устранение пробежек желудочковой тахикардии и экстрасистол V градации (R на Т).
ОБУЧЕНИЕ ПАЦИЕНТА
Пациенту с ЖЭС следует разъяснить суть данного нарушения ритма, рассказать об ожидаемом эффекте проводимого лечения, побочных эффектах лекарственных средств, а также о чрезвычайной важности тщательного соблюдения режима жизни и регулярности приёма антиаритмических и других препаратов (если есть в этом необходимость).
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ
При отсутствии необходимости лечения ЖЭС пациенту желательно 1р в год проводить контрольное обследование, включающее ЭКГ, суточное холтеровское мониторирование ЭКГ, эхоКГ. При этом дают оценку количества экстрасистол, динамики их градаций, состояния сердечной мышцы и клапанного аппарата, после чего определяют целесообразность проведения медикаментозной терапии.
Больные с ЖЭС, получающие антиаритмическую терапию, нуждаются в постоянном наблюдении. Оно должно включать в себя опрос, осмотр пациента при каждом посещении, ЭКГ 1-2р в 3мс, суточное мониторирование ЭКГ и эхоКГ 1р в 6мс.
ПРОГНОЗ
Для определения прогностической значимости желудочковых нарушений ритма используют классификацию, предложенную в 1984г. J.T.Bigger (табл. 63). Она построена на анализе не только характера желудочковой эктопической активности и её клинических проявлений, но и на наличии либо отсутствии органического поражения сердца. Классификация выделяет три категории больных по степени риска внезапной аритмической смерти. Такое разделение больных на группы позволяет определить показания к проведению противоаритмического лечения, направленного на профилактику (первичную или вторичную) внезапной смерти, улучшение прогноза жизни пациента.
Таблица 63. «Прогностическая» классификация желудочковых аритмий J.T.Bigger (1984).

ЖЕЛУДОЧКОВАЯ ТАХИКАРДИЯ
Желудочковая тахикардия ЖТ - тахикардия, при которой источник эктопической импульсации расположен ниже пучка Гиса: в миокарде желудочков, в ножках пучка Гиса, в сети Пуркинье.
ЭПИДЕМИОЛОГИЯ
Точная распространённость ЖТ неизвестна.
ПРОФИЛАКТИКА
Исключение преходящих факторов, влияющих на возникновение ЖТ. Адекватное лечение патологии, способной обусловить возникновение тахикардии (см. Этиология).
СКРИНИНГ
ЭКГ, а также суточное ЭКГ-мониторирование по Холтеру.
КЛАССИФИКАЦИЯ
По форме электрокардиографических комплексов:
- мономорфная
- полиморфная:
двунаправленная
двунаправленная веретенообразная torsade de pointes (связанная с патологическим удлинением интервала Q-T).
По частоте желудочковых сокращений:
- от 51-100 ускоренный идиовентрикулярный ритм
- от 101-250 желудочковая тахикардия
- выше 250 трепетание желудочков
- фибрилляция желудочков - аритмичная, хаотичная электрическая активация желудочков, на ЭКГ дискретные комплексы QRS не дифференцируются.
По продолжительности:
- устойчивые длительностью более 30с
- неустойчивые длительностью менее 30с.
По характеру течения:
- пароксизмальные
- непароксизмальные.
ЭТИОЛОГИЯ
Органические заболевания сердца:
- ИБС, в том числе инфаркт миокарда
- кардиомиопатии
- артериальная гипертензия
- миокардит
- сердечная недостаточность
- пороки сердца
- аритмогенная дисплазия правого желудочка.
Преходящие факторы:
- приём алкоголя
- физическая и эмоциональная нагрузка
- повышенное утомление
- курение
- злоупотребление кофеинсодержащими напитками.
Несердечные заболевания и состояния:
- гипокалиемия (в том числе при лечении диуретиками)
- гипомагниемия
- приём лекарственных препаратов (сердечных гликозидов, симпатомиметиков, антиаритмических лекарственных средств, некоторых психотропных средств, некоторых антибиотиков)
- эндокринные заболевания (феохромоцитома, гипотиреоз).
Мутации генов, регулирующих функции ионных каналов (врождённые клинико-электрофизиологические синдромы: удлинённого Q-T, Бругада, укороченного Q-T).
Идиопатическая ЖТ.
ДИАГНОСТИКА
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
ЖАЛОБЫ И АНАМНЕЗ
Клинические проявления пароксизмов ЖТ варьируют от ощущения сердцебиения до отёка лёгких, аритмического шока, обмороков или остановки кровообращения.
Чаще всего пациентов беспокоят ощущение сердцебиения, «остановки сердца», иногда возникают немотивированная внезапная слабость, головокружение, обморочное состояние. Следует уточнить длительность эпизодов сердцебиения, провоцирующие факторы (физическая и эмоциональная нагрузка, употребление алкоголя, симпатомиметиков, препаратов, удлиняющих интервал Q-Т), переносимость тахикардии, а также предшествующие и сопутствующие ей симптомы (одышка, боли в грудной клетке стенокардитического характера, подъём или снижение артериального давления, головокружение, обморок и т.д.), в какое время суток обычно появляются симптомы, опыт использования лекарственной терапии с целью купирования профилактики тахикардии, её эффективность.
Выяснение жалоб и анамнеза для уточнения наличия сопутствующих заболеваний и вероятной причины ЖТ.
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Физикальное обследование пациентов должно быть направлено на выявление симптомов заболевания сердечно-сосудистой системы и других органов как возможной причины возникновения ЖТ.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Биохимический анализ крови (для исключения гипокалиемии, гипомагниемии, признаков инфаркта миокарда и т.д.).
Лабораторные маркёры хронического злоупотребления алкоголем, в первую очередь повышение гамма-глютамилтранспептидазы.
Гормоны щитовидной железы (для исключения гипотиреоза).
Содержание катехоламинов в крови.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
ЭКГ - регистрируется тахикардия с уширенными комплексами QRS (более 120мс) с дискордантным направлением начальной и конечной его части, В 50% случаев выявляют признаки предсердно-желудочковой диссоциации - отсутствие связи между предсердными и желудочковыми комплексами (единственным достоверным электрокардиографическим признаком ЖТ).
Суточное мониторирование ЭКГ позволяет получить особенно ценную информацию в случаях непрерывно рецидивирующего течения или частого рецидивирования ЖТ: определить длительность эпизодов ЖТ, периодичность их возникновения, а также выявить связь тахикардии с физической нагрузкой, временем суток, эпизодами ишемии миокарда и другими факторами. При использовании 12-канального ЭКГ-мониторирования, помимо этого, можно определить топографию источника ЖТ. Возможно определение связи появления ЖТ с изменениями длительности интервала Q-T.
ЭхоКГ: направлена на выявление признаков сердечной патологии, являющейся возможной причиной развития ЖТ - гипертрофии миокарда, зон нарушенной сократимости миокарда левого желудочка, признаков аритмогенной дисплазии правого желудочка, изменения клапанов, пороков развития, размеров камер сердца (в первую очередь припою и левого желудочков).
Инвазивное электрофизиологическое исследование проводят с целью диагностики ЖТ, а также для оценки индивидуальной эффективности профилактической антиаритмической терапии (исследование проводят только в условиях специализированного стационара).
Остальные исследования должны быть направлены на поиск представленных выше причин возникновения ЖТ и проводиться строго по показаниям на основании жалоб, анамнеза пациента и клинического осмотра.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Цель - подтвердить связь возникающих клинических симптомов именно с ЖТ (по ЭКГ, данным суточного ЭКГ-мониторирования, электрофизиологического исследования).
По ЭКГ в некоторых случаях ЖТ необходимо дифференцировать от наджелудочковой тахикардии (при аберрантных наджелудочковых комплексах) по отсутствию или наличию зубцов Р и их соотношению с комплексами QRS, а также от преходящей блокады ножки пучка Гиса.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Консультация кардиолога в кардиодиспансере показана во всех случаях при выявлении ЖТ
ЛЕЧЕНИЕ
ЦЕЛИ ЛЕЧЕНИЯ
При неустойчивой ЖТ немедленного вмешательства обычно не требуется. Данный вид ЖТ соответствует IVB градации по В.Lown и обусловливает необходимость в таких же подходах к лечению (см. Желудочковая экстрасистолия).
Устойчивую желудочковую тахикардию относят к тяжёлым и опасным для жизни аритмиям. При этой форме ЖТ требуются неотложное купирование и эффективная профилактика пароксизмов.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Госпитализация показана при нестабильной гемодинамике, частом рецидивировании, а также для проведения электрофизиологического исследования для уточнения диагноза.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Купирование пароксизмов ЖТ.
При острых и тяжёлых нарушениях гемодинамики проводят экстренную электрическую кардиоверсию.
В отсутствие тяжёлых нарушений гемодинамики возможно медикаментозное купирование приступа ЖТ. Применяют:
лидокаин в/в 1-1,5мг/кг, можно повторять каждые 5мин до обшей дозы 3мг/кг, под контролем ЭКГ
прокаинамид в/в 20-30мг/мин общей дозы 17мг/кг под контролем ЭКГ и АД
соталол в/в 20мг медленно в течение 5мин, через 20мин еще 20мг со скоростью введения 1мг/мин под контролем ЭКГ и АД
амиодарон в/в 5мг/кг в течение 5мин под контролем ЭКГ.
При неэффективности лекарственного купирования показана электрическая кардиоверсия.
При полиморфной ЖТ типа torsade de pointes, обусловленной патологическим удлинением интервала Q-Т, электрическую кардиоверсию проводят так же, как и при мономорфной ЖТ. Показано также применение солей магния:
магния сульфат в/в 1000мг однократно.
Купирование пароксизмов ЖТ желательно проводить в условиях палаты интенсивной терапии.
Профилактика рецидивов ЖТ. У больных, перенёсших инфаркт миокарда, страдающих дилатационной кардиомиопатией и другой органической патологией, которая протекает со сниженной систолической функцией левого желудочка, применение б-адреноблокаторов может снизить риск внезапной аритмической смерти, однако редко бывает достаточным для профилактики рецидивов ЖТ:
атенолол внутрь по 25-100мг 1-2р в сутки
бисопролол внутрь по 2,5-10мг 1р в сутки
метопролол внутрь по 50-100мг 2р в сутки
пиндолол внутрь по 5-30мг 2р в сутки
пропранолол внутрь по 10-40мг 2-4р сутки
тимолол внутрь по 10-30мг 2р в сутки, длительно.
У пациентов со сниженной фракцией выброса левого желудочка и недостаточностью кровообращения дозы б-адреноблокаторов подбирают индивидуально, начиная с минимальных.
Назначение антиаритмических средств IA и IC классов для профилактики ЖТ, как и для лечения других форм сердечных аритмий, ухудшает прогноз жизни пациентов с органической патологией сердца, поэтому эти классы препаратов не используют у данной категории больных.
Единственным препаратом, который не только эффективно предотвращает развитие ЖТ, но и улучшает прогноз жизни больных, является амиодарон. При его применении следует учитывать возможность развития побочных эффектов. Препарат назначают по насыщающей схеме:
амиодарон внутрь по 200мг 3р в сутки (1-я неделя), 2р в сутки (2-я неделя) под контролем ЭКГ (1р в 2-3сут). После достижения признаков насыщения амиодароном - увеличения продолжительности интервала Q-T на 20% от исходного назначают поддерживающую дозу:
амиодарон внутрь по 100-400мг 1р в сутки длительно (обычно с 3-й недели) под контролем ЭКГ (1р в 4-6нд) до увеличения продолжительности интервала Q-T 500мс или на 25% от исходного, когда требуются временная отмена препарата и в дальнейшем применение его в уменьшенной дозе. (Наблюдение за больными, принимающими амиодарон, см. в Желудочковая экстрасистолия.)
У пациентов с органическим поражением миокарда с целью профилактики ЖТ также возможно использование другого препарата III класса
соталол внутрь по 80-160мг 2р в сутки постоянно длительно.
Дозу лекарственного средства подбирают индивидуально, путём титрования от меньшей к большей, с учётом переносимости, уровня АД и чсс. Первые 3-5дней необходим ежедневный контроль ЭКГ, затем каждые 4-6нд. Необходимо оценивать чсс, длительность интервалов P-Q и Q-Т. Как и при назначении амиодарона, в случае увеличения продолжительности интервала Q-Т до 500мс или на 25% от исходного требуются временная отмена препарата и в дальнейшем попытка его назначения в уменьшенной дозировке при условии сохранения эффективности. Подбор антиаритмической терапии желательно проводить в условиях стационара. Критерием эффективности проводимого лечения служит отсутствие рецидивов тахикардии.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Несмотря на улучшение прогноза жизни больных с ЖТ при назначении амиодарона, имплантация автоматических кардиовертеров-дефибрилляторов превосходит медикаментозное лечение по влиянию на продолжительность жизни пациентов с тяжёлой органической патологией миокарда (особенно после перенесённого инфаркта миокарда).
Положительные результаты дают сочетание хирургических методов лечения основного заболевания (аортокоронарное шунтирование у больных с ИБС) с интраоперационной деструкцией эктопического очага желудочковой импульсации или с имплантацией кардиовертера-дефибриллятора.
У больных с идиопатической ЖТ возможна успешная катетерная аблация (деструкция) очага желудочковой эктопической импульсации.
ОБУЧЕНИЕ ПАЦИЕНТА
Пациенту с ЖТ следует разъяснить опасность данного нарушения ритма, рассказать об ожидаемом эффекте проводимого лечения, побочных эффектах лекарственных средств, а также о чрезвычайной важности тщательного соблюдения режима жизни и регулярности приёма антиаритмических препаратов, а также средств, необходимых для лечения основного заболевания.
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ
После постановки диагноза ЖТ наблюдение пациентов с целью оценки эффективности проводимой терапии и оценки динамики основного заболевания обязательно. Оно должно включать в себя опрос, осмотр пациента при каждом посещении, ЭКГ 1-2р в 3мс, суточное мониторирование ЭКГ и эхоКГ 1р в 6мс. При назначении амиодарона в качестве средства профилактического лечения необходим контроль структуры и функции щитовидной железы (УЗИ щитовидной железы 1р в 4-6мс, гормоны щитовидной железы 1р в 3мс), рентген-контроль 1р в год, консультация окулиста 1р в 6мс.
ПРОГНОЗ
См. Желудочковая экстрасистолия.
ИНФЕКЦИОННЫЙ ЭНДОКАРДИТ
Инфекционный эндокардит ИЭ - внутрисосудистая микробная инфекция, локализующаяся на эндокарде сердечно-сосудистых структур и внутрисердечных инородных материалах, располагающихся на пути тока крови.
КОД МКБ-10
I33.0 Острый и подострый инфекционный эндокардит.
ЭПИДЕМИОЛОГИЯ
ИЭ - относительно редкое заболевание, заболеваемость составляет от 16 до 116 случаев на 1 млн населения в год в разных регионах. Заболевание возможно в любом возрасте, чаще болеют мужчины.
ЭТИОЛОГИЯ
Около 85% случаев ИЭ обусловлено стафилококками, стрептококками (прежде всего Streptococcus viridans) или энтерококками. По последним данным, во многих регионах на первое место в этиологической структуре ИЭ выходит Staphylococcus aureus.
Возбудители ИЭ:
- стафилококки. ИЭ вызываются каогулазапозитивными (S.aureus) и коагулазанегативными стафилококками (S.epidermidis и другие). S.aureus вызывает около 1/3 случаев ИЭ естественных и протезированных клапанов. Характерны рост частоты стафилококкового ИЭ, ассоциированного с медицинскими вмешательствами, и растущая встречаемость стафилококков, резистентных к оксациллину/метициллину
- стрептококки. Стрептококки зеленящей группы (S.sanguis, S.oralis, S.salivaris, S.mutans, S.milleri, Gemella morbillorum), S.bovis, S.pneumoniae, S.pyogenes, Abiotrophia и другие стрептококки - типичные возбудители внебольничного подострого ИЭ на естественных клапанах, не связанного с применением наркотиков
- энтерококки. Из видов энтерококков ИЭ чаще вызываются Е.faecalis и Е.faeclum
- НАСЕК-группа. Грамотрицательные бактерии Haemophilus parainfluenzae, H.aprophilus, H.paraprophilus, H.influenzae, Actinobacillus actinomycetemcomltans, Cardiobacterium hominis, Eikenella corrodens, Kingella kingae, K.denltriflcans вызывают от 2 до 10% случаев внебольничного ИЭ на естественных клапанах, не связанного с наркоманией.
Другие грамотрицательные бактерии. Грамотрицательные аэробные бактерии — Salmonella, Enterobacter, E.coli, Proteus mirabilis, Klebsiella, Serratia, Pseudomonas (P.aeruginosa, P.cepacia), Neisseria gonorrhoeae, условно-патогенные нейссерии, Moraxella catarrhalis, менингококки — редкие возбудители ИЭ.
Грибы. Грибковый ИЭ наблюдается редко, характеризуется летальностью до 80%. Candida и Aspergillus — основные возбудители; первый встречают значительно чаще.
ИЭ с негативной гемокультурой. При соблюдении правил взятия крови на посев и хороших лабораторных возможностях в 5—20% случаев ИЭ роста гемокультуры нет. К редким возбудителям ИЭ, не растущим на обычных средах или требующим серологической диагностики, относят Bartonella, Chlamydia, Coxiella burnetii, Brucella, Legionella, Tropheryma whippleii, Nocardia, не-Candida грибы (Aspergillus).
Полимикробная ассоциация наблюдается редко — как правило, при ИЭ наркоманов.
Таблица 64. Наиболее вероятные возбудители ИЭ в группах больных в зависимости от эпидемиологических ситуаций (AHA Scientific Statement, 2005)

ПАТОГЕНЕЗ ИНФЕКЦИОННОГО ЭНДОКАРДИТА
Инфицирование эндокарда происходит из тока крови при бактериемии. Поступлению микроорганизмов в кровоток способствуют плохое состояние зубов, травмы и инфекции кожи, ожоги, очаговые инфекции, хронические воспалительные заболевания или опухоли кишечника, органов мочеполовой системы, наркомания (внутривенное введение наркотиков). Ятрогенную бактериемию наблюдают при стоматологических и других инвазивных медицинских процедурах, особенно таких, как открытые операции на сердце, внутривенные катетеры и внутрисердечные устройства, гемодиализ.
Необходимым условием для фиксации микроорганизмов на эндокарде считают наличие предшествующего неинфекционного тромбоэндокардита — микротромбов на эндокарде в местах гемодинамической микротравматизации, чаще связанной с определёнными нарушениями гемодинамики при пороках сердца. ИЭ может возникнуть при отсутствии какой-либо предшествующей патологии сердца, но риск присоединения ИЭ значительно выше среди больных с пороками сердца, перенесённым ИЭ, клапанными протезами и перенесёнными реконструктивными операциями на сердце, пролапсом митрального клапана, гипертрофической кардиомиопатией.
Поражение сердца при ИЭ характеризуется образованием на поверхности эндокарда вегетации, содержащих тромбоциты, фибрин, эритроциты, воспалительные клетки и колонии микроорганизмов. Размножение микроорганизмов в вегетациях, вызывающее их дальнейшее разрастание, по неуточнённым причинам выходит из-под контроля противоинфекционных защитных механизмов организма, и без лечения антибиотиками или хирургического лечения эндокардит прогрессирует, приводя к смерти больного, при прогрессировании ИЭ наблюдают изъязвления, разрывы, разрушение клапанов, а также распространение инфекции на другие структуры сердца: абсцессы прилежащих участков миокарда и фиброзного клапанного кольца, аневризма синуса Вальсальвы, образование внутрисердечных фистул. Эти патологические изменения приводят к клапанной регургитации (острой или подострой), развитию сердечной недостаточности у большинства больных в разные периоды заболевания и появлению новых, нарушений проводимости при вовлечении проводящих путей.
Внесердечные проявления ИЭ. Течение болезни характеризуется системным воспалением и септической интоксикацией, нередко сопровождается внесердечными мультиорганными поражениями, которые носят вторичный характер и связаны с развитием иммунокомплексной патологии или тромбоэмболическими осложнениями, а также метастатической инфекцией и септицемией.
ПРОФИЛАКТИКА
Постоянная профилактика ИЭ входит в задачи работы врача-кардиолога амбулаторной практики и должна проводиться у всех больных с заболеваниями сердца, относящимися к категории высокого и среднего риска присоединения ИЭ.
Заболевания сердца, при которых показана профилактика ИЭ (заболевания с высоким риском присоединения ИЭ):
- протезированные клапаны сердца (в том числе биологические трансплантаты)
- сложные врождённые пороки сердца «цианотического» типа (в том числе после хирургической коррекции)
- ранее перенесённый инфекционный эндокардит
- сформированные хирургически системные или лёгочные сосуды.
Заболевания со средним риском присоединения ИЭ:
- приобретённые клапанные пороки сердца
- врождённые пороки сердца «нецианотического» типа, включая бикуспидальный аортальный клапан (исключается вторичный дефект межпредсердной перегородки)
- пролапс митрального клапана с выраженной регургитацией или значительным утолщением клапана (миксоматозная дегенерация)
- гипертрофическая кардиомиопатия.
Заболевания сердца, при которых нет необходимости в проведении профилактики инфекционного эндокардита (заболевания с низким риском присоединения ИЭ):
- вторичный дефект межпредсердной перегородки
- после хирургических операций по поводу перевязки открытого артериального протока и пластики дефекта межпредсердной перегородки
- пролапс митрального клапана без регургитации
- после операции аортокоронарного шунтирования
- после имплантации электрокардиостимулятора
- при функциональных шумах сердца.
Для предупреждения инфицирования эндокарда необходимо применение антибиотиков непосредственно перед медицинскими процедурами, во время которых повреждение кожи или слизистых оболочек с большой вероятностью вызывает бактериемию. Если это не было выполнено, антибиотики могут быть полезны при последующем внутривенном введении в течение 2-3ч.
Медицинские процедуры, при которых рекомендована антимикробная профилактика ИЭ:
- бронхоскопия жёстким эндоскопом
- цистоскопия (при инфекции мочевыводящих путей)
- биопсия мочевыводящих путей или предстательной железы
- стоматологические процедуры, сопровождающиеся риском повреждения слизистой оболочки полости рта или дёсен
- тонзиллэктомия, аденоидэктомия
- дилатация пищевода или склеротерапия варикозных вен пищевода
- оперативные вмешательства или манипуляции при обструкции желчевыводящих путей
- трансуретральная резекция предстательной железы
- вмешательства на мочеиспускательном канале (в том числе его бужирование)
- литотрипсия
- гинекологические операции и роды при наличии инфекции.
При операциях, во время которых антибиотики назначают по общим показаниям в соответствии с наиболее вероятными возбудителями, дополнительная антимикробная профилактика ИЭ не нужна.
Рекомендуемые схемы антимикробной профилактики инфекционного эндокардита (European Society of Cardiology Guidelines, 2004)
При медицинских процедурах в полости рта, дыхательных путях, пищеводе антибактериальная профилактика направлена в первую очередь против стрептококков зеленящей группы и НАСЕК-группы:
при отсутствии аллергии на бензилпенициллин амоксициллин 2г (детям 50мг/кг) внутрь за 1ч до процедуры или амоксициллин или ампициллин 2г (детям 50мг/кг) внутривенно за 30-60мин до процедуры при невозможности приёма препарата внутрь
при аллергии на бензилпенициллин клиндамицин 600мг (детям 20мг/кг) или азитромицин или кларитромицин 500мг (дети 15мг/кг) за 1ч до процедуры или цефалексин 2г (дети 50мг/кг) внутрь за 1ч до процедуры.
При медицинских процедурах на мочеполовых органах или желудочно-кишечном тракте антибактериальная профилактика направлена на энтерококки, Streptococcus bovis, Enterobacteriaceae:
при отсутствии аллергии на бензилпенициллин больным группы высокого риска амоксициллин или ампициллин 2г внутривенно + гентамицина 1,5мг/кг в/в за 30-60мин до процедуры, через 6ч амоксициллин или ампициллин 1г внутрь или ампициллин 1г в/в или в/м
больным группы среднего риска амоксициллин или ампициллин 2г (детям 50мг/кг) в/м или в/в за 30—60мин до процедуры или амоксициллина 2г (детям 50мг/кг) внутрь за 1ч до процедуры
при аллергии на бензилпенициллин больным группы высокого риска ванкомицина 1г (детям 20мг/кг) в/в за 1-2ч до процедуры + гентамицина 1,5мг/кг в/в или в/м
больным группы среднего риска ванкомицина 1г (детям 20мг/кг) в/в за 1 -2ч до процедуры.
Больные, нуждающиеся в профилактике ИЭ, должны быть информированы об индивидуальном риске ИЭ и основных ситуациях, когда необходимо профилактическое применение антибиотиков. Необходимы санация полости рта и ежедневная личная гигиена полости рта. Показана консультация стоматолога, осведомлённого о показаниях к профилактике ИЭ у больного не реже 1р в год. Больные должны быть предупреждены о необходимости обращения к врачу при появлении лихорадки.
КЛАССИФИКАЦИЯ
по течению:
— острый и подострый ИЭ (при раннем назначении антибактериальной терапии различия в течении острого и подострого ИЭ зачастую размыты, поэтому эксперты Европейского общества кардиологов [2004] не рекомендуют дифференцировать острые и подострые формы в диагнозе ИЭ).
по предшествующему состоянию поражённых структур сердца:
— ИЭ на естественных клапанах первичный (на интактных клапанах) и вторичный (на ранее повреждённых клапанах сердца)
- ИЭ протеза клапанов на ранний (до 1 года после операции на сердце) и поздний.
особые формы ИЭ:
- ИЭ наркоманов
- нозокомиальный ИЭ (возникший позднее 72ч после госпитализации или непосредственно связанный с инвазивными процедурами в стационаре, перенесёнными в течение предшествовавших 6мс).
В соответствии с рекомендациями Европейского общества кардиологов (2004), при постановке диагноза ИЭ следует учитывать
- наличие или отсутствие ИЭ в прошлом:
ИЭ впервые возникший
повторный ИЭ или рецидив ИЭ (новый эпизод ИЭ после излечения инфекции при предшествующем эпизоде ИЭ)
активность процесса:
активный ИЭ характеризуется лихорадкой в сочетании с выявлением микроорганизмов в крови или материале, полученном во время операции
перенесённый (излеченный) ИЭ
- диагностический статус:
достоверный ИЭ (в соответствии с модифицированными диагностическими критериями ИЭ — Duke, 2000)
возможный ИЭ (имеются клинические основания подозревать ИЭ, но поражение эндокарда ещё не доказано, или потенциальный диагноз ИЭ рассматривается при дифференциальной диагностике у лихорадящего больного — неисключённый ИЭ)
- локализацию ИЭ:
ИЭ с поражением митрального клапана
ИЭ с поражением аортального клапана
ИЭ с поражением трикуспидального клапана
ИЭ с поражением клапана лёгочной артерии.
пристеночный ИЭ
- микробиологическую характеристику ИЭ:
вид возбудителя - стрептококковый ИЭ, стафилококковый ИЭ..
ИЭ с негативной гемокультурой
серологически негативный ИЭ
ПЦР-негативный ИЭ
гистологически негативный ИЭ.
ДИАГНОСТИКА
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Своевременность диагноза ИЭ зависит от раннего клинического подозрения, возникающего при совокупности соответствующих симптомов, и высокой степени настороженности в отношении этого угрожающего жизни заболевания у врача-терапевта, к которому первоначально обращаются большинство больных ИЭ.
Клинические проявления ИЭ представляют разные сочетания симптомов:
- бактериемии и системного воспаления
- признаков вальвулита
- периферических эмболии
- иммунокомплексных сосудистых и органных поражений.
Диагностика ИЭ трудна в связи с полиморфизмом дебютов заболевания, разнообразием клапанной и внесердечной симптоматики и вариабельностью течения. В типичных случаях диагностику ИЭ основывают на сочетании проявлений клапанной патологии и бактериемии (с признаками системного воспаления).
Наиболее чувствительным, но неспецифическим симптомом ИЭ служит лихорадка. Повышение температуры наблюдают почти у всех больных ИЭ (в 90-97% случаев), к диагностическим признакам ИЭ относят лихорадку выше 38°С с ознобом и потом. ИЭ может начаться как острая, быстро прогрессирующая инфекция, но чаще как подострое заболевание с невысокой лихорадкой и только неспецифическими симптомами. При подозрении на ИЭ рекомендуют проводить термометрию каждые 3ч в течение дня, так как можно наблюдать кратковременные «свечки» температуры. У лихорадящих больных ИЭ часто выявляют умеренную спленомегалию, которая быстро регрессирует на фоне эффективного лечения инфекции, возможно снижение массы тела.
Шум клапанной регургитации - один из прямых клинических симптомов эндокардита (особенно важны новый шум регургитации или увеличение интенсивности ранее имевшегося шума регургитации). Особенности шумов — быстрая динамика, непостоянство шума, иногда музыкальный оттенок шума. При остром ИЭ шум регургитации появляется чаще на 1-й неделе заболевания, при подостром ИЭ позднее, как правило, не ранее 2нд от начала болезни. Однако шумы не обязательны и могут не появляться длительно до развития перфорации или разрыва створки. Шум может отсутствовать при ИЭ трикуспидального клапана или при пристеночном ИЭ. При эндокардите клапанов левых отделов сердца выраженная регургитация, возникающая остро или подостро, проявляется нарастающей инспираторной одышкой, кашлем, иногда кровохарканьем, ночными приступами удушья, вплоть до развития отёка лёгких. Симптомы сердечной недостаточности наблюдают у 30-50% больных ИЭ, и, помимо клапанной регургитации, они могут быть обусловлены присоединением миокардита (в 12—23% случаев). Возможно также присоединение перикардита (в 5—8% случаев).
ИЭ нужно рассматривать при дифференциальной диагностике у каждого больного с лихорадкой длительностью более 1нд и сердечным шумом регургитации. При опросе больного важно выяснить, относится ли он к группе риска развития ИЭ и есть ли связь начала заболевания с состояниями, которые могли вызвать бактериемию.
Более чем у половины больных ИЭ на разных этапах заболевания наблюдают внесердечные проявления, обусловленные тромбоэмболиями или иммунопатологическими механизмами (табл. 65).
Таблица 65. Внесердечные проявления инфекционного эндокардита (частота по разным данным)


Поражение почек считают классическим, и иногда оно служит первым симптомом ИЭ. ИЭ необходимо рассматривать в дифференциальной диагностике острого или подострого нефритического синдрома, особенно с обратимой или быстро прогрессирующей почечной недостаточностью. Нефротический синдром, макрогематурия, выраженная азотемия при ИЭ возникают редко (4-5%), но могут затруднять диагностику ИЭ. Довольно часто наблюдают эмболии почечных сосудов с развитием инфарктов почек, поэтому ИЭ нужно учитывать в дифференциальной диагностике гематурии и боли в пояснице.
В диагностике ИЭ может помочь выявление характерных поражений кожи — узелков Ослера на подушечках пальцев, васкулита периферических артерий, проявляющегося петехиальной мелкоточечной геморрагической сыпью, локализованной преимущественно на голенях, кровоизлияний в кожу пальцев рук и стоп, цвет кожи «кофе с молоком», а также типичных поражений глаза (конъюнктивальные кровоизлияния). Геморрагический васкулит, особенно в сочетании с гломерулонефритом, требует обязательного рассмотрения ИЭ в дифференциальной диагностике, при этом первоначальный, даже выраженный ответ васкулита на иммуносупрессивную терапию, не исключает инфекции как причины васкулита.
Симптомы поражения костно-мышечной системы типичны для ИЭ, артриты (артралгии) и миалгии наблюдаются примерно у 1/4 больных. В последнее время высказывают мнения о необходимости рассматривать вероятность ИЭ в дифференциальной диагностике low back pain в связи с описанием в дебюте ИЭ случаев сакроилеита, спондилодисцита, в том числе септического, и остеомиелита позвонков.
Тромбоэмболии в сосуды ЦНС, коронарные сосуды, сосуды почек, кишечника, селезёнки, реже в магистральные сосуды могут быть первыми проявлениями ИЭ. Неврологические осложнения наблюдаются в 5-19% случаев. Многоочаговость поражения мозга (по данным КТ или МРТ) позволяет заподозрить эмбологенный характер поражения вещества головного мозга.
Сочетание лихорадки и нарушения мозгового кровообращения у молодого пациента нужно рассматривать как проявление инфекционного эндокардита до тех пор, пока не будет доказана другая этиология этой комбинации.
Множественные септические инфаркты лёгких с плевральными болями типичны для трикуспидального ИЭ. При выявлении множественных абсцессов лёгких у молодых больных, особенно у наркоманов, ИЭ должно рассматривать в дифференциальной диагностике в первую очередь.
Неправильная оценка внесердечных симптомов ИЭ, нередко имитирующих другие заболевания (это относится к маскам ИЭ — почечной, неврологической, гематологической, лёгочной, маске системной патологии), может вести к диагностическим ошибкам, а с другой стороны, при должной настороженности врача внесердечные проявления могут быть первым ключом к диагнозу ИЭ.
КЛИНИЧЕСКИЕ СИТУАЦИИ, ПОЗВОЛЯЮЩИЕ ЗАПОДОЗРИТЬ ИНФЕКЦИОННЫЙ ЭНДОКАРДИТ
Основные ситуации, позволяющие заподозрить ИЭ:
- необъяснимая лихорадка более 1нд + шум регургитации (особенно вновь появившийся)
- необъяснимая лихорадка более 1нд + впервые развившиеся симптомы сердечной недостаточности
- необъяснимая лихорадка более 1нд + типичные проявления на коже (узелки Ослера, пятна Жаневье) и конъюнктиве (пятна Лукина)
- необъяснимая лихорадка + положительная гемокультура (с характерным для ИЭ возбудителем)
- необъяснимая лихорадка более 1нд у больных, относящихся к группе риска ИЭ (пороки сердца, протезы клапанов или других внутрисердечных структур, инъекционные наркоманы)
необъяснимая лихорадка более 1нд, связанная с недавно выполненными процедурами, способными вызвать бактериемию (интервал между процедурой и появлением лихорадки составляет менее 2нд)
- сепсис неясного происхождения.
Особые ситуации, вызывающие подозрение на ИЭ:
- тромбоэмболии из неустановленного источника
- необъяснимые инсульты или субарахноидальное кровоизлияние у молодых
- множественные абсцессы лёгких у наркоманов
- периферические абсцессы неясной этиологии (абсцессы почек, селезёнки, тел позвонков, эндогенный эндофтальмит)
- необъяснимая лихорадка более 1нд + впервые развившиеся нарушения атриовентрикулярной и желудочковой проводимости
- протез клапана + новая дисфункция протеза.
Ситуации, требующие рассмотрения ИЭ в дифференциальной диагностике:
- острый или быстро прогрессирующий гломерулонефрит
- необъяснимая лихорадка более 1нд + боль в нижней части спины
- гематурия + боль в спине, подозрение на инфаркт почки
- геморрагический васкулит.
Диагноз ИЭ достоверен, если при септицемии или системном воспалении имеется характерное поражение эндокарда. Если ИЭ подозревают, но вовлечение эндокарда пока ещё не доказано, эндокардит рассматривают как вероятный.
ДИАГНОСТИЧЕСКИЕ КРИТЕРИИ ИНФЕКЦИОННОГО ЭНДОКАРДИТА
Общепризнанны диагностические критерии ИЭ, разработанные Службой эндокардита Университета Duke (см. ниже). Больные с подозрением на ИЭ должны быть клинически обследованы с использованием этих критериев как первичной диагностической схемы. Диагноз возможного ИЭ часто ставят по клинике или факторам риска ещё до того, как будут готовы результаты посева крови. Выявление вегетации или нарастающей клапанной недостаточности при эхоКГ часто завершает диагностику достоверного ИЭ. Больные с «ИЭ, исключённым по недостаточному количеству критериев», нуждаются в дальнейшем наблюдении, так как многие признаки ИЭ могут проявиться позднее.
ДИАГНОСТИЧЕСКИЕ КРИТЕРИИ ИНФЕКЦИОННОГО ЭНДОКАРДИТА (в модификации J.Li, одобренные Американской кардиологической ассоциацией Университета Duke в 2005г.)
1.Достоверный инфекционный эндокардит.
Патоморфологические признаки, достаточно 1 критерия:
- микроорганизмы, выявленные при бактериологическом или гистологическом исследовании вегетации, эмболов, образцов из внутрисердечных абсцессов
- вегетации или внутрисердечные абсцессы, подтверждённые гистологическим исследованием, выявившим активный эндокардит.
Клинические критерии, достаточно 2 больших критерия или 1 большой и 3 малых критерия или 5 малых критериев.
2.Возможный инфекционный эндокардит
Клинические критерии, достаточно 1 большой и 1 малый критерий или 3 малых критерия.
3.Исключённый инфекционный эндокардит.
Клинические критерии, достаточно:
- несомненный альтернативный диагноз, объясняющий симптомы болезни или исчезновение симптомов ИЭ на фоне лечения антибиотиками менее чем за 4дня
- отсутствие патологических подтверждений ИЭ при операции или аутопсии при терапии антибиотиками менее 4 дней
- недостаточное количество критериев вероятного ИЭ, перечисленных выше.
КЛИНИЧЕСКИЕ КРИТЕРИИ ИНФЕКЦИОННОГО ЭНДОКАРДИТА
Большие критерии:
- положительная гемокультура (типичные для ИЭ возбудители, выделенные из двух раздельно взятых проб крови): зеленящие стрептококки, Streptococcus bovis или НАСЕК-группа (Haemophilus spp., Actinobacillus actinimycetemcomitans, Cardiobactehum hominis, Eirenella spp., Kingella kingae), или Staphylococcus aureus, или внебольничные энтерококки при отсутствии первичного очага
- согласующиеся с ИЭ возбудители, выделенные из гемокультуры при соблюдении условия - как минимум 2 положительных результата исследования проб крови, взятых с интервалом не менее 12ч, или 3 положительных результата из 3, или большинство положительных результатов из 4 проб крови и более (интервал между взятием первой и последней пробы должен составлять как минимум 1ч)
- однократное выявление Coxiella burnetii или титра IgG к этому микроорганизму >1:800.
- доказательства поражения эндокарда:
- положительные данные трансторакальной эхокардиографии (трансэзофагеальной при наличии протезированных клапанов у пациентов с возможным ИЭ по клиническим критериям или выявлении осложнений в виде околоклапанного абцесса): свежие вегетации на клапане, или поддерживающих его структурах, или имплантированном материале, или абсцесс, или новая дисфункция клапанного протеза
- вновь сформированная клапанная регургитация (нарастание или изменение имевшегося сердечного шума не учитывается).
Малые критерии:
- предрасположенность: предрасполагающие сердечные состояния или частые внутривенные инъекции (в том числе наркомания и токсикомания)
- температура тела 38С и выше
- сосудистые феномены: эмболии крупных артерий, септические инфаркты лёгкого, микотические аневризмы, внутримозговые кровоизлияния, геморрагии на переходной складке конъюнктивы и повреждения Жаневье
- иммунологические феномены: гломерулонефрит, узелки Ослера, пятна Рота и ревматоидный фактор
- микробиологические данные: положительная гемокультура, которая не соответствует большому критерию (исключая однократные позитивные культуры коагулаза-стафилококков, обычно эпидермального стафилококка, и микроорганизмов, не являющихся причиной ИЭ), или серологическое подтверждение активной инфекции, обусловленной потенциальным возбудителем ИЭ (Coxiella burnetii, бруцеллы, хламидии, легионеллы).
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
При подозрении на ИЭ больной должен быть госпитализирован для обследования и лечения. ЭхоКГ и микробиологическое исследование крови необходимо проводить при подозрении на ИЭ не позднее 12ч после первичного осмотра.
ЭХОКАРДИОГРАММА
Трансторакальная эхоКГ ТТЭ рекомендована всем пациентам с подозрением на ИЭ. Диагностическое значение имеет выявление вегетации, связанных с клапанным или пристеночным эндокардом, особенно при локализации в типичных местах (по траектории потока регургитации) или связанных с имплантированным протезным материалом без другого анатомического объяснения, внутрисердечных абсцессов или фистул, новой клапанной регургитации, нового дефекта клапанного протеза.
Чреспищеводное эхоКГ-исследование ЧПЭ имеет большую чувствительность для выявления вегетации и абсцессов и показано при ИЭ протезированных клапанов, при негативном результате ТТЭ у больных с высокой клинической вероятностью ИЭ и осложнениях ИЭ. ТТЭ и ЧЭЭ могут давать ложноотрицательные результаты, если вегетации маленькие или произошёл отрыв вегетации с эмболией, поэтому, если подозрение на ИЭ остаётся, через 7-10дней после первой ЧПЭ показано повторное исследование.
МИКРОБИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ КРОВИ
Посев крови. Для выявления бактериемии рекомендовано как минимум трижды производить раздельный забор венозной крови в количестве 5—10мл с интервалом в 1ч независимо от температуры тела. Если пациент получал непродолжительный курс антибиотиков, рекомендуют делать посев через 3дня после отмены антибиотиков. После продолжительного приёма антибиотиков гемокультура может быть негативной в течение 6—7дней и более. При выявлении возбудителя необходимо определить его чувствительность к антибиотикам.
Серологические методики и ПЦР-исследования эффективны при диагностике ИЭ, вызванного труднокультивируемыми Bartonella, Legionella, Chlamydia, Coxiella bumetti и Tropheryma.
ДРУГИЕ ЛАБОРАТОРНЫЕ И ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Общий анализ крови: типичны нормохромная нормоцитарная анемия (при подостром ИЭ), лейкоцитоз или умеренная лейкопения, сдвиг лейкоцитарной формулы влево, тромбоцитопения (в 20% случаев), увеличение СОЭ выше 30мм/ч.
Биохимический анализ крови: диспротеинемия с увеличением уровня гамма-глобулинов, повышение С-реактивного белка, креатинин (контроль функции почек).
Ревматоидный фактор в сыворотке крови обнаруживается у 35—50% больных с подострым ИЭ.
Общий анализ мочи: гематурия, протеинурия разной выраженности, эритроцитарные цилиндры при нефритическом синдроме.
Коагулограмму, исследование иммунного статуса пациента проводят при наличии показаний.
ЭКГ: при присоединении миокардита или абсцесса миокарда возможно появление нарушений проводимости (атриовентрикулярная или синоатриальная блокада), реже пароксизмы предсердной тахикардии или фибрилляции предсердий. При эмбологенном инфаркте миокарда — инфарктные изменения ЭКГ.
Рентгенография грудной клетки. Для ИЭ правых отделов сердца характерны множественные или «летучие» инфильтраты в лёгких (с образованием полостей) в результате септических эмболии.
УЗИ селезёнки и почек (спленомегалия, инфаркт селезёнки, инфаркт почки).
КТ органов грудной клетки и органов брюшной полости, головного мозга (по показаниям).
Колоноскопия показана при ИЭ, вызванном S.bovis, для исключения опухоли или других повреждений слизистой толстой кишки.
ПРИМЕРЫ ФОРМУЛИРОВОК ДИАГНОЗА
Инфекционный эндокардит подострый первичный, вызванный S.viridans, с поражением митрального клапана, недостаточность митрального клапана (митральная регургитация 3), НК2А, ФK2(NYHA), острый гломерулонефрит.
Инфекционный эндокардит подострый вторичный с поражением аортального клапана, врождённый двустворчатый аортальный клапан, недостаточность аортального клапана (аортальная регургитация 2), НК1, ФKl(NYHA).
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Вероятность ИЭ следует всегда учитывать при проведении дифференциальной диагностики лихорадки неясной этиологии. Недостаточность специфических признаков, особенно при отсутствии предрасполагающего заболевания сердца, определяет необходимость широкого диагностического поиска многих острых и хронических инфекций, ревматических, иммунологических и злокачественных заболеваний. Положительная гемокультура у лихорадящего больного без сердечных проявлений делает вероятным диагноз ИЭ, но до выявления клапанной патологии дифференциальная диагностика проводится с септическими состояниями другой этиологии. Отрицательный результат эхоКГ требует более тщательного поиска альтернативных источников лихорадки и сепсиса. Однонаправленное обследование до установления убедительного диагноза ИЭ недопустимо. Основные заболевания, которые следует включать в дифференциально-диагностический ряд:
- ревматическая лихорадка
- системная красная волчанка
- неспецифический аортоартериит (болезнь Такаясу), другие аортиты;
- лимфопролиферативные заболевания
- злокачественные новообразования
- хронический пиелонефрит, обострение
- тромбоэмболия лёгочной артерии (у больных с клапанными пороками сердца)
- миксома левого предсердия
- нарушение мозгового кровообращения
- небактериальный (марантический) тромбоэндокардит.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Кардиохирург — при появлении показаний к хирургическому лечению.
Невропатолог (при неврологических осложнениях).
Нефролог (при быстро прогрессирующем гломерулонефрите, почечной недостаточности, нефротическом синдроме).
Окулист (осмотр глазного дна).
Стоматолог (по показаниям).
ЛЕЧЕНИЕ
ЦЕЛИ ЛЕЧЕНИЯ
Основа лечения ИЭ — подавление внутрисердечной инфекции антибиотиками. Антибиотики не следует назначать до первичного взятия бактериологических посевов крови. Выбор схемы лечения определяется выделенным возбудителем ИЭ. Если возбудитель при посеве крови не выявлен или необходимо неотложное начало терапии, применяют режимы эмпирической терапии. Рекомендуемая длительность лечения антибиотиками не менее 4—6нд, подсчёт дней курса лечения антибиотиками должен начинаться с первого дня, когда культура крови станет негативной.
Хирургическое удаление поражённого клапана или вегетации (вегетэктомия) с протезированием или пластикой клапана при неэффективности лечения антибиотиками или при необходимости коррекции сформировавшегося порока сердца по завершении 4-6-недельного курса антибактериальной терапии. Решение о хирургическом лечении должно быть индивидуальным для каждого больного и приниматься с участием кардиолога и кардиохирурга.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Лечение ИЭ проводится в стационаре, все больные ИЭ или при подозрении на ИЭ должны быть госпитализированы:
больные со стабильной гемодинамикой и низким риском осложнений — в кардиологическое или терапевтическое отделение
больные ИЭ с гипотензией, выраженной сердечной недостаточностью и другими угрожающими жизни состояниями — в отделение интенсивной терапии.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Состояния, требующие рассмотрения вопроса о хирургическом лечении при ИЭ:
- сердечная недостаточность
- грибковый ИЭ
- ИЭ, вызванный бактериями, резистентными к антибиотикам
- левосторонний ИЭ, вызванный грамотрицательными бактериями.
- персистирующая бактериемия с положительной гемокультурой через неделю после начала лечения антибиотиками
- 1 или более эмболический эпизод в течение первых 2нд терапии антибиотиками
- эхоКГ признаки деструкции клапана — перфорации, разрыв, фистула или крупный паравальвулярный абсцесс, другие показания — крупная, более 10 мм, вегетация на передней створке митрального клапана, сохранение вегетации после эпизода эмболии и увеличение вегетации в размере, несмотря на соответствующую антимикробную терапию
- ИЭ протеза.
Критерии выписки больного из стационара:
- завершение курса антибиотикотерапии
- отсутствие лихорадки в течение 3дней после отмены антибиотиков
- отрицательная гемокультура через 7дней после отмены антибиотиков
- стабильная гемодинамика.
ДАЛЬНЕЙШЕЕ АМБУЛАТОРНОЕ ВЕДЕНИЕ БОЛЬНЫХ, ПЕРЕНЁСШИХ ИНФЕКЦИОННЫЙ ЭНДОКАРДИТ
Динамическое наблюдение за пациентом после выписки из стационара осуществляет кардиолог поликлиники. В течение первых 6мс необходимы ежемесячные осмотры с контролем:
- возврата инфекции — новая лихорадка, ознобы, другие проявления интоксикации диктуют немедленное обследование, включая не менее 3серий посевов крови, исключено эмпирическое назначение антибиотиков до выяснения причин лихорадки
- усиления или нового появления сердечной недостаточности: при нарастании недостаточности кровообращения показаны эхоКГ и консультация кардиохирурга
- проявления побочных токсических эффектов лечения антибиотиками — симптомов ототоксичности, связанных с лечением аминогликозидами, псевдомембранозного колита, вызванного избыточным ростом Clostridium difficile (диарея может появиться вплоть до 4нд после последней дозы антибиотиков).
В последующем осмотры проводят 2р в год, эхоКГ проводят через 3 и 6мс после выписки, лабораторные исследования (общий анализ крови, биохимический анализ крови, общий анализ мочи) 1р в 3мс на протяжении первого года после перенесённого ИЭ.
В дальнейшем в течение всей жизни больные нуждаются в наблюдении в отношении рецидива ИЭ и отдалённого нарастания клапанной дисфункции. Больным необходимо проводить профилактику ИЭ, ежегодные эхоКГ, при необходимости консультация кардиохирурга.
ОБУЧЕНИЕ ПАЦИЕНТА
Больные, перенёсшие ИЭ, должны быть осведомлены о правилах профилактики ИЭ, симптомах рецидива ИЭ и необходимости обращения в поликлинику при появлении лихорадки.
ПРОГНОЗ
Прогноз при ИЭ остается серьёзным. Если при ИЭ правых отделов сердца у наркоманов, вызванном S.aureus, при своевременном начале лечения возможно выздоровление более 85% больных, то при грибковом эндокардите смертность достигает 80%. Факторы риска повышенной госпитальной и ранней (в течение 6 мес после выписки) летальности: сахарный диабет; ИЭ, вызванный S. aureus или стрептококками, не относящимися к группе зеленящего стрептококка, тромбоэмболические или неврологические осложнения, сердечная недостаточность, отсутствие оперативного вмешательства при наличии показаний к нему.
Основные причины смерти при ИЭ:
- прогрессирующая сердечная недостаточность
- тромбоэмболии
- септический шок, полиорганная недостаточность
- почечная недостаточность.
ИСТОЧНИКИ
1. Baddour L.M., Wilson W.R., Bayer A.S. et al. Infective endocarditis: diagnosis,
antimicrobial therapy, and management of complications: a statement for
healthcare professionals from the Committee on Rheumatic Fever, Endocarditis,
and Kawasaki Disease, Council on Cardiovascular Disease in the Young, and the
Councils on Clinical Cardiology, Stroke, and Cardiovascular Surgery and Anesthesia,
American Heart Association: endorsed by the Infectious Diseases Society of
America. Circulation. 2005; 11 l(23):e394-434.
2. Horstkotte D., Follath F., Gutschik E. et al. Guidelines on prevention, diagnosis and treatment of infective endocarditis executive summary; the task force on infective endocarditis of the European society of cardiology. Europ. Heart J. 2004:25 3:267-276.
МИОКАРДИТ
Миокардит — иммунно-воспалительное поражение сердечной мышцы, сопровождающееся её дисфункцией при тяжёлом и среднетяжёлом течении заболевания.
КОДЫ МКБ-10
I40.0 Инфекционный миокардит
I40.1 Изолированный миокардит
I40.8 Другие виды острого миокардита
I40.9 Острый миокардит неуточнённый
I41.0 Миокардит при бактериальных болезнях, классифицированных в других рубриках
I41.2 Миокардит при других инфекционных и паразитарных болезнях, классифицированных в других рубриках
I41.8 Миокардит при других болезнях, классифицированных в других рубриках.
ЭПИДЕМИОЛОГИЯ
Истинная распространённость миокардита неизвестна, так как у большинства больных заболевание протекает асимптоматически или субклинически.
Признаки миокардита выявляются примерно в 1-2% всех патологоанатомических исследований и в 10% случаев внезапной смерти.
У мужчин миокардит возникает чаще, чем у женщин, — 1,5:1.
ПРОФИЛАКТИКА
Всем лицам, имеющим отягощенный семейный анамнез по случаям внезапной смерти или сердечной недостаточности в молодом возрасте у родственников, необходимо проведение периодической (не реже 1р в год) записи ЭКГ. Им следует избегать профессиональных занятий спортом и профессий, связанных с перегрузками. Во время эпидемий вирусных инфекций применять все профилактические меры, а при заболевании — постельный режим.
СКРИНИНГ
Выявление бессимптомных и субклинических миокардитов увеличивается при записи ЭКГ во время профессиональных осмотров, отбора военнослужащих на призывных комиссиях, у участников спортивных соревнований и др.
Миокардит следует исключать в каждом случае регистрации на ЭКГ изменений сегмента ST и зубца Т, нарушений ритма и проводимости.
Для скрининга больных с миокардитом будет значимым проведение ЭКГ-исследования при диспансерном осмотре 1р в год всем группам населения и каждый раз после вирусной инфекции дыхательных путей или гастроэнтерита (например, при визите больного в поликлинику для закрытия листка нетрудоспособности).
КЛАССИФИКАЦИЯ
Классификация по этиологическому признаку.
Основные причины развития миокардитов.
Вирусы Вирусы Коксаки Аденовирусы ECHO Вирус гепатита С Вирус иммунодефицита человека Вирус гриппа Вирус краснухи Вирус ветряной оспы и опоясывающего герпеса Вирус эпидемического паротита Вирус Эпштейна-Барра
Бактерии Mycoplasma pneumoniae Treponema pallidwn Corynebacterium diphtheriae Streptococcus pyogenes Staphylococcus aureus Сальмонеллы Хламидии
Грибы
Aspergillus Candida Coccidiodes Cryptoccocus Histoplasma
Лекарственные препараты Сульфаниламиды Цефалоспорины Пенициллины Стрептомицин Диуретики Дигоксин Трициклические антидепрессанты Добутамин
Заболевания Амилоидоз Болезнь Такаясу Гранулематоз Вегенера
В подавляющем большинстве случаев встречают вирусные миокардиты, среди них чаще наблюдаются миокардиты, вызванные вирусами Коксаки и аденовирусами.
Классификация по объёму поражения миокарда
Очаговый миокардит: воспалительные изменения затрагивают преимущественно одну из стенок левого желудочка, что проявляется в нарушениях ритма, проводимости или изменениях ST и Т в нескольких отведениях ЭКГ и/или появлении зон гипо-, дис-, акинеза на эхоКГ.
Диффузный миокардит: в процесс вовлечены все стенки левого желудочка, что может приводить к снижению сократимости (уменьшение фракции выброса по данным эхоКГ) и клиническим проявлениям сердечной недостаточности.
Классификация в зависимости от стадии заболевания
Острый миокардит. Первые 4дня вирусного инфицирования. Острый миокардит характеризуется виремией. Гистологически некроз кардиомиоцитов. Иммунологически повышение провоспалительных цитокинов.
Подострый миокардит. Первые 2нд заболевания. Виремия может не определяться. Гистологически инфильтрация миокарда мононуклеарными клетками. Иммунологически активация Т- и В-лимфоцитов.
Хронический миокардит. Виремия не определяется. Гистологически фиброз, воспалительная инфильтрация.
Классификация в зависимости от тяжести заболевания
Лёгкая форма миокардита протекает с нормальными размерами и сократимостью левого желудочка, без клинических признаков сердечной недостаточности.
Среднетяжёлая форма характеризуется обратимой дилатацией полостей сердца.
Тяжёлое течение наблюдают у больных с выраженной застойной сердечной недостаточностью.
ДИАГНОСТИКА
Диагноз миокардита — один из наиболее сложных в кардиологии, что связано с отсутствием специфических клинических проявлений.
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Клинические проявления миокардитов чрезвычайно разнообразны и колеблются от асимптоматического течения болезни (чаще всего) или неспецифических изменений на ЭКГ до быстрого развития острой левожелудочковой недостаточности в виде отёка лёгких или кардиогенного шока.
Связь с перенесённой инфекцией
До 80% больных с подтверждённым в дальнейшем миокардитом имеют в анамнезе продромальный период заболевания, протекающий в виде вирусной инфекции, чаще верхних дыхательных путей (ОРВИ, грипп, фарингит, ангина) или гастроэнтерита. Могут быть выявлены симптомы:
- лихорадочное состояние
- миалгии, артралгии
- респираторные проявления (фарингит, ринит, трахеит)
- гастроэнтерит
- другие.
Настороженным на возможное развитие миокардита нужно быть после заболевания гепатитом, менингоэнцефалитом, ветряной оспой.
Клинические проявления миокардита могут наступать спустя 7—10дней после вирусной инфекции или в течение её.
ЖАЛОБЫ
Для миокардита не описано каких-либо специфических жалоб больного. Наиболее частые жалобы:
одышка
снижение толерантности к нагрузкам, слабость
ощущения сердцебиения, перебоев
кардиалгии
отёки на ногах
другие.
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
В большинстве случаев миокардит протекает без клинических проявлений.
Результаты физикального обследования зависят от объёма поражения миокарда.
Очаговый миокардит не приводит к каким-либо изменениям status praesens, если очаг поражения не затрагивает проводящую систему. Даже небольшой очаг в проводящей системе может привести к выраженным разнообразным нарушениям ритма и проводимости/
Диффузный миокардит протекает клинически как сердечная недостаточность по малому или по обоим кругам кровообращения.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Общий анализ крови d большинстве случаев не изменён.
Биохимический анализ крови. В связи с нарушением целостности цитоплазматической мембраны кардиомиоцитов в биохимическом анализе крови у 28-80% (в среднем 35%) больных с миокардитом повышаются кардиоспецифические ферменты:
креатинфосфокиназа (общая и МВ-фракция)
тропонин Т (чувствительность 53%, специфичность 94%)
тропонин I (чувствительность 34%, специфичность 89%).
Повышение кардиоспецифических ферментов, особенно в сочетании с кардиалгиями и изменениями на ЭКГ, требует от врача исключения инфаркта миокарда.
ЭЛЕКТРОКАРДИОГРАФИЯ
Один из ведущих методов диагностики миокардитов. Наиболее часто наблюдают следующие изменения ЭКГ:
- неспецифические изменения сегмента ST и зубца Т; изменения сегмента ST и зубца Т при миокардите могут требовать от врача исключения острой коронарной патологии, прежде всего инфаркта миокарда, так как могут наблюдаться подъём сегмента ST выше изолинии в 2 и более отведениях ЭКГ, депрессия сегмента ST, формирование патологического зубца Q
- нарушения проводимости (атриовентрикулярная блокада различной степени, нарушения внутрижелудочкового проведения)
- нарушения ритма.
РЕНТГЕНОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ ГРУДНОЙ КЛЕТКИ
При миокардите может быть информативно, но малоспецифично:
- увеличение дуги левого желудочка
- увеличение кардиоторакального индекса
- застой в малом круге кровообращения.
ЭХОКАРДИОГРАФИЯ
Показана всем больным с подозрением на миокардит. Наиболее частые находки при эхоКГ-исследовании у больных с миокардитом:
- снижение фракции выброса левого желудочка (до 69% больных)
- выявление зон гипо-, дис- и акинеза, т.е. зон пониженной, необычной или отсутствие локальной сократимости стенок левого желудочка (до 64% больных)
- нормальная сократимость и размеры левого желудочка
- утолщение перикарда.
В тех случаях, когда эхоКГ-исследование проводят в специализированном кардиологическом лечебно-диагностическом учреждении, может быть определено изменение плотности и эластичности миокарда левого желудочка. Специфичность этих показателей достигает 90%, чувствительность 100%, но рутинно учитывать эти характеристики невозможно.
СЦИНТИГРАФИЯ МИОКАРДА
Проводят в тех случаях, когда всё остальное комплексное обследование больного не позволяет точно верифицировать диагноз.
БИОПСИЯ МИОКАРДА
Наиболее точный метод диагностики миокардита. Ограничения метода — инвазивность, необходимость специального оборудования и медицинского персонала и отсутствие 100% информативности. (При 4—5 биопсийных образцах информативность составляет 50%, при 17 биопсийных образцах 79%.) Характерными гистологическими признаками миокардита служат некроз кардиомиоцитов и прилегающая воспалительная клеточная инфильтрация.
ВИРУСОЛОГИЧЕСКАЯ ДИАГНОСТИКА
Вирусную инфекцию (Коксаки В1—5, вирусы гриппа А и В, парагриппа, аденовирусы и др.) документируют с помощью серологических методов (если такая возможность существует). Титр антител увеличивается в 4раза и более и постепенно уменьшается при выздоровлении.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Наиболее часто миокардит нужно дифференцировать от инфаркта миокарда, дилатационной кардиомиопатии.
Инфаркт миокарда. Сходство: боли в грудной клетке, изменения ST- Т на ЭКГ, повышение кардиоспецифических ферментов. Различия: больные с инфарктом миокарда или подозрением на другие формы острого коронарного синдрома, как правило, имеют несколько факторов риска, прежде всего дислипидемию, курение, артериальную гипертонию и др., для инфаркта миокарда более характерны изменения в синергичных отведениях ЭКГ, например II, III, aVF или I, aVL, V5—V6, при развитии инфаркта миокарда изменения на ЭКГ и уровень кардиоспецифических ферментов крови меняются в определённой последовательности, при развитии инфаркта миокарда изменения на ЭКГ, как правило, никогда не возвращаются к исходным данным, при миокардите при длительном наблюдении за больным (несколько месяцев) может наблюдаться полная нормализация ЭКГ.
Дилатационная кардиомиопатия. Сходство: клинические признаки застойной сердечной недостаточности, на ЭКГ неспецифические изменения ST—T, эхоКГ дилатация полостей сердца и снижение сократимости миокарда левого желудочка (уменьшение фракции выброса левого желудочка). Различия: у больных с миокардитом возможна анамнестическая связь с перенесённой вирусной инфекцией, у больных с миокардитом можно наблюдать воспалительные изменения в клиническом анализе крови, у больных с миокардитом повышен уровень кардиоспецифических ферментов в биохимическом анализе крови.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
В случаях, когда миокардит диагностирован у лиц с отягощенным эпидемиологическим анамнезом или причину миокардита не удаётся установить (особенно при сохраняющихся воспалительных изменениях в анализах крови), необходима консультация врача-инфекциониста.
ЛЕЧЕНИЕ
ЦЕЛИ ЛЕЧЕНИЯ
Предотвратить необратимую дилатацию полостей сердца и развитие хронической сердечной недостаточности.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Подлежат госпитализации все больные с острым миокардитом, а также больные со среднетяжёлой и тяжёлой формами миокардита.
НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
При остром миокардите необходимо ограничение физической активности, при среднетяжёлой и тяжёлой форме заболевания необходимо соблюдение постельного режима. Диета: рекомендуется ограничение соли, жидкости.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
При развитии клинической картины застойной сердечной недостаточности применяют стандарты лечения сердечной недостаточности (см. Сердечная недостаточность).
Нестероидные противовоспалительные препараты не могут быть рекомендованы для лечения больных с миокардитом.
Кортикостероиды и иммунодепрессанты также не могут быть рекомендованы для лечения больных с миокардитом.
В острой стадии вирусного миокардита можно применять противовирусные препараты: рибавирин, рекомбинантный альфа-интерферон, поликлональный иммуноглобулин. Практически из-за кратковременности острой фазы заболевания, редкости попадания к врачу больных в этот период заболевания и, как правило, потери времени при проведении дифференциальной диагностики, уровень доказанности эффективности этих препаратов низкий.
Антибактериальные средства. При бактериальных миокардитах проводят терапию антибиотиками, показанными при том или ином конкретном заболевании.
ОБУЧЕНИЕ ПАЦИЕНТА
Всем лицам, перенесшим миокардит, рекомендуют избегать переохлаждения, повышенных физических нагрузок, избыточного потребления соли, жидкости. В случаях развития острого респираторного вирусного заболевания рекомендуют соблюдение постельного режима. Один раз в год по месту жительства желательны проведение ЭКГ и эхоКГ-исследования (при появлении одышки, аритмии — немедленно) и консультация кардиолога.
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ
Всем лицам, перенёсшим миокардит, дают рекомендации (см. выше Обучение пациентов).
ПРОГНОЗ
Течение и исходы миокардитов чрезвычайно разнообразны, что делает прогноз у каждого больного затруднительным.
Среди больных с острым миокардитом, протекающим с клиникой сердечной недостаточности, смертность за первый год составляет 15—20% и 50% за четыре года наблюдения.
В 10-15% случаев после миокардита развивается дилатационная кардиомиопатия.
У больных, перенёсших миокардит, возможен рецидив заболевания, однако для диагностики данного состояния необходимо, помимо клинических данных, серологическое и энзимологическое подтверждение.
КАРДИОМИОПАТИИ
ГИПЕРТРОФИЧЕСКАЯ КАРДИОМИОПАТИЯ
Гипертрофическая кардиомиопатия ГКМП — генетически обусловленное заболевание сердца, характеризующееся массивной (более 1,5см) гипертрофией левого и/или реже правого желудочка.
КОДЫ МКБ-10
I42.1 Обструктивная гипертрофическая кардиомиопатия
I42.2 Другая гипертрофическая кардиомиопатия.
ЭПИДЕМИОЛОГИЯ
Болезнь может манифестировать в любом возрасте, в том числе пожилом и старческом. Встречаемость у взрослого населения 0,02-0,05%, в равной степени у мужчин и женщин. Около половины всех случаев заболевания составляют семейные формы.
Гипертрофическая кардиомиопатия— наиболее частая причина внезапной сердечной смерти ВСС у молодых людей (включая легкоатлетов, у которых ГКМП составляет 50% ВСС). Ежегодная смертность больных ГКМП колеблется в пределах от 1 до 6%.
ПРОФИЛАКТИКА
Около половины всех случаев заболевания — наследуются. Всем лицам, имеющим отягощенный семейный анамнез по случаям внезапной смерти в молодом возрасте у родственников, необходимо проведение периодической (не реже 1р в год) эхокардиографии. Им следует избегать профессиональных занятий спортом и профессий, связанных с перегрузками.
СКРИНИНГ
Необходим активный диагностический поиск (физикальное обследование, ЭКГ, эхоКГ) у ближайших родственников больных ГКМП. У детей в течение всего пубертатного периода необходимы ежегодные повторные обследования, так как в этот период особенно высок риск ремоделирования левого желудочка со спонтанным развитием его гипертрофии.
КЛАССИФИКАЦИЯ
По наличию градиента систолического давления в полости левого желудочка:
- обструктивная форма ГКМП — наличие градиента систолического давления в полости левого желудочка
- необструктивная форма ГКМП — отсутствие градиента систолического давления в полости левого желудочка.
Гемодинамический вариант обструктивной ГКПМ:
- с базальной обструкцией — субаортальная обструкция в покое
- с лабильной обструкцией — значительные спонтанные колебания внутрижелудочкового градиента давления
- с латентной обструкцией — обструкция возникает только при нагрузке и провокационных фармакологических пробах.
Вариант течения ГКПМ:
- стабильное, доброкачественное течение
- внезапная смерть
- прогрессирующее течение: усиление одышки, слабости, утомляемости, болевого синдрома (кардиалгия, стенокардия), синкопальных и пресинкопальных состояний и др
- развитие мерцательной аритмии и связанных с ней тромбоэмболических осложнений
- «конечная стадия»: нарастание явлений сердечной недостаточности из-за ремоделирования левого желудочка и снижения его сократительной способности.
ДИАГНОСТИКА
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
ЖАЛОБЫ И АНАМНЕЗ
Клиническая симптоматика у больных с ГКМП разнообразна и малоспецифична. Для ГКМП не описано каких-либо специфических жалоб больного. Наиболее часто выявляют:
одышку
боли в грудной клетке кардиалгического и стенокардитического характера
ощущение сердцебиения, перебоев
головокружения
пре- и синкопальные состояния.
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Результаты физикального обследования больных необструктивной ГКМП могут быть абсолютно нормальными.
Физикальное обследование больного обструктивной ГКМП.
Пульс при пальпации сонных артерий быстрый («отрывистый»). Пальпация области сердца выявляет, что верхушечный толчок смещён влево, усилен, может носить разлитой характер.
При аускультации сердца выслушивают систолический шум различной интенсивности с максимумом вдоль левого края грудины, который не проводится на сосуды шеи. Громкость систолического шума увеличивается при уменьшении наполнения сердца и снижении общего периферического сопротивления (вставание с корточек, натуживание, приём нитроглицерина) и уменьшается при увеличении наполнения сердца (в положении лёжа, на корточках).
ЛАБОРАТОРНЫЕ И ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Лабораторные методы исследования не дают диагностически значимой информации для установления диагноза ГКМП.
Изменения на ЭКГ выявляют у абсолютного большинства больных. Наболее типичными, хотя и малоспецифичными проявлениями заболевания на ЭКГ служат:
признаки гипертрофии миокарда левого желудочка
патологический зубец Q или комплекс QS (эти изменения требуют исключения инфаркта миокарда)
нарушения проводимости (атриовентрикулярная блокада различной степени, нарушения внутрижелудочкового проведения)
нарушения ритма.
Рентгенологическое исследование грудной клетки малоинформативно. Изменений может не быть, а может быть немного увеличена тень сердца.
ЭхоКГ — основной метод диагностики ГКМП. ЭхоКГ должна быть проведена всем больным с подозрением на ГКМП. Наиболее характерные изменения при ЭхоКГ:
гипертрофия миокарда левого желудочка: в 60% случаев асимметричная (отношение толщины межжелудочковой перегородки и толщины задней стенки левого желудочка 1,3:1), в 30% симметричная, в 10% апикальная
систолическое движение передней створки митрального клапана вперёд
нормальные или уменьшенные размеры полости левого желудочка
фракция выброса левого желудочка повышена
гиперкинезия задней стенки левого желудочка и гипокинезия межжелудочковой перегородки.
Если имеется возможность проведения допплер-эхоКГ, могут быть определены следующие признаки:
наличие внутри левого желудочка систолического градиента давления (градиент более 50мм рт.ст. считают выраженным)
у 80% больных имеется диастолическая дисфункция.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
Гипертрофическая кардиомиопатия, обструктивная форма. Стенокардия напряжения II ФК, желудочковая экстрасистолия. НК 1 ст. (II ФК).
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Наиболее часто ГКМП нужно дифференцировать с аортальным стенозом. Сходство: жалобы на одышку, стенокардитические боли, обмороки, гипертрофия левого желудочка, выявляемая при физикальном обследовании, на ЭКГ и эхоКГ. Различия: в отличие от шума при аортальном стенозе систолический шум при ГКМП не проводится или слабо проводится на сонные артерии, выявляемая допплеровским исследованием обструкция выносящего тракта левого желудочка при ГКМП (в отличие от аортального стеноза) часто носит динамический характер, внутрижелудочковый градиент давления меняется.
ПОКАЗАНИЯ ДЛЯ КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
При высоком риске внезапной смерти необходима максимально активная врачебная тактика:
уточнение лекарственной терапии
использование искусственных водителей ритма, дефибрилляторов-кардиовертеров
проведение хирургических вмешательств.
Больной должен быть проконсультирован в специализированном кардиологическом лечебном учреждении.
Больной должен быть также направлен на консультацию в лечебное учреждение с возможностью имплантационных и хирургических вмешательств, когда фармакотерапия не позволяет эффективно контролировать симптомы заболевания, а низкое качество жизни не устраивает пациента.
ЛЕЧЕНИЕ
ЦЕЛИ ЛЕЧЕНИЯ
— коррекция клинических проявлений заболевания
- предупреждение прогрессирования заболевания, контроль течения болезни
- предупреждение осложнений - профилактика внезапной смерти
- улучшение качества жизни
- улучшение прогноза.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Впервые выявленная у больного ГКМП с клинической симптоматикой заболевания.
Бессимптомное или малосимптомное течение ГКМП при наличии отягощенного семейного анамнеза, признаков внутрижелудочковой обструкции по данным эхоКГ и серьёзных нарушений ритма сердца по данным ЭКГ или холтеровского мониторирования.
Начало медикаментозной терапии или необходимость её коррекции.
НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Ограничение значительных физических нагрузок, запрещение занятий спортом, способных вызвать усугубление гипертрофии миокарда, повышение внутрижелудочкового градиента давления и риска внезапной смерти.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
До настоящего времени не решён вопрос о необходимости проведения активной медикаментозной терапии наиболее многочисленной группе больных с бессимптомными или малосимптомными формами ГКМП и низкой вероятностью внезапной смерти (см. Прогноз).
Антибиотикопрофилактику инфекционного миокардита (аналогично больным с пороками сердца) рекомендуют при обструктивных формах ГКМП в ситуациях возможной бактериемии.
Основу медикаментозной терапии ГКМП составляют препараты с отрицательным инотропным эффектом: б-адреноблокаторы и урежающие ритм блокаторы кальциевых каналов. При необходимости антиаритмической терапии преимущественно назначают амиодарон.
Б-адреноблокаторы — наиболее эффективная группа лекарственных средств, применяемых в лечении ГКПМ.
Пропранолол назначают по 20мг 3-4р в день с постепенным увеличением дозы под контролем пульса и артериального давления, максимальная доза 120—240мг/сут. Следует стремиться к применению возможно более высоких доз препарата, так как отсутствие эффекта терапии часто связано с недостаточной дозировкой.
Атенолол, бисопролол и другие б-адреноблокаторы также могут быть рекомендованы для длительного лечения больного с ГКМП. Их достоинство — продолжительность действия, что снижает кратность приёма. Преимущества, связанные с кардиоселективностью, как правило, нивелируются необходимостью применения высоких доз препарата.
Соталол рекомендован к применению у больных с ГКМП с тяжёлыми суправентрикулярными и желудочковыми аритмиями, так как сочетает в себе свойства б-адреноблокатора и антиаритмического препарата III класса (кордароноподобный эффект).
Блокаторы кальциевых каналов.
Верапамил — препарат выбора в этой группе лекарственных средств, благодаря наибольшему отрицательному инотропному эффекту и наилучшему фармакологическому профилю. Верапамил назначают, начиная с 20—40мг 3р в день с постепенным повышением дозы до снижения частоты сердечных сокращений в покое до 50-60в минуту. Обычная клиническая доза 160—240мг/сут. Удобны пролонгированные формы (изоптин-ретард и др.) верапамила, так как снижают кратность приёма.
Антиаритмические препараты.
Дизопирамид применяют у больных ГКМП с умеренной обструкцией оттока из левого желудочка с желудочковыми аритмиями. Начальная доза 400мг/сут с постепенным увеличением до 800мг.
Амиодарон применяют у больных ГКМП как с суправентрикулярными, так и желудочковыми аритмиями. Начинают лечение с насыщающей дозы 600—1200мг/сут в течение 3—7дней с постепенным, по мере уменьшения чсс, снижением до поддерживающей 200 и менее мг/сут.
Антикоагулянты.
Назначают при развитии мерцательной аритмии, при постоянной форме неопределённо долго. Схемы подробно см. Нарушения ритма сердца.
ОБУЧЕНИЕ ПАЦИЕНТА
Больному следует рекомендовать ограничение значительных физических нагрузок, профессиональных занятий спортом.
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ
Все больные ГКМП, включая бессимптомное течение, нуждаются в динамическом наблюдении. Не реже чем 1р в год врач по месту жительства должен вызвать больного для осмотра, проведения записи ЭКГ и эхоКГ-исследования с определением градиента в полости левого желудочка и ЭКГ-мониторирования для выявления желудочковых нарушений ритма сердца.
Выжидательная тактика возможна только в случаях бессимптомного или малосимптомного течения ГКМП при отсутствии признаков внутрижелудочковой обструкции, обмороков и серьезных нарушений ритма сердца, а также отягощенного семейного анамнеза.
ПРОГНО3
Факторами высокого риска внезапной смерти при ГКМП служат:
молодой возраст (менее 14лет)
семейный анамнез по ГКМП или внезапной смерти у ближайших родственников
гипертрофия миокарда левого желудочка более 3см
выраженная обструкция выходного тракта левого желудочка (градиент давления более 60)
наличие синкопальных и пресинкопальных состояний
тяжёлые желудочковые тахиаритмии
мерцательная аритмия
неадекватность прироста артериального давления при физической нагрузке.
ИСТОЧНИКИ
Maron B.J.,
Towbin J.A., Thiene G. el al. Contemporary definitions and classification of
the Cardiomyopathies. An American Heart Association Scientific Statement From
the Council on Clinical Cardiology, Heart Failure and Transplantation
Committee; Quality of Care and Outcomes Research and Functional Genomics and
Transplantation Biology Interdisciplinary Working Groups; and Council on
Epidemiology and Prevention // Circulation. 2006. Vol. 113. P. 1807-1816.
Wynne J.,
Braunwald E. The cardiomyopathies // Braunwald's Heart Disease. — 7th ed. / eds
D.R. Zipes et al. Philadelphia : Elsevier Saunders, 2005. P. 1659-1696.
Thiene G.,
Angelini A., Basso С et
al. The new definition and classification of cardiomyopathies // Adv. Clin.
Path. 2000. Vol. 4. P. 53-57.
Tniene G., Corrado D., Basso C. Cardiomyopathies: is it time for a molecular classification? // Eur. Heart J. 2004. Vol. 25. P. 1772-1775.
ДИЛАТАЦИОННАЯ КАРДИОМИОПАТИЯ
Дилатационная кардиомиопатия ДКМП — заболевание сердца, характеризующееся расширением его полостей и нарушением сократительной функции.
КОДЫ МКБ-10
I42.0 Дилатационная кардиомиопатия
I42.8 Другие кардиомиопатии
I42.9 Кардиомиопатия неуточнённая.
ЭПИДЕМИОЛОГИЯ
Распространённость дилатационной кардиомиопатии — 5—8 случаев на 100 000 человек в год. У мужчин ДКМП возникает чаще, чем у женщин — 2,5:1. Среди всех кардиомиопатии ДКМП составляет до 60%.
ПРОФИЛАКТИКА
У 20—25% больных ДКМП заболевание имеет наследственный характер, поэтому всем лицам, имеющим отягощенный семейный анамнез по случаям сердечной недостаточности в молодом возрасте у родственников, необходимо проведение врачебного осмотра не реже 1р в год. Им следует избегать профессиональных занятий спортом и профессий, связанных с перегрузками. Во время эпидемий вирусных инфекций следует применять все профилактические меры, а при заболевании постельный режим, так как все многочисленные агенты (прежде всего вирусы), приводящие к развитию миокардитов, могут влиять на прогрессирование сердечной недостаточности при ДКМП.
СКРИНИНГ
Диагноз ДКМП следует исключить во всех следующих случаях:
больной с клинической картиной сердечной недостаточности, особенно при отсутствии у него в анамнезе сведений об ИБС и клапанных поражениях
больной с мерцательной аритмией (пароксизмальной или постоянной) без ишемической болезни сердца и/или систематического злоупотребления алкоголем в анамнезе
лица с дилатацией полостей сердца по данным рентгенологического или эхоКГ-исследования без клапанных поражений и/или систематического злоупотребления алкоголем в анамнезе
больные с тромбоэмболиями при отсутствии внесердечных источников эмболии.
КЛАССИФИКАЦИЯ
ДКМП, как правило, классифицируют в зависимости от выраженности клинических проявлений сердечной недостаточности (см. Сердечная недостаточность).
ДИАГНОСТИКА
ДКМП может манифестировать в любом возрасте больного, но чаще в 30-50лет.
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Бессимптомная кардиомегалия встречается в 4—13% всех случаев ДКМП.
Наиболее частое клиническое проявление ДКМП — сердечная недостаточность (подробно см. Сердечная недостаточность).
Наиболее частые жалобы больного с ДКМП:
снижение толерантности к нагрузкам, слабость (до 100% больных)
одышка (90%
ощущения сердцебиения, перебоев (30%)
периферические отёки (30%)
кардиалгии (9-13%).
Осмотр:
ортопноэ
периферические отеки
положительный венный пульс
асцит.
Перкуссия:
расширение границ сердца
увеличение печени.
Пальпация
верхушечный толчок разлитой и смещен влево.
Аускультация:
влажные хрипы в лёгких
при синусовом ритме выслушивается IV тон, а при прогрессировании заболевания III тон
систолический шум на митральном и трикуспидальном клапане.
ЛАБОРАТОРНЫЕ И ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Рентгенологическое исследование:
расширение камер сердца
застой в малом круге кровообращения различной степени.
На ЭКГ у больного ДКМП можно наблюдать самые разнообразные изменения:
различные нарушения проводимости (до 80% больных): атриовентрикулярная блокада различной степени, нарушения внутрижелудочкового проведения
неспецифические изменения сегмента ST и зубца Т
признаки гипертрофии левого желудочка
нарушения ритма сердца: экстрасистолия, мерцательная аритмия и др.
также может регистрироваться нормальная ЭКГ.
ЭхоКГ — наиболее информативный неинвазивный метод диагностики ДКМП.
У больных с ДКМП чаще всего определяют:
снижение фракции выброса левого желудочка ниже 45%
дилатация левого или обоих желудочков
внутриполостные тромбы
при возможности проведения допплеровского исследования можно определить митральную и/или трикуспидальную регургитацию.
Сцинтиграфию миокарда проводят в тех случаях, когда вследствие плохого ультразвукового окна невозможно проведение эхоКГ исследования. Сцинтиграфия миокарда позволяет количественно оценить систолическую и диастолическую функции левого желудочка.
Проведение исследования лимитирует его стоимость и необходимость специального оборудования.
Биопсия миокарда не может быть рекомендована из-за низкой диагностической значимости и стоимости метода.
Коронароангиографию проводят только в тех случаях, когда всё выше указанное обследование не позволило разграничить ДКМП и ИБС. Метод лимитируют стоимость и необходимость специального оборудования.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
Дилатационная кардиомиопатия. Мерцательная аритмия, постоянная форма, тахисистолия. НК IIA стадии (III ФК).
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Данные анамнеза, аускультативная картина, рентгенологическое исследование и эхокардиограмма чаще всего сразу позволяют исключить ряд заболеваний, протекающих с дилатацией полостей сердца и клиникой сердечной недостаточности: артериальную гипертонию, аневризму левого желудочка, злоупотреблением алкоголем, пороки сердца.
Наибольшие трудности наблюдают в различии ДКМП с ИБС, постинфарктным кардиосклерозом, когда острый инфаркт миокарда был перенесён «на ногах» незаметно для больного, и с хроническим миокардитом.
ИБС, постинфарктный кардиосклероз. Сходство: проявления сердечной недостаточности, изменения ST-Т на ЭКГ, дилатация левого желудочка, снижение его сократимости и внутриполостные тромбы по данным эхоКГ. Различия: у больных с постинфарктным кардиосклерозом, как правило, можно выявить анамнестические указания на перенесённый инфаркт миокарда, больные с ИБС обычно имеют несколько факторов риска, прежде всего дислипидемию, курение, артериальную гипертонию и др., для постинфарктного кардиосклероза более характерны изменения в синергичных отведениях ЭКГ, например, II, III, aVF или I, aVL, V5—V6, у больных с постинфарктным кардиосклерозом на эхоКГ более характерно выявление зон локального гипо-, а- или дискинеза, тогда как при ДКМП более характерно диффузное снижение сократимости миокарда левого желудочка, коронароангиография — наиболее точный метод дифференциальной диагностики ИБС и ДКМП, лимитируют её проведение стоимость и необходимость специального оборудования.
Хронический миокардит. Различить ДКМП и хронический миокардит часто не представляется возможным. Считается, что ДКМП может быть исходом миокардита. Сходство: клинические признаки застойной сердечной недостаточности, на ЭКГ неспецифические изменения ST—T, на эхоКГ дилатация полостей сердца и снижение сократимости миокарда левого желудочка (уменьшение фракции выброса левого желудочка). Различия: у больных с миокардитом может быть анамнестическая связь начала заболевания с перенесённой вирусной инфекцией, у больных с миокардитом можно наблюдать воспалительные изменения в клиническом анализе крови, у больных с миокардитом повышен уровень кардиоспецифических ферментов в биохимическом анализе крови.
ПОКАЗАНИЯ ДЛЯ КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
При развитии тромбоэмболических осложнений больного ведут совместно с врачом соответствующей специальности: невропатологом при развитии ишемического инсульта, сосудистым хирургом при развитии эмболии периферических сосудов.
ЛЕЧЕНИЕ
ЦЕЛИ ЛЕЧЕНИЯ
Лечение ДКМП — лечение сердечной недостаточности (подробно см. Сердечная недостаточность).
Цель лечения — замедлить прогрессирование хронической сердечной недостаточности, предотвратить осложнения заболевания (нарушения ритма сердца, тромбоэмболии и др).
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Впервые выявленная ДКМП.
Прогрессирование сердечной недостаточности, не купирующееся в амбулаторных условиях.
Пароксизмальные нарушения ритма сердца.
Тромбоэмболии.
НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Ограничение соли, жидкости.
Щадящий режим.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
При развитии клинической картины сердечной недостаточности применяют стандарты её лечения, (см. Сердечная недостаточность).
При развитии нарушений ритма сердца проводят антиаритмическую терапию (см. Нарушения ритма сердца).
ОБУЧЕНИЕ ПАЦИЕНТА
Строго обязателен отказ от курения и приёма алкоголя.
Необходим контроль массы тела больного для выявления задержки жидкости. С этой целью желательно ежедневное взвешивание утром натощак.
Больной должен быть обучен оценке дневного диуреза — подсчёту выпитой и выделенной жидкости.
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ
Дилатационная кардиомиопатия служит показанием для пересадки сердца. Однако трансплантация сердца доступна лишь небольшому числу пациентов из-за ограниченного количества донорских сердец. В последние годы число листов ожидания выросло.
ПРОГНОЗ
Дилатационная кардиомиопатия характеризуется неуклонно прогрессирующим течением и плохим прогнозом. Смертность за 1 год наблюдения с момента установления диагноза ДКМП составляет 20-30%, за 5 лет 50%. При применении всего комплекса лечебных мероприятий и приверженности больных к лечению летальность может быть снижена. Наиболее частая причина смерти — фатальные нарушения ритма сердца. Другие причины — прогрессирование сердечной недостаточности, тромбоэмболии и др.
Предикторы плохого прогноза у больных с ДКМП:
кардиоторакальный индекс более 55%
конечный диастолический объем левого желудочка более 150мл
фракция выброса левого желудочка менее 35%
синкопальные состояния в анамнезе
системная гипотензия
гипонатриемия (натрий крови менее 137ммоль/л).
ИСТОЧНИКИ
Maron B.J., Towbin J.A., Thiene G. et al. Contemporary definitions and classification of the Cardiomyopathies. An American Heart Association Scientific Statement From the Council on Clinical Cardiology, Heart Failure and Transplantation Committee; Quality of Care and Outcomes Research and Functional Genomics and Transplantation Biology Interdisciplinary Working Groups; and Council on Epidemiology and Prevention // Circulation. 2006. Vol. 113. P. 1807-1816.
ЗАБОЛЕВАНИЯ ПЕРИКАРДА
КОДЫ МКБ-10
I30.0 Острый неспецифический идиопатический перикардит
I30.1 Острый инфекционный перикардит (пневмококковый, гнойный, стафилококковый, стрептококковый, вирусный). При необходимости идентифицировать инфекционный агент используют дополнительный код (В95-В97)
I30.8 Другие формы острого перикардита
I30.9 Острый перикардит не уточнённый
I31.0 Хронический адгезивный перикардит
I31.1 Хронический констриктивный перикардит
I31.2 Гемоперикард, не классифицированный в других рубриках
I31.3 Перикардиальный выпот не воспалительный
I31.8-9 Другие не уточнённые болезни перикарда.
КЛАССИФИКАЦИЯ БОЛЕЗНЕЙ ПЕРИКАРДА
Воспалительные заболевания перикарда (перикардиты) подразделяют:
по этиологии (идиопатические, инфекционные, при системных заболеваниях соединительной ткани и др.)
по течению (острые, хронические)
по клинико-морфологическому синдрому (сухой или фибринозный, экссудативный, экссудативно-констриктивный, адгезивный без констрикции, констриктивный).
Накопление в перикардиальной сумке содержимого невоспалительной этиологии (гидроперикард, гемоперикард, пневмоперикард, хилоперикард).
Опухоли перикарда (первичные, метастатические, злокачественные, доброкачественные)
Травмы перикарда.
Врождённые заболевания перикарда (тотальный или частичный дефект перикарда, дивертикулы, кисты перикарда).
Паразитарные поражения перикарда (эхинококк, цистицерк, трихинелла).
ОСТРЫЙ ПЕРИКАРДИТ
Острый перикардит ОП — острое воспаление перикарда различной этиологии, может быть самостоятельным заболеванием или проявлением системной болезни.
ЭПИДЕМИОЛОГИЯ
Данные о частоте острых перикардитов недостаточны (около 0,1% среди госпитализированных больных). Летальность зависит от этиологии, достигая 100% при нелеченом гнойном перикардите, тогда как при остром вирусном или идиопатическом ОП выздоравливают почти все больные. Заболевание возможно в любом возрасте.
ПРОФИЛАКТИКА
ПАТОГЕНЕЗ
Повышение сосудистой проницаемости при воспалении перикарда приводит к экссудации в полость перикарда жидких фракций крови, фибриногена, который откладывается в виде фибрина и формируется фибринозный (сухой) перикардит. При широком вовлечении перикарда в воспаление экссудация жидких фракций крови превышает реабсорбцию жидкости, что приводит к образованию перикардиального выпота (экссудативный перикардит). В зависимости от этиологии ОП выпот может быть серозным, серофибринозным, геморрагическим, гнойным, гнилостным. Быстрое накопление даже небольшого количества жидкости может привести к повышению давления в полости перикарда, вследствие этого повышается конечное диастолическое давление в предсердиях и желудочках, центральное венозное давление повышается на 20—30мм вод.ст. выше внутриперикардиального. Нарушения кровообращения (венозный застой, падение АД) возникают, когда давление в полости перикарда превышает 50—60мм вод.ст. Если давление в полости перикарда становится равным или выше диастолического давления в правых полостях сердца, развивается тампонада сердца с диастолическим коллапсом правого предсердия и желудочка и падением сердечного выброса и системного АД.
ЭТИОЛОГИЯ
Около 90% ОП вирусной либо неизвестной этиологии.
Идиопатические (неизвестной этиологии).
В 26—86% случаев ОП клинических отличий между идиопатическими случаями и вирусным перикардитом нет (вероятно, большинство идиопатических случаев это не диагностированные вирусные инфекции).
Инфекции. Вирусные — наиболее частая причина острого перикардита (30—50%). Вызывающие вирусы: Коксаки В вирус, ЕСНО-вирус, аденовирусы, вирусы гриппа А и В, энтеровирусы, вирус эпидемического паротита, вирус Эпстайна-Барр, вирус иммунодефицита человека, вирусы простого герпеса типа 1, herpes zoster, кори, парагриппа типа 2, респираторно-синцитиальный вирус, вирусы Коксаки В и гриппа могут вызывать сезонные эпидемии, поражение перикарда часто при ВИЧ-инфекции, но обычно это бессимптомные выпоты небольшого объёма, симптомные перикардиты возникают менее чем в 1% случаев ВИЧ-инфекции, их этиология включает, кроме обычных причин, оппортунистические инфекции и саркому Капоши. Бактериальные (1-8%) инфекции вызывают гнойный перикардит при инфицировании путём прямого распространения при инфекции лёгких, проникающих повреждениях грудной клетки при травме или операциях, поддиафрагмальном абсцессе и гематогенным путем при абсцессах миокарда или инфекционном эндокардите. Вызывающие микроорганизмы: стрептококки (Streptococcus pneumonia) и стафилококки, грамотрицательные возбудители Proteus, Escherichia coli, Pseudomonas, Klebsiella, Salmonella, Shigella, Neisseria meningitides, Haemophilus influenza, более редкие возбудители Legionella, Nocardia, Actinobacillus, Rickettsia, Borrelia burgdorferi (боррелиоз Лайма). Туберкулёз (4%) должен рассматриваться во всех случаях перикардита без быстрого течения, особенно в группах высокого риска туберкулёза. Другие инфекции: грибы, включая Histoplasma, Blastomyces, Coccidioides, Aspergillus, Candida, паразитарные организмы Entamoeba, Echinococcus, Toxoplasma.
Системные заболевания соединительной ткани и другие воспалительные заболевания.
Ревматоидный артрит. Поражение перикарда обычно клинически бессимптомно, у 11-50% больных ревматоидным артритом по секционным данным находят перикардиальные спайки.
Системная красная волчанка. Клинически явный перикардит отмечен у 25% больных СКВ. Аутопсия выявляет поражение перикарда в 62%.
Системная склеродермия. Перикардит диагностируют у 5—10% больных системной склеродермией, при аутопсии выявляют чаще.
Ревматическая лихорадка. Перикардит сопровождает эндокардит и миокардит, чаще у детей.
Саркоидоз. Перикардит при аутопсии выявляют примерно у 25%.
Другие воспалительные заболевания — синдром Шегрена, смешанное заболевание соединительной ткани, синдром Рейтера, анкилозирующий спондилоартроз, неспецифический язвенный колит, болезнь Крона, гранулематоз Вегенера, васкулиты (полиартериит, гигантоклеточный артериит), полимиозит, синдром Бехчета, болезнь Уиппла, семейная средиземноморская лихорадка, сывороточная болезнь.
Метаболические заболевания.
Почечная недостаточность (ОП наблюдают у больных с уремией, которые нуждаются в гемодиализе).
Гипотиреоз.
Холестериновый перикардит.
Сердечно-сосудистые заболевания.
Инфаркт миокарда: после трансмурального инфаркта фибринозный перикардиальный экссудат появляется в течение 24ч. Начинает организовываться на 4—8-е сутки и полностью организуется к 4-й неделе. Аутоиммунный перикардит (синдром Дресслера) наблюдают обычно через 2-3нед после инфаркта миокарда, возникает редко.
Расслоение аорты (гемоперикард).
Опухолевые заболевания.
Перикардит развивается при опухолевой инвазии перикарда, связанной чаще с метастатическим поражением. Рак лёгких наблюдается примерно в 33% случаев, рак молочной железы в 25%, лейкемия и лимфомы в 15%, меланома в 5%. В перикард могут метастазировать почти все другие злокачественные опухоли, кроме первичной опухоли мозга.
Первичные опухоли перикарда и сердца редки (мезотелиома перикарда, ангиосаркома, лимфома сердца).
Смешанные причины, включая ятрогенные факторы.
Вакцинация против оспы может вызывать миоперикардит (в течение 14дней после вакцинации).
Облучение (высокая частота ОП при облучении грудной клетки и средостения).
Постперикардиотомный синдром (ОП после хирургических и инструментальных вмешательств на сердце с повреждением эпикарда и перикарда).
Тупая или проникающая травма сердца.
Разрыв или перфорации пищевода, панкреатит.
Лекарства вызывают перикардит через реакцию гиперчувствительности, прямое кардиотоксическое действие, лекарственный синдром СКВ.
Лекарственная красная волчанка:
прокаинамид, гидралазин, метилдопа, месалазин, резерпин, изониазид
гиперчувствительные реакции
пенициллины, кромоглициевая кислота
идиосинкразические реакции или гиперчувствительность
миноксидил, практолол, бромокриптин, цитарабин, фенилбутазон, амиодарон, стрептокиназа, парааминосалициловая кислота, тиазиды, стрептомицин, циклофосфамид, циклоспорин, месалазин.
Прямое кардиотоксическое действие доксорубицина.
Сывороточная болезнь:
сыворотка противостолбнячная
продукты крови.
Реакции на инородные вещества (прямая аппликация к перикарду):
тальк, силикон, тетрациклин, другие склерозирующие препараты
асбестоз.
Вторичное перикардиальное кровотечение (гемоперикард):
антикоагулянты, тромболитики.
Лихорадка полимерного дыма — вдыхание дыма горения политетрафлюороэтилена (тефлон).
КЛИНИКА И ДИАГНОСТИКА
Диагноз ОП ставится больным с аускультацией шума трения перикарда, болью в груди и типичными последовательными изменениями ЭКГ. Дальнейшее обследование направлено на оценку наличия перикардиального выпота и нарушений гемодинамики и определение причины болезни.
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Жалобы больного ОП. Основной симптом — боль в груди, начало боли может быть внезапным, боль может быть острой, тупой, с жжением или давлением, интенсивность боли меняется от слабой до выраженной, локализуется за грудиной с распространением в шею, левое плечо, руки, трапециевидные мышцы, у детей встречается боль в эпигастрии, боль усиливается при вдохе, в положении лёжа, во время глотания или при движении тела, уменьшается в положении сидя прямо или с наклоном вперёд.
Возможны связь начала заболевания с инфекцией, лихорадка, слабость, миалгии в продромальном периоде.
Данные осмотра и физических методов исследования больного ОП. Шум трения перикарда патогномоничен (у 85% больных ОП): шум царапающий, скребущий, типа трения кожи о кожу, трёхфазный пресистоло-систолодиастолический (более 50% случаев):
1 фаза — шум трения в систолу предсердий, предшествующий I тону
2 фаза — шум трения в систолу желудочков между I и II тоном, совпадающий с пиком пульса на сонных артериях
3 фаза — ранний диастолический шум после II тона (обычно самый слабый), отражает быстрое заполнение желудочков в ранней диастоле.
двухфазный (у трети больных ОП, при тахикардии или в результате суммации предсердного и раннего диастолического трения)
монофазный (в систолу желудочков) наименее частый, у больных ОП при фибрилляции предсердий или в начале болезни
лучше выслушивается над левым нижним краем грудины в пределах абсолютной тупости сердца, не проводится
изменчив во времени, слабее слышен в начале болезни
может сохраняться и при наличии перикардиального выпота.
Возможна лихорадка (редко выше 38°С, может указывать на гнойный ОП).
Часто тахикардия, ритм правильный. Дыхание поверхностное из-за боли, может появляться одышка.
Клинические симптомы, позволяющие заподозрить перикардиальный выпот при ОП, обусловлены:
синдромом увеличения объёма околосердечной сумки
нарушением венозного оттока
снижением сердечного выброса.
Жалобы больного ОП, обусловленные перикардиальным выпотом:
сердечно-сосудистые — ощущение сдавления, дискомфорта в груди; сердцебиение
дыхательные — упорный сухой кашель, одышка, охриплость
желудочно-кишечные — икота, дисфагия.
Данные осмотра и физических методов исследования, указывающие на перикардиальный выпот.
Сердечно-сосудистая система.
Расширение сердечной тупости во все стороны, изменение границ сердца при перемене положения (в положении стоя зона тупости во втором и третьем межреберьях сокращается, а в нижних отделах расширяется), необычная интенсивность тупости сердца, совпадение зоны абсолютной тупости сердца с зоной относительной тупости в нижних отделах.
Смещение верхушечного толчка вверх и кнутри от нижнелевой границы тупости сердца (признак Жардена).
Набухание шейных вен, не уменьшающееся на вдохе, увеличение центрального венозного давления.
Печеночно-ярёмный «рефлюкс» — повышение давления в ярёмной вене более чем на 3см вод.ст. в течение более 30с при надавливании в околопупочной области.
Тоны сердца резко ослаблены в нижних левых отделах тупости сердца, но могут быть хорошо слышны кнутри от верхушечного толчка.
Если есть шум трения перикарда, то он лучше слышен в положении лёжа в конце выдоха (признак Потена) или при запрокидывании головы назад (признак Герке), при увеличении выпота шум может исчезнуть.
Тахикардия (может отсутствовать при гипотиреозе или уремии).
Акроцианоз.
Система органов дыхания. Признак Эварда — тупой перкуторный звук ниже угла левой лопатки из-за компрессии левого лёгкого перикардиальным выпотом, в этом месте усилено голосовое дрожание, дыхание ослаблено. При наклоне вперёд тупость под лопаткой исчезает, но появляются незвонкие мелкопузырчатые хрипы (признак Пена).
Система органов пищеварения. Живот не участвует в акте дыхания (признак Винтера) из-за ограничения подвижности диафрагмы.
Небольшие или медленно накапливающиеся перикардиальные выпоты могут быть бессимптомными, нераспознанный перикардиальный выпот может привести к быстрому ухудшению состояния и смерти больного от тампонады сердца.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Обязательные методы исследования.
ЭКГ — один из трёх главных диагностических признаков (изменена у 90% больных ОП). Классический острый перикардит проходит 4 стадии:
стадия 1 — конкордатный подъём сегмента ST в передних и нижних отведениях (кроме отведений aVR и V1), зубцы Т положительные в отведениях с элевацией ST, отклонения сегмента PR в противоположном направлении по отношению к зубцу Р (сопровождает начало боли)
стадия 2 ранняя — сегмент ST возвращается к изолинии, PR ещё отклонён (через несколько дней)
стадия 2 поздняя — зубцы Т прогрессивно уплощаются и инвертируются, PR на изолинии
стадия 3 — генерализованная инверсия зубца Т
стадия 4 — ЭКГ возвращается к исходному состоянию (через 2—4нд).
При перикардиальном выпоте типичны низкий вольтаж ЭКГ, синусовая тахикардия.
Трансторакальная эхоКГ - стандарт неинвазивной диагностики перикардиального выпота, должна быть выполнена всем больным с ОП или подозрением на ОП, так как выявление выпота помогает подтвердить диагноз ОП, чрезпищеводная эхоКГ полезна для характеристики локальных выпотов, утолщения перикарда, опухолевых поражений, при перикардиальном выпоте характерно эхосвободное пространство между висцеральным и париетальным перикардом. Большие выпоты имеют толщину более 1см, полностью окружая сердце. Малые выпоты имеют толщину менее 1см и часто локализованные, обычно задние.
Рентгенографию грудной клетки выполняют, чтобы оценить тень сердца, исключить изменения лёгких и средостения, которые могли быть причиной перикардита. При значительном перикардиальном выпоте более 250мл наблюдается увеличение размеров и изменение конфигурации тени сердца («тень фляги», шаровидная форма при остром большом выпоте, треугольная форма при длительно существующих выпотах), ослабление пульсации контура тени сердца.
Лабораторные исследования крови (общий анализ, биохимический анализ):
количество лейкоцитов, СОЭ и С-реактивный белок — маркёры воспаления
повышенный уровень тропонина (наблюдают у 35-50% больных с вирусным или идиопатическим перикардитом, уровень тропонина нормализуется в течение 1—2нд, более длительное повышение указывает на миоперикардит, что ухудшает прогноз)
повышение КФК при ОП наблюдают реже
креатинин и мочевина плазмы резко повышены при уремическом ОП
тест на ВИЧ-инфекцию.
ДОПОЛНИТЕЛЬНЫЕ ИССЛЕДОВАНИЯ
Дополнительные лабораторные исследования крови по клиническим показаниям:
оценка культур крови при подозрении на гнойный перикардит
титры антистрептолизина-0 (АСЛ-О) при подозрении на ревматическую лихорадку (у молодых больных)
ревматоидный фактор, антинуклеарные антитела, антитела к ДНК, особенно, если заболевание продолжительное или тяжёлое
оценка функции щитовидной железы у больных с большим перикардиальным выпотом (тиреотропный гормон повышен при гипотиреозе)
специальные исследования на кардиотропные вирусы, как правило, не показаны, так как их результаты не изменяют тактику лечения.
Выполнение туберкулиновой пробы, исследование мокроты на палочки туберкулёза, если болезнь продолжается более недели.
Перикардиоцентез показан при тампонаде сердца, выпоте более 20мм в диастолу по данным эхоКГ или подозрении на гнойный, туберкулёзный или опухолевый экссудативный ОП. Перикардиоцентез не показан, если диагноз может быть установлен без этого исследования или если выпот рассасывается при противовоспалительном лечении. Противопоказания к перикардиоцентезу:
расслаивающая аневризма аорты
относительные противопоказания включают некоррегированную коагулопатию, антикоагулянтную терапию, тромбоцитопению (менее 50000), небольшие задние или локальные выпоты.
Анализ перикардиального выпота должен включать исследование клеточного состава, белка, ЛДГ, аденозиндеаминазы, посев и прямое исследование на микобактерии туберкулёза, специальные исследования перикардиальной жидкости в соответствии с клиническими данными (онкомаркеры при подозрении на злокачественное заболевание, ПЦР-анализ на кардиотропные вирусы при подозрении на вирусный перикардит, «молочного» вида выпот исследуют на триглицериды).
Компьютерная томография, магнитно-резонансная томография при противоречивых результатах других визуализирующих исследований.
Если выраженная клиническая активность сохраняется в течение 3нд после начала лечения или тампонада сердца рецидивирует после перикардиоцентеза при неустановленном этиологическом диагнозе, некоторые авторы рекомендуют перикардиоскопию, биопсию перикарда с гистологическим и бактериологическим исследованием.
ПРИМЕРЫ ФОРМУЛИРОВОК ДИАГНОЗА
Острый вирусный перикардит, НК1, ФК1(NYHA).
Острый гнойный пневмококковый перикардит, НК1, ФК1(NYHA).
Острый идиопатический перикардит, НКО, ФКО(NYHA).
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
В острых идиопатических случаях ведение больного осуществляет кардиолог или терапевт.
В осложнённых или специфических случаях ОП (туберкулёзный, гнойный, уремический, опухолевый) требуется мультидисциплинарный подход, включая консультации кардиолога, кардиохирурга и специалистов (бактериолога, инфекциониста, фтизиатра, нефролога, эндокринолога, онколога).
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальную диагностику проводят с другими заболеваниями, которые могут вызвать боль за грудиной. В первую очередь исключают такие угрожающие причины боли в сердце, как инфаркт миокарда, расслоение аорты, лёгочную эмболию, стенокардию. План дифференциальной диагностики также включает миоперикардит, эзофагит, эзофагоспазм, разрыв пищевода, в некоторых случаях острый гастрит и язвенную болезнь желудка.
Изменения ЭКГ при ОП трудно дифференцировать от инфаркта миокарда или синдрома ранней реполяризации. При инфаркте миокарда элевация ST куполообразная, изменения региональные с реципрокной депрессией сегмента ST, а не диффузные, характерно формирование патологического Q и снижение вольтажа зубца R, отрицательные Т появляются до нормализации ST, депрессия PR не типична. Важное отличие ОП, в том числе и от синдрома ранней реполяризации — отношение элевации ST к амплитуде зубца Т в отведении V6 более 0,25.
При перикардиальном выпоте проводится дифференциальный диагноз с выпотами не воспалительной природы (транссудат при сердечной недостаточности, нефротическом синдроме).
ОСЛОЖНЕНИЯ ОП:
- тампонада сердца
- рецидивы ОП (у 15-30% больных идиопатическим ОП), чаще после лечения глюкокортикоидами и перикардиотомии или создания перикардиального окна, реже после лечения колхицином
- хронический констриктивный перикардит в исходе.
Клинические симптомы, указывающие на тампонаду сердца или её угрозу при перикардиальном выпоте
Жалобы больного: появление приступов резкой слабости со слабым пульсом, появление обмороков, головокружений, страха смерти, усиление одышки.
Данные осмотра и физических методов исследования
Сердечно-сосудистая система: набухание шейных вен, сохраняющееся на вдохе (менее заметно у больных с гиповолемией); высокие показатели центрального венозного давления (200-300мм вод.ст.), инспираторное увеличение или недостаточное снижение давления в шейных венах при вдохе (симптом Куссмауля); артериальная гипотензия (может отсутствовать, особенно у больных с ранее наблюдавшейся артериальной гипертензией); классическая триада Бека при тампонаде перикарда — артериальная гипотензия, ослабление тонов сердца, расширение ярёмных вен; парадоксальный пульс — снижение систолического АД более чем на 10мм рт.ст. при вдохе; двойной инспираторный феномен Куссмауля — парадоксальный пульс и набухание шейных вен при вдохе; нарастающая тахикардия; слабый периферический пульс, ослабляющийся на вдохе; выраженный акроцианоз.
Система органов дыхания: одышка или учащённое дыхание при отсутствии хрипов в лёгких.
Система органов пищеварения: увеличение и болезненность печени; нарастание асцита.
Общий осмотр: положение больного сидя с наклоном вперёд и упором лбом на подушку (поза Брейтмана), поза глубокого поклона; возможно появление отёчности лица, отёка плеча и руки, больше слева (сдавление безымянной вены); нарастание периферических отёков.
Незаметно развивающаяся тампонада сердца может дебютировать симптомами осложнений, связанных с нарушением кровообращения в органах — почечной недостаточности, шоковой печени, мезентериальной ишемии. Тампонада сердца у больного с лихорадкой может быть ошибочно расценена как септический шок.
ТЕХНИКА ОПРЕДЕЛЕНИЯ ПАРАДОКСАЛЬНОГО ПУЛЬСА
Манжетку нагнетают до давления выше систолического. При медленном спускании воздуха выслушивают интермиттирующий первый тон Короткова. Сопоставляя с циклом дыхания больного, выявляют точку, при которой тон слышен на выдохе и исчезает на вдохе. При дальнейшем снижении давления в манжетке достигают точки, при которой тон слышен на всём протяжении цикла дыхания. Разницу систолического давления между этими точками более 10мм рт.ст определяют как положительный парадоксальный пульс. Для быстрой клинической ориентации этот признак также может быть исследован путём простой пальпации пульса, который значительно уменьшается во время обычного неглубокого вдоха.
ИНСТРУМЕНТАЛЬНЫЕ МЕТОДЫ ДИАГНОСТИКИ ТАМПОНАДЫ СЕРДЦА
(Руководство по диагностике и лечению болезней перикарда Европейского общества кардиологов, 2004)
ЭКГ: может быть нормальной или иметь неспецифические изменения сегмента ST и зубца Т; электрическая альтерация (вариабельность вольтажа QRS, реже зубцов Т, вызванная избыточной подвижностью сердца); брадикардия (в поздней стадии); электромеханическая диссоциация (в агональной фазе).
Рентгенография грудной клетки: увеличение тени сердца с нормальным лёгочным рисунком
ЭхоКГ: диастолический коллапс передней свободной стенки правого желудочка;
систолический коллапс правого предсердия; коллапс стенки левого предсердия в конце диастолы и начале систолы; увеличение толщины стенок левого желудочка в диастолу, «псевдогипертрофия»; дилатация нижней полой вены (нет спадения при вдохе); «качающееся сердце».
Допплерография: усиление трикуспидального потока и уменьшение митрального потока во время вдоха (при выдохе наоборот); в системных венах снижены систолические и диастолические потоки на выдохе и усилен обратный ток при сокращении предсердий.
Цветное допплеровское картирование: значительные колебания митрального и трикуспидального потоков, связанные с дыханием.
Катетеризация сердца. Подтверждение диагноза и количественная оценка гемодинамических нарушений:
повышение давления в правом предсердии (сохраняется систолический спад и уменьшается диастолический спад); внутриперикардиальное давление повышено и практически равно давлению в правом предсердии; среднедиастолическое давление в правом желудочке повышено и равно давлению в правом предсердии и перикарде (без теледиастолического плато); диастолическое давление в лёгочной артерии слегка повышено и может соответствовать давлению в правом желудочке; лёгочное капиллярное давление заклинивания также повышено и почти равно внутриперикардиальному давлению и давлению в правом предсердии; систолическое давление в левом желудочке и аорте может быть нормальным или сниженным. Подтверждение, что аспирация перикардиального выпота приводит к улучшению гемодинамики. Выявление сопутствующих гемодинамических нарушений (левожелудочковая недостаточность, констрикция, лёгочная гипертензия).
Ангиография правого и левого желудочков: коллапс предсердий и маленькие гиперактивные полости желудочков.
Коронарография: сдавление коронарных артерий в диастолу.
Компьютерная томография: не визуализируется субэпикардиальный жир вдоль обоих желудочков, изменение конфигурации желудочков и предсердий.
ЛЕЧЕНИЕ
ЦЕЛИ ЛЕЧЕНИЯ
При идиопатическом и вирусном перикардите проводится терапия, направленная на уменьшение воспаления и купирование боли. В специфических случаях ОП лечение направлено на вызвавшую причину (табл. 66).
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Большинство больных ОП могут лечиться амбулаторно, так как заболевание обычно доброкачественное с сохранением симптомов менее 2нд, хорошим ответом на нестероидные противовоспалительные препараты. Если есть небольшой или средний выпот, он рассасывается в течение нескольких недель. Повторное обследование не нужно, если симптомы не возобновляются или нет ухудшения.
Для определения показаний к госпитализации следует оценить наличие гемодинамической нестабильности и безопасность амбулаторного лечения. Индикаторы плохого прогноза: лихорадка выше 38°С, подострое начало болезни, иммуносупрессия, связь с травмой, лечение пероральными антикоагулянтами, миоперикардит, большой перикардиальный выпот — служат основными показаниями к госпитализации. Неотложная госпитализация и лечение в отделении интенсивной терапии необходимы при перикардиальном выпоте с тампонадой сердца. Госпитализация показана также при необходимости дополнительных инвазивных исследований для установления этиологии заболевания.
Больным ОП показано ограничение физических нагрузок.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Основа терапии — лечение нестероидными противовоспалительными препаратами НПВП приводит к прекращению боли в груди у 85-90% больных в течение нескольких дней. Предпочтительно применение ибупрофена (меньше побочных эффектов и благоприятное влияние на коронарный кровоток) в дозе 300-800мг каждые 6-8ч в течение нескольких дней или недель, лучше до исчезновения выпота. Аспирин 2-4г/сут рекомендуют больным с инфарктным перикардитом (другие препараты ухудшают формирование рубца в эксперименте). При лечении НПВП должна быть предусмотрена защита слизистых оболочек желудочно-кишечного тракта. Если боль сохраняется после 2нд лечения НПВП, следует поменять НПВП или добавить колхицин. Лечение НПВП не позволяет предотвратить тампонаду, констрикцию или рецидив выпота в последующем.
Таблица 66. Диагностика и лечение в соответствии с этиологией ОП

Колхицин 0,5мг 2р в день отдельно или в комбинации с НПВП назначают больным ОП с рецидивирующими или продолжающимися в течение 14дней симптомами; наиболее эффективное лечение для профилактики рецидивов ОП; хорошо переносится.
Лечение глюкокортикоидами показано больным аутоиммунными ОП и при системных заболеваниях соединительной ткани. При ОП другой этиологии глюкокортикоиды показаны только при неэффективности НПВП и колхицина у больных с плохим общим состоянием. Применяют преднизолон в дозе 1—1,5мг/кг в сутки в течение не менее месяца. Глюкокортикоиды следует постепенно отменить в течение 3мс. После отмены глюкокортикоидов назначают колхицин или ибупрофен. У больных, которые лечились глюкокортикоидами в начале заболевания, чаще наблюдаются рецидивы ОП (в эксперименте — обострение вирусной инфекции).
ТАКТИКА ЛЕЧЕНИЯ ПРИ ПЕРИКАРДИАЛЬНОМ ВЫПОТЕ С ТАМПОНАДОЙ СЕРДЦА
Экстренный перикардиоцентез или перикардиальный дренаж.
Восполнение внутрисосудистого объёма (малые количества солевых или коллоидных растворов могут способствовать улучшению, особенно при гиповолемии, вазопрессоры малоэффективны).
Избегать вентиляции лёгких при положительном давлении, это уменьшает венозный возврат и сердечный выброс.
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ
После перенесённого ОП больные нуждаются в наблюдении кардиолога с целью своевременной диагностики рецидива ОП или развития констриктивного перикардита. Больной должен быть информирован о симптомах заболевания, при появлении которых необходимо обращение к врачу и повторное обследование.
ЛЕЧЕНИЕ И ПРОФИЛАКТИКА РЕЦИДИВОВ ОП
Медикаментозное лечение (колхицин, НПВП, преднизолон, в случае неэффективности с частыми рецидивами при иммунопатологических формах циклофосфамид или азатиоприн).
Перикардэктомия или перикардиальное окно показаны только при частых и клинически выраженных рецидивах, устойчивых к медикаментозному лечению. Перед перикардэктомией больные не должны получать глюкокортикоиды в течение нескольких недель.
ПРОГНОЗ
Зависит от этиологии. Исходом может быть рассасывание выпота при стихании воспаления, реже организация выпота с образованием перикардиальных спаек, частичной или полной облитерации полости перикарда. У небольшого числа больных, перенёсших ОП, в дальнейшем может развиться констриктивный перикардит. Идиопатический и вирусный перикардиты имеют самоограниченное благоприятное течение. Гнойный, туберкулёзный и опухолевый перикардиты имеют более тяжёлое течение с менее благоприятным прогнозом.
ХРОНИЧЕСКИЕ ПЕРИКАРДИТЫ
Хронические перикардиты — воспалительные заболевания перикарда продолжительностью более 3мс, возникающие как первично-хронические процессы или в результате хронизации или рецидивирующего течения острого перикардита; включают экссудативные, адгезивные, экссудативно-констриктивные и констриктивные формы.
ХРОНИЧЕСКИЙ ЭКССУДАТИВНЫЙ ПЕРИКАРДИТ
Воспалительный перикардиальный выпот, сохраняющийся от нескольких месяцев до нескольких лет. Этиология аналогична ОП, но с большей частотой туберкулёзных, опухолевых и связанных с иммунным воспалением заболеваний. Клинические симптомы и диагностика перикардиального выпота описаны выше; медленно нарастающие хронические выпоты, как правило, малосимптомны. При больших бессимптомных хронических перикардиальных выпотах нередко возможно неожиданное ухудшение с развитием тампонады сердца. К её развитию предрасполагают гиповолемия, пароксизмы тахиаритмии, рецидивы острого перикардита. Важно диагностировать потенциально излечимые или требующие специфического этиотропного лечения формы заболевания (туберкулёз, аутоиммунные и системные заболевания соединительной ткани, токсоплазмоз). Симптоматическое лечение и показания к перикардиоцентезу и дренированию перикарда такие же, как и при ОП. При частых рецидивах выпота с тампонадой сердца может быть показано хирургичесое лечение (перикардиотомия, перикардэктомия).
ХРОНИЧЕСКИЙ ЭКССУДАТИВНО-КОНСТРИКТИВНЫЙ ПЕРИКАРДИТ
Это редкий клинический синдром, который характеризуется сочетанием перикардиального выпота и констрикции перикарда с сохранением конетрикции после удаления выпота. Любая форма хронического перикардиального выпота может организоваться в констриктивно-экссудативное состояние, поэтому этиология отражает этиологию острого перикардита и тампонады перикарда. Перикардиальный выпот при этом заболевании различают по размерам и длительности существования, при выявлении должен быть оценён для определения этиологии и гемодинамической значимости. Механизм констрикции сердца — сдавление висцеральным перикардом. Гемодинамическая характеристика — затяжное повышение конечного диастолического давления в правом и левом желудочках после того, как удаление перикардиальной жидкости возвращает давление в перикарде к нулю или близко к нулю. Не все случаи экссудативно-констриктивного перикардита прогрессируют до хронического констриктивного перикардита. Лечение перикардиоцентезом может быть недостаточным, висцеральная перикардэктомия показана при подтверждении стойкой констрикции висцерального перикарда.
ХРОНИЧЕСКИЙ КОНСТРИКТИВНЫЙ ПЕРИКАРДИТ
Констриктивный перикардит КП — отдалённое последствие острого или хронического перикардита в результате фиброзного утолщения и кальцификации париетального и, реже, висцерального перикарда, которое препятствует нормальному диастолическому заполнению сердца. Раннее диастолическое заполнение становится быстрым, повышается и уравнивается диастолическое давление во всех камерах, ограничивается поздняя фаза заполнения и уменьшается конечный диастолический объём. Это ведёт к хроническому венозному застою и снижению сердечного выброса.
ЭПИДЕМИОЛОГИЯ
Заболевание редкое, возможно в любом возрасте.
ЭТИОЛОГИЯ
Перикардиты любой этиологии в исходе могут привести к констрикции сердца.
Типичные причины КП:
- идиопатические: во многих случаях КП никакого подлежащего заболевания не находят (можно предполагать ранее перенесённый нераспознанный вирусный перикардит)
- инфекционные (бактериальные): туберкулёз, бактериальные инфекции, приводящие к гнойному перикардиту
- лучевые: отдалённые эффекты (через 5—10лет) облучения средостения и грудной клетки
- постхирургические: любые оперативные или инвазивные вмешательства, при которых повреждался перикард.
Менее частые причины:
- грибковые инфекции: Aspergillus, Candida, Coccidioides у больных с иммунодефицитом
- опухоли: злокачественное распространение (наиболее типичны метастазы рака лёгкого, молочной железы и лимфомы) может проявиться как панцирное сердце с утолщением висцерального и париетального листков перикарда
- заболевания соединительной ткани (ревматоидный артрит, СКВ и системная склеродермия)
- лекарственные: прокаинамид, гидралазин (лекарственно индуцированный люпус-синдром).
- травма грудной стенки (тупая и проникающая)
- инфаркт миокарда: описаны случаи КП после инфаркта миокарда в случае синдрома Дресслера в анамнезе или гемоперикарда после тромболитической терапии.
Редкие причины:
- уремия при хроническом гемодиализе
- врождённые
- хилоперикард.
В развитых странах большинство случаев КП идиопатические или предположительно вирусные или связанные с системными заболеваниями либо торакальной хирургией. В развивающихся странах преобладают инфекционные причины, особенно туберкулёз.
КЛИНИКА И ДИАГНОСТИКА
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Констриктивный перикардит КП проявляется множеством симптомов, обусловленных повышением венозного давления и снижением сердечного выброса. Наиболее характерна триада — высокое венозное давление, асцит, «малое тихое сердце». Диагноз КП должен рассматриваться у больных при набухании ярёмных вен, плевральном выпоте, гепатомегалии, асците, необъяснимых другими причинами. Этиологию заболевания выясняют на основании данных анамнеза.
Жалобы больного и история заболевания:
одышка при нагрузке — самый частый начальный симптом;
увеличение живота, отёки нижних конечностей (появляются позднее асцита);
слабость при физическом напряжении;
боли в груди редко;
вздутие живота, тошнота, рвота, боли в правом подреберье (проявления нарушения венозного кровообращения в печени, кишечнике);
нередко первоначальный ошибочный диагноз криптогенного цирроза печени.
Данные осмотра и физических методов исследования. Общий осмотр:
акроцианоз, цианоз лица, усиливающийся в положении лёжа, одутловатость лица, шеи;
периферические отёки;
отсутствие ортопноэ;
в развёрнутых стадиях может быть потеря мышечной массы, кахексия и желтуха.
Сердечно-сосудистая система:
набухание шейных вен (обследовать больных в вертикальном положении и лежа), высокое венозное давление, признак Куссмауля (повышение системного венозного давления при вдохе), пульсация крупных вен, их диастолический коллапс, набухание шейных вен усиливается при надавливании на область правого подреберья;
верхушечный толчок обычно не пальпируется;
границы сердечной тупости мало изменены;
тахикардия при нагрузке и в покое обычна;
тоны сердца могут быть приглушенными, «перикардиальный тон» — дополнительный тон в протодиастолу (соответствует внезапному прекращению заполнения желудочков в ранней диастоле) — возникает почти у половины больных;
парадоксальный пульс (редко превышает 10мм рт.ст., если нет сопутствующего перикардиального выпота с аномально повышенным давлением), во время глубокого вдоха пульс может исчезать (признак Ригеля);
артериальное давление нормальное или низкое, снижение пульсового давления в зависимости от стадии болезни.
Системы органов пищеварения, дыхания и другие:
гепатомегалия с пульсацией печени может быть найдена у 70% больных;
другие симптомы, обусловленные хроническим застоем в печени: асцит, сосудистые звездочки, эритема ладоней;
плевральный выпот.
 Таблица
67. Диагностический алгоритм при констриктивном перикардите (Руководство по
диагностике и лечению болезней перикарда Европейского общества кардиологов,
2004)
Таблица
67. Диагностический алгоритм при констриктивном перикардите (Руководство по
диагностике и лечению болезней перикарда Европейского общества кардиологов,
2004)

Утолщение перикарда не эквивалентно констриктивной патологии, при сочетании клинических симптомов, эхокардиографических и гемодинамических признаков констрикции сердца нормальная толщина перикарда не исключает КП и необходимость перикардэктомии.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
Хронический констриктивный перикардит, НК2Б, ФКЗ (NYHA).
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Кардиолог (интерпретация результатов эхоКГ, перикардиоцентеза и инвазивного исследования гемодинамики).
Кардиохирург (оценка показаний к хирургическому лечению).
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Включает: рестриктивную кардиомиопатию (при саркоидозе, амилоидозе, гемохроматозе, эндокардите Леффлера);
застойную правожелудочковую сердечную недостаточность другой этиологии, включая лёгочное сердце, инфаркт правого желудочка, трикуспидальные пороки;
тампонаду сердца;
опухоли сердца — миксома правого предсердия, первичные опухоли сердца (лимфома, саркома);
экссудативно-констриктивный перикардит;
цирроз печени;
синдром нижней полой вены и нефротический синдром (могут вызывать сильные отёки и асцит);
карциному яичников, которая должна быть рассмотрена у больных с асцитом и отёками.
ЛЕЧЕНИЕ
ЦЕЛИ ЛЕЧЕНИЯ
Хирургическая коррекция констрикции сердца и лечение застойной сердечной недостаточности.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Госпитализация показана при необходимости инвазивных исследований и для хирургического лечения.
НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Консервативное лечение проводят при незначительной степени констрикции, в период подготовки к операции или неоперабельным больным, включает:
ограничение нагрузки;
ограничение соли и жидкости в диете.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Диуретики (петлевые, калийсберегающие) при отёках и асците.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Перикардэктомия — основной метод лечения при постоянной констрикции. Перикардэктомия не показана при слабых проявлениях констрикции, выраженном обызвествлении перикарда или тяжёлом поражении миокарда.
ПРОГНОЗ
Летальность при перикардэктомии при КП 6—12%. Отдалённый прогноз после перикардэктомии зависит от этиологии КП (лучше прогноз при идиопатическом КП). Если показания к хирургическому лечению были установлены рано, отдалённая летальность после перикардэктомии соответствует летальности в общей популяции. Летальность при перикардэктомии в наибольшей степени связана с нераспознанным до хирургического вмешательства фиброзом миокарда.
ИСТОЧНИКИ
Гогин Е.Е., Тюрин В.П. Перикардиты / Дифференциальная
диагностика и лечение внутренних болезней. М.: Медицина,
2003; С. 496-534.
Guidelines on the Diagnosis and Management of Pericardial Diseases. The Task Force on the Diagnosis and Management of Pericardial Diseases of the European Society of Cardiology. Eur Heart J 2004;25:587-610.
СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ
ОСТРАЯ СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ
Острая сердечная недостаточность ОСН — это острое состояние, характеризующееся быстрым развитием симптомов и признаков сердечной недостаточности на фоне нарушений функции сердца.
Дисфункция сердца может развиться вследствие систолической или диастолической дисфункции, нарушений ритма сердца или несоответствия пред- или постнагрузки условиям гемодинамики.
Острая сердечная недостаточность — это часто жизнеугрожающее состояние, требующее неотложных вмешательств.
КОДЫ МКБ-10
428.1 Острая левожелудочковая недостаточность
518.4 Отёк лёгких.
ЭПИДЕМИОЛОГИЯ
5% всех госпитализаций за год.
10% всех финансовых затрат на здравоохранение.
10% смертность за 30 дней.
30% годичная смертность.
45% повторных госпитализаций.
КЛАССИФИКАЦИЯ
Клиническая классификация по типу течения ОСН (табл. 68).
Таблица 68. Клинические типы острой сердечной недостаточности


Острая декомпенсация ХСН: симптомы и признаки выражены умеренно.
Отёк лёгких: тяжёлый респираторный дистресс.
Гипертонический тип: ОСН на фоне высокого артериального давления (часто гипертонический криз) и сохранной фракции выброса левого желудочка.
Кардиогенный шок: гипотензия, анурия, гипоперфузия.
Правожелудочковая недостаточность: низкий сердечный выброс, гипотензия, набухшие ярёмные вены.
ОСН с высоким сердечным выбросом: признаки высокого сердечного выброса, тахикардия.
Классификация ОСН по Killip (разработана для классификации ОСН на фоне острого инфаркта миокарда).
Класс I — симптомы и признаки сердечной недостаточности отсутствуют.
Класс II — сердечная недостаточность. Диагностические критерии включают хрипы, ритм галопа, венозную лёгочную гипертензию. Застой в лёгких с влажными хрипами, занимающий половину лёгких.
Класс III — тяжёлая сердечная недостаточность. Отёк лёгких с хрипами, занимающими все лёгочные поля.
Класс IV — кардиогенный шок. Симптомы и признаки включают гипотонию (САД <90мм рт.ст.) и признаки гипоперфузии (олигурия, цианоз, бледность).
Классификация остро декомпенсированной ХСН (по L.W.Stevenson) основана на выявлении симптомов застоя в лёгких («влажный» или «сухой») и признаков гипоперфузии («тёплый» или «холодный») (табл. 69).
Таблица 69. Классификация остро декомпенсированной ХСН

ДИАГНОСТИКА
Диагноз ОСН ставится на основании характерных симптомов и признаков СН, объективизированных инструментальными и лабораторными методами исследований дисфункции сердца. Общий алгоритм диагностики представлен на рис. 30.
Рис. 30. Диагностический алгоритм ОСН.

АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Для выявления симптомов и признаков СН в целом применимы общепринятые критерии диагностики.
Фремингемские критерии диагностики СН.
Большие критерии:
ночные приступы сердечной астмы;
набухание шейных вен;
влажные хрипы в лёгких;'
кардиомегалия;
отёк лёгких;
ритм галопа (патологический III тон);
повышенное центральное венозное давление >16см вод.ст.;
гепатоюгулярный рефлюкс;
увеличение времени кругооборота крови (>25с).
Малые критерии:
отёки ног;
ночной кашель;
одышка при нагрузке;
гепатомегалия;
плевральный выпот;
снижение жизненного объёма лёгких на 1/3 от нормы;
тахикардия >120.
Диагноз ставят при наличии 2 больших или 1 большого и 2 малых критериев.
Особое внимание следует уделять трём категориям признаков: нарушениям периферической циркуляции, признакам застоя жидкости (признаки высокого венозного давления) и температуре тела.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Таблица 70. Рекомендуемые лабораторные исследования при ОСН

Уровень натрийуретических пептидов — биохимический маркёр сердечной недостаточности. Используют для исключения диагноза СН. Для учреждений первичной медицинской помощи определение содержания натрийуретических пептидов следует рассматривать как первый диагностический шаг при подозрении на ОСН. Общепринятая норма для мозгового натрийуретического пептида <100 пкг/мл, а для NT-МНП <300пкг/мл.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Электрокардиографию следует проводить во всех случаях ОСН. ЭКГ позволяет идентифицировать ритм сердца, выявить этиологию СН. ЭКГ незаменима для диагностики и дальнейшего ведения острого коронарного синдрома.
Рентгенография грудной клетки должна выполняться во всех случаях ОСН. Данные рентгенографии позволяют оценить размеры сердца, выявить наличие и степень выраженности признаков застоя в лёгких. Рентгенография грудной клетки позволяет провести дифференциальную диагностику между СН и инфекционными/воспалительными поражениями лёгких.
В случае ОСН на фоне острого коронарного синдрома показано проведение коронаровентрикулографии.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальную диагностику следует проводить со всеми состояниями, сопровождающимися одышкой. Сердечно-сосудистые причины одышки:
тяжёлая стенокардия, инфаркт миокарда;
аритмии;
тромбоэмболия лёгочной артерии ТЭЛА;
констриктивный перикардит, тампонада сердца;
рестриктивная кардиомиопатия;
лёгочная гипертония.
Несердечно-сосудистые причины:
пневмония;
бронхиальная астма;
хроническая обструктивная болезнь лёгких ХОБЛ;
пневмоторакс;
инфильтративное поражение лёгких,
анемия;
тиреотоксикоз
неангинозный болевой синдром в грудной клетке;
психогенная одышка.
Наиболее часто дифференциальную диагностику проводят между ОСН, ХОБЛ и ТЭЛА. Наиболее полезным и информативным исследованием в данном случае признана эхокардиография. При обнаружении рентгенологических признаков отёка лёгких следует также исключить некардиальную её причину (острый респираторный дистресс-синдром, острое повреждение лёгких, токсическое поражение лёгких).
ЛЕЧЕНИЕ
ЦЕЛИ ЛЕЧЕНИЯ
 Таблица
71. Цели лечения пациентов с ОСН
Таблица
71. Цели лечения пациентов с ОСН

*ДЗЛА — давление заклинивания лёгочной артерии. **СВ — сердечный выброс.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Во всех случаях пациенты с подозрением на ОСН должны быть госпитализированы в стационар.
НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Окигенотерапия через маску в объёме 8л/мин во всех случаях ОСН. Необходимо поддерживать насыщение крови кислородом на уровне >90%.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
![]() Таблица
72. Медикаментозное лечение ОСН
Таблица
72. Медикаментозное лечение ОСН


Морфин и его аналоги показаны для лечения выраженной ОСН. Стандартная доза морфина 3—5мг в/в. При необходимости препарат вводят дополнительно по 2-4мг с 5-минутными интервалами до обшей дозы 16—20мг. Необходимо следить за дыханием, особенно у пожилых и больных с хронической обструктивной болезнью лёгких. Редкое поверхностное дыхание — признак передозировки.
Вазодилататоры показаны для большинства пациентов с ОСН как средства первой линии терапии при признаках гипоперфузии, адекватном систолическом АД, явлениях застоя и неадекватном диурезе. Способствуют снижению преднагрузки и «открывают» периферическую циркуляцию.
Нитраты. Во время сборки системы для внутривенной инфузии проводят несколько аэрозольных ингаляций нитратов. Внутривенное введение нитратов особенно показано при отёке лёгких, обусловленном инфарктом миокарда: они уменьшают как пред-, так и постнагрузку. Инфузию необходимо проводить с помощью специального дозатора. Систолическое АД следует поддерживать на уровне 100мм рт.ст. и выше. При более низком АД необходимо провести инфузионную терапию или ввести допамин (или добутамин). Первоначальная доза нитроглицерина невелика: 4капли раствора в минуту (или 12 мл/ч), содержащего в 100мл 10мг вещества. Дозу необходимо регулировать каждые 5—10мин, поддерживая систолическое АД на уровне выше 90мм рт.ст. У больных с исходно нормальным АД необходимо снизить давление примерно на 20мм рт.ст. При невозможности внутривенной инфузии необходимо назначать повторные аэрозольные ингаляции.
Диуретики. Показаны особенно при остром ухудшении течения ХСН, происходящем чаще всего вследствие перегрузки жидкостью. Лечение диуретиками безопасно, если у больного достаточно высокое АД. Применяют 40мг в/в фуросемида. При необходимости можно повторить до общей дозы 200мг. Симптоматическое улучшение у больных с острым отёком лёгких наступает быстро. Однако клинические или рентгенологические признаки отёка лёгких не подразумевают перегрузки жидкостью всего организма. Дальнейшее введение чрезмерных доз диуретиков может привести к гиповолемии, тахикардии и падению сердечного выброса.
Сердечные гликозиды и б-адреноблокаторы. Показаны больным с тахисистолической ФП, а также с любой формой суправентрикулярной тахикардии. Дозы: дигоксин 0,25мг в/в с последующими введениями по 0,125 мг (с интервалами в 1ч) до общего количества 0,75мг (если раньше больной не получал препаратов наперстянки). Эффект препаратов наперстянки развивается медленно. Для достижения быстрого эффекта дополнительно назначают б-адреноблокаторы: анаприлин перорально по 20мг каждые 60мин.
Допамин, добутамин и левосимендан. Могут быть использованы в тяжёлых случаях у больных с артериальной гипотензией. Первоначальная доза допамина составляет 4мкг/кг/мин (6капель в минуту для взрослого человека с массой тела 70кг). При необходимости дозу можно увеличить до 15капель в минуту. Не следует забывать о недостатках применения допамина: он увеличивает нагрузку на миокард. Препарат, не обладающий действием на адренорецепторы сердца — левосимендан является кальциевым сенситизатором. Особенно показан в случаях острой декомпенсации кровообращения с синдромом малого выброса у больных, находящихся на длительной терапии б-адреноблокаторами.
ПРОГНОЗ
Уровень 30-дневной смертности при ОСН составляет 10%, а смертность за год достигает 30%.
ХРОНИЧЕСКАЯ СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ
Хроническая сердечная недостаточность ХСН представляет собой заболевание с комплексом характерных симптомов (одышка, утомляемость, снижение физической активности, отёки и др.), которые связаны с неадекватной перфузией органов и тканей в покое или при нагрузке и часто с задержкой жидкости в организме. Первопричина — ухудшение способности сердца к наполнению или опорожнению, обусловленное повреждением миокарда, а также дисбалансом вазоконстрикторных и вазодилатирующих нейрогуморальных систем (табл. 73).
Таблица 73. Определение ХСН. Наличие критериев 1 и 2 обязательно во всех случаях

ЭПИДЕМИОЛОГИЯ
Распространённость клинически выраженной ХСН составляет 8,1 млн человек. Декомпенсация ХСН служит причиной госпитализации почти каждого второго пациента в кардиологические отделения (49%). У 80-85% пациентов ХСН развивается на фоне сохранной сократимости миокарда. Однолетняя смертность больных с клинически выраженной СН достигает 26-29%, т.е. за один год в РФ умирают от 880 000 до 986 000 больных с СН.
КОД МКБ-10
428.0 Недостаточность сердечная, хроническая.
ПРОФИЛАКТИКА
Необходимо выявлять факторы риска развития ХСН:
возраст;
мужской пол;
АГ;
ИБС;
СД;
ожирение.
Лечить пациентов с АГ необходимо в соответствии с существующими рекомендациями для снижения риска развития сердечной недостаточности. Лечение показано всем пациентам с повышенным уровнем АД (более 140 и 90мм рт.ст. у людей без сопутствующих заболеваний и более 130 и 80мм рт.ст. у пациентов с другими факторами риска, например СД). Больным с СД показано агрессивное лечение для снижения риска развития сердечно-сосудистых осложнений. Для снижения риска сердечно-сосудистых осложнений у пациентов с СД и клиническими проявлениями атеросклероза или с одним и более факторами риска развития ИБС назначают ингибиторы АПФ. Необходимо контролировать уровень липидов крови у больных СД в соответствии с существующими рекомендациями для снижения риска ИБС. Следует рекомендовать пациентам избегать приёма кардиотоксичных веществ, в первую очередь алкоголя, а также отказаться от курения и употребления наркотических средств, в особенности кокаина. Пациентам с повышенным уровнем липидов крови назначают мероприятия по изменению образа жизни и при необходимости ЛС. Необходимо адекватное лечение пациентов с доказанной ИБС для предотвращения инфаркта миокарда. У пациентов с доказанной ИБС при отсутствии противопоказаний проводят активную терапию, включающую липидоснижающие ЛС (желательно из группы статинов), ингибиторы АПФ, б-адреноблокаторы, ацетилсалициловую кислоту. Назначение ингибиторов АПФ необходимо больным, перенёсшим инфаркт миокарда. При нестабильном состоянии проводят реваскуляризацию.
Необходимо выявлять и лечить заболевания щитовидной железы; цель — нормализация сывороточных уровней её гормонов. Пациентам с гипотиреозом показана заместительная гормональная терапия с регулярным лабораторным контролем. Адекватное лечение пациентов с гипертиреозом с регулярным лабораторным контролем.Регулярно проводить исследование функций щитовидной железы у пациентов, принимающих амиодарон.
Адекватное лечение пациентов с наджелудочковыми тахиаритмиями и устойчивой тахикардией в покое назначают для предупреждения развития дисфункции левого желудочка. Контролируют чсс у пациентов с ФП и наджелудочковыми тахиаритмиями. При необходимости нужно проконсультировать больного у специалиста для решения вопроса о восстановлении синусового ритма.
СКРИНИНГ
Нужно своевременно выявлять клапанные пороки сердца, чтобы предотвратить развитие сердечной недостаточности (эхоКГ у пациентов с диастолическими и систолическими шумами средней и высокой интенсивности).
У пациентов с высоким риском необходимо своевременно выявлять ИБС: проведение нагрузочных тестов при наличии дисфункции левого желудочка и ХСН у пациентов с высокой вероятностью ИБС и наличием следующих факторов риска: СД, АГ, гиперлипидемии, отягощенного семейного анамнеза по ИБС, типичных клинических проявлений стенокардии напряжения, при выявлении наследственной предрасположенности к ХСН, отягощенный семейный анамнез по сердечной недостаточности неустановленной этиологии, внезапной смерти, прогрессирующей сердечной недостаточности у родственников молодого возраста, а также наличие в наследственном анамнезе врождённых пороков сердца. Отдельно следует уточнить наличие в семейном анамнезе отягощённости по гемохроматозу, гипертрофической кардиомиопатии, аутоиммунных заболеваний и амилоидоза. В семьях с повышенной частотой ХСН (страдают несколько человек) необходимо проведение эхоКГ-скрининга.
КЛАССИФИКАЦИЯ
Классификация степеней тяжести ХСН (Нью-Йоркской ассоциации кардиологов, NYHA).
I функциональный класс — пациенты с заболеванием сердца, не приводящим к ограничению физической активности. Обычная физическая нагрузка не сопровождается возникновением утомляемости, сердцебиения, одышки или стенокардии (более 7МЕТ; МЕТ — метаболический эквивалент потребления кислорода; 1 МЕТ = 3,5мл/кг/мин, что соответствует обмену в состоянии покоя).
II функциональный класс — пациенты с заболеванием сердца, которое вызывает небольшое ограничение физической активности. В покое пациенты чувствуют себя хорошо, однако обычная физическая нагрузка вызывает появление усталости, одышки, сердцебиения или стенокардии (5МЕТ).
III функциональный класс — пациенты с заболеванием сердца, которое вызывает значительные ограничения физической активности. В покое пациенты чувствуют себя хорошо, однако небольшая (меньшая, чем обычная) нагрузка вызывает появление усталости, одышки, сердцебиения или стенокардии (2—3МЕТ).
IV функциональный класс — пациенты с заболеванием сердца, из-за которого они неспособны выполнять какую бы то ни было физическую нагрузку без неприятных ощущений. Симптомы сердечной недостаточности или стенокардия возникают в покое, при любой физической нагрузке эти симптомы усиливаются (1,6МЕТ).
Таблица 74. Классификация ХСН Общества специалистов по сердечной недостаточности ОССН, 2002 г.


ДИАГНОСТИКА
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Алгоритм постановки диагноза ХСН представлен на рис. 31.
Рис 31. Диагностический алгоритм СН.

Необходим тщательный целенаправленный расспрос пациента для выявления симптомов и признаков ХСН.
Самые частые жалобы больных с ХСН (в порядке встречаемости): одышка, быстрая утомляемость, сердцебиение, периферические отёки, кашель, хрипы в лёгких, ортопноэ, набухшие ярёмные вены, гепатомегалия, кардиомегалия.
Для клинической диагностики СН используют Бостоноские критерии (табл.75).
Таблица 75. Бостонские критерии диагностики СН


Как пользоваться таблицей.
В каждой категории разрешается использовать не более 4 критериев, так, чтобы суммарный балл в каждой категории не превышал 12.
Диагноз СН: определённый 8—12баллов, возможный 5—7баллов, маловероятный <4балла.
КАК ИССЛЕДОВАТЬ НАБУХШИЕ ШЕЙНЫЕ ВЕНЫ?
Для исследования набухших шейных вен измеряют точку максимальной пульсации ярёмных вен.
Для этого пациент лежит в постели с приподнятым изголовьем под углом 45°. Находят точку максимальной пульсации ярёмных вен. От угла грудины проводят воображаемую параллельную линию до точки максимальной пульсации. Высота пульсации более 4-5см считается превышающей норму.

ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Электрокардиография
Всем пациентам с подозрением на ХСН необходимо провести ЭКГ в 12 отведениях. Наиболее важными для объективизации ХСН служат признаки рубцового поражения миокарда, блокады левой ножки пучка Гиса при ИБС, как предикторы низкой сократимости ЛЖ. Диагностическая значимость данных ЭКГ возрастает при наличии клинических признаков ХСН.
Гематологический и биохимический анализы крови и общий анализ мочи
Стандартный диагностический набор лабораторных исследований у пациента с СН должен включать определение уровня гемоглобина, количества эритроцитов, лейкоцитов и тромбоцитов, концентрации электролитов плазмы, креатинина, глюкозы, печёночных ферментов и общий анализ мочи.
ОПРЕДЕЛЕНИЕ УРОВНЯ НАТРИЙУРЕТИЧЕСКИХ ПЕПТИДОВ
Уровень натрийуретических пептидов служит биохимическим маркёром сердечной дисфункции ХСН. спользуют для исключения диагноза СН.
Учреждениям первичной медицинской помощи определение содержания натрийуретических пептидов следует рассматривать как первый диагностический шаг при подозрении на СН, и только при обнаружении повышенного их содержания (для мозгового натрийуретического пептида >100пкг/мл; для N-МНП >100пкг/мл у мужчин и >150пкг/мл у женщин) пациент должен пройти эхоКГ или любое другое исследование по оценке функции сердца.
ЭХОКАРДИОГРАФИЯ
Всем пациентам с ХСН показано проведение эхоКГ, которой отводится первостепенная роль в диагностике ХСН.
ЭхоКГ позволяет решить главную диагностическую задачу — уточнить сам факт дисфункции и её характер, а также провести динамическую оценку состояния сердца и гемодинамики.
Важнейшим гемодинамическим показателем служит фракция выброса левого желудочка ФВЛЖ, отражающая сократительную способность сердца. Нормальный уровень ФВЛЖ >45%. Определение ФВЛЖ дифференцирует пациентов с систолической дисфункцией (т.е. с ФВЛЖ <45%) от тех, у кого систолическая функция сохранна, т.е. от больных с диастолической ХСН.
Критерии диагностики диастолической СН:
симптомы и признаки СН;
нормальная или незначительно нарушенная систолическая функция ЛЖ ФВЛЖ >45-50%
выявление нарушения релаксации ЛЖ и/или его растяжимости.
РЕНТГЕНОГРАФИЯ ГРУДНОЙ КЛЕТКИ
Всем пациентам с ХСН показано проведение рентгенографии органов грудной клетки. Главное внимание при подозрении на ХСН следует уделять кардиомегалии (кардиоторакальный индекс >50%) и венозному лёгочному застою. Кардиомегалия — свидетельство вовлечённости сердца в патологический процесс. Наличие венозного застоя и его динамики может быть использовано для характеристики тяжести заболевания и служить объективным критерием эффективности терапии.
МАГНИТНО-РЕЗОНАНСНАЯ ТОМОГРАФИЯ МРТ СЕРДЦА
МРТ сердца — наиболее точный и воспроизводимый метод визуализации. Учитывая высокую стоимость и малую доступность, МРТ проводят при недостаточно полной информативности других визуализирующих методов.
ОЦЕНКА ФУНКЦИИ ВНЕШНЕГО ДЫХАНИЯ
Данный тест полезен для исключения лёгочной патологии.
НАГРУЗОЧНЫЕ ТЕСТЫ
Нагрузочный тест проводят с целью оценки функционального статуса пациента, оценки степени риска, а не для диагностики ХСН. Тем не менее нормальный результат нагрузочного теста у пациента, не получающего специфического лечения, практически полностью исключает диагноз ХСН. У больных с ХСН возможно использование различных вариантов нагрузочного теста:
6-минутной ходьбы, велоэргометрии, тредмила, в том числе с анализом газового состава крови.
В рутинной практике при отсутствии специального оборудования для оценки физической толерантности и объективизации функционального статуса пациентов можно использовать тест ходьбы в течение 6 мин. Пациент должен непрерывно идти в течение 6 мин, осуществляя движение между двумя точками, расположенными на известном расстоянии. Пациент может останавливаться по своему желанию. Расстояние, пройденное пациентом за 6 мин, хорошо коррелирует с другими показателями работоспособности.
Таблица 76. Параметры физической активности и потребления кислорода у больных с различными ФК ХСН (по NYHA)

ДРУГИЕ ИССЛЕДОВАНИЯ
Другие исследования (холтеровское мониторирование, определение нейрогормонального профиля, радиоизотопное исследование) не занимают важного места в диагностике ХСН.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Следует выявлять возможные заболевания со сходной симптоматикой.
На основании клинической картины определяют необходимость дальнейшего обследования для выявления лёгочных, сосудистых и инфекционных заболеваний.
Анемия, почечная недостаточность, нарушения ритма, сепсис могут быть причинами одышки; кроме того, они могут утяжелять течение ХСН.
При подозрении на патологию лёгких необходимы рентгенография органов грудной клетки, оценка ФВД и нагрузочный тест с анализом газового состава крови.
Необходим целенаправленный поиск причины ХСН.
ИБС (инфаркт миокарда, тяжёлый коронарный атеросклероз, дисфункция или разрыв сосочковых мышц) — анамнестические указания на перенесённый инфаркт миокарда, наличие признаков инфаркта миокарда на ЭКГ, наличие факторов риска развития ИБС.
Дилатационная кардиомиопатия — сердечная недостаточность у больных, чаще молодого возраста, без факторов риска или клинических проявлений ИБС.
АГ — плохо контролируемая АГ, выявление IV тона сердца при аускультации, гипертрофия левого желудочка по данным ЭКГ или эхоКГ.
Клапанные пороки сердца (митральная недостаточность, аортальная недостаточность, стеноз устья аорты, недостаточность трёхстворчатого клапана, недостаточность клапана лёгочной артерии).
Митральная недостаточность — систолический шум на верхушке сердца, одышка при физической нагрузке, мерцательная аритмия.
Стеноз устья аорты — одышка при физической нагрузке, шум изгнания на основании сердца, проводящийся на сонные артерии, синкопальные состояния, стенокардия.
Инфекционный эндокардит — лихорадка, наличие факторов риска, положительная гемокультура.
Семейная дилатационная кардиомиопатия — указание на застойную сердечную недостаточность или случаи внезапной смерти у родственников первой степени родства.
Токсическая кардиомиопатия (воздействие алкоголя, антрациклинов, лучевой терапии, кокаина, катехоламинов).
Диффузные заболевания соединительной ткани (СКВ, узелковый периартериит, системная склеродермия, дерматомиозит).
Гранулематозные заболевания (гранулематоз Вегенера, гигантоклеточный артериит).
Эндокринные и метаболические расстройства (гипертиреоз, гипотиреоз, акромегалия, уремия, феохромоцитома, СД, недостаточность тиамина, карнитина, селена, квашиоркор, карциноид, ожирение).
Гигантоклеточный миокардит — рефрактерные к лечению нарушения сердечного ритма с прогрессирующей дисфункцией левого желудочка. Для подтверждения диагноза может быть проведена эндомиокардиальная биопсия. Несмотря на проводимую иммуносупрессивную терапию, прогноз неблагоприятен. Пациента следует направить в центры, где возможна пересадка сердца или имплантация аппаратов вспомогательного кровообращения.
Кардиомиопатия беременных — клиническая картина сердечной недостаточности с дисфункцией левого желудочка, развившаяся в течение 6мс беременности.
Нейромышечные заболевания (мышечная дистрофия Беккера, миотоническая дистрофия, атаксия Фридрайха, мышечная дистрофия Дюшенна).
Реакция отторжения сердечного трансплантата — анамнестические указания на пересадку сердца, несоблюдение рекомендаций по приёму ЛС, одышка, тахикардия, нарушения сердечного ритма.
Гипертрофическая кардиомиопатия.
Рестриктивные кардиомиопатии (амилоидоз, саркоидоз, гемохроматоз, болезни накопления гликогена, болезнь Фабри, болезнь Гоше, эндомиокардиальный фиброз, гиперэозинофильный синдром).
Другие патологические состояния, имеющие сходную картину с ХСН или усугубляющие её течение.
Бронхиальная астма
ТЭЛА.
Мерцательная аритмия.
Наджелудочковые нарушения ритма.
ХОБЛ.
Септический шок.
Пневмония.
Интерстициальные болезни лёгких.
Синдром ночного апноэ.
Почечная недостаточность.
Анемия.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
На консультацию к специалисту-кардиологу следует направлять следующих больных:
- причина СН неизвестна
- систолическое АД <100мм рт.ст.
- содержание креатинина крови > 150ммоль/л
- содержание натрия сыворотки < 135ммоль/л
- содержание калия сыворотки >6ммоль/л
- тяжёлая СН
- клапанные пороки сердца как причина СН.
При подозрении на первичную лёгочную патологию и при сложностях в интерпретации результатов лабораторных и инструментальных методов обследования необходима консультация пульмонолога.
ЛЕЧЕНИЕ
ЦЕЛИ ЛЕЧЕНИЯ
Предотвращение развития симптомов ХСН (на этапе бессимптомной дисфункции сердца).
Устранение симптомов ХСН.
Замедление прогрессирования болезни.
Улучшение качества жизни.
Уменьшение количества госпитализаций.
Улучшение прогноза.
Пути достижения поставленных целей лечения:
диета
режим физической активности
психологическая реабилитация, организация врачебного контроля, школ для больных с ХСН
медикаментозная терапия
электрофизиологические методы лечения
хирургические, механические методы лечения.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Госпитализация необходима при неэффективности лечения в амбулаторных условиях:
пациентам с IV функциональным классом ХСН, выраженной утомляемостью и снижением работоспособности, а также при неэффективности диуретиков, применяемых с целью снижения объёма циркулирующей крови и устранения задержки жидкости;
при планировании парентерального введения диуретиков, вазодилататоров или ЛС с положительным инотропным действием под контролем показателей гемодинамики, требующим катетеризации лёгочной артерии;
у пациентов с очень низким сердечным выбросом, которым необходимо проведение терапии положительными инотропными препаратами.
Госпитализация необходима при наличии жизнеугрожающих нарушений ритма или аритмий, ухудшающих течение ХСН.
Нарушения ритма: устойчивая желудочковая тахикардия, пароксизмы желудочковой тахикардии, сопровождающиеся нарушением состояния больного, синкопальные состояния, внезапная сердечная смерть, наджелудочковые нарушения ритма, ухудшающие течение ХСН.
Пациентов с жизнеугрожающими аритмиями госпитализируют для проведения электрофизиологического исследования с целью решения вопроса о необходимости установки имплантируемого кардиовертера-дефибриллятора или назначения антиаритмической терапии.
У больных с ХСН и жизнеугрожающими нарушениями ритма до имплантации кардиовертера-дефибриллятора антиаритмическую терапию следует ограничить назначением амиодарона или соталола.
НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
ДИЕТА БОЛЬНЫХ С ХСН
Ограничение приёма поваренной соли, причём тем больше, чем выраженнее симптомы болезни и застойные явления:
I ФК — не употреблять солёной пищи (до 3г соли);
II ФК — не досаливать пищу (до 1,5г соли);
III ФК — употреблять продукты со сниженным содержанием соли и приготовление без соли (<1г соли).
Ограничение потребления жидкости актуально только в крайних ситуациях: при декомпенсированном состоянии, требующем внутривенного введения мочегонных. В обычных ситуациях объём жидкости не рекомендуют увеличивать более 2л в сутки.
Пища должна быть калорийной, легко усваиваться, с достаточным содержанием витаминов, белка.
Алкоголь
Алкоголь строго запрещён для больных с алкогольной кардиомиопатией. У пациентов с ишемическим генезом ХСН употребление до 20мл этанола в сутки может способствовать улучшению прогноза. Для всех остальных больных с ХСН ограничение приёма алкоголя имеет вид обычных рекомендаций. Следует ограничивать применение больших объёмов (например, пива).
РЕЖИМ ФИЗИЧЕСКОЙ АКТИВНОСТИ
Покой не показан любым больным с ХСН. Физическую реабилитацию рекомендуют всем пациентам с I—IV ФК ХСН. Требование к проведению физической реабилитации — стабильное течение ХСН.
Физическая реабилитация противопоказана при:
активном миокардите;
клапанных стенозах;
цианотичных врождённых пороках;
нарушениях ритма высоких градаций;
приступах стенокардии у больных с низкой ФВЛЖ.
РЕЖИМ. ОБЩИЕ РЕКОМЕНДАЦИИ
Вакцинация. Нет доказательств пользы. Целесообразно использование вакцин против гриппа и гепатита В.
Путешествия. Не рекомендовано пребывание в условиях высокогорья, высоких температур, влажности. Желательно проводить отпуск в привычной климатической зоне. При выборе транспорта предпочтение следует отдавать авиаперелётам.
Курение. Строго и абсолютно однозначно не рекомендовано всем пациентам с ХСН.
Сексуальная активность. Применение ингибиторов фосфодиэстеразы-5 (силденафил) не противопоказано, за исключением сочетаний с длительно действующими нитратами.
ПСИХОЛОГИЧЕСКАЯ РЕАБИЛИТАЦИЯ
Основная задача врача — обучить больного и его ближайших родственников приёмам контроля за течением ХСН, методам самопомощи и дать возможность регулярно контактировать с лечащим врачом для своевременной коррекции состояния и недопущения экстренных декомпенсаций.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Все лекарственные средства для лечения ХСН можно разделить на три основные категории:
основные (А), дополнительные (В) и вспомогательные (С) (табл. 77).
Таблица 77. Препараты для лечения ХСН

1 Эффект на клинику, качество жизни и прогноз доказан и сомнений не вызывает.
2 Эффективность и безопасность исследованы, но требуют уточнения.
3 Влияние на прогноз неизвестно; применение диктуется клиникой.
Основные препараты для медикаментозного лечения
Ингибиторы АПФ
Основные положения по применению ингибиторов АПФ (иАПФ) в лечении ХСН:
иАПФ показаны всем больным с ХСН (любой этиологии и стадии процесса, включая бессимптомную дисфункцию ЛЖ);
иАПФ улучшают клиническую симптоматику, качество жизни, замедляют прогрессирование болезни, снижают заболеваемость и улучшают прогноз больных с ХСН, т.е. позволяют достичь всех пяти целей в лечении ХСН;
иАПФ являются наиболее обоснованным способом лечения ХСН с сохранной систолической функцией сердца;
неназначение иАПФ не может считаться оправданным и ведёт к сознательному повышению риска смерти больных с ХСН;
абсолютными противопоказаниями к назначению иАПФ являются непереносимость (ангионевротический отёк), двусторонний стеноз почечных артерий, беременность.
В табл. 78 показаны дозы восьми наиболее исследованных в лечении и профилактике ХСН иАПФ, применяемых в России.
Таблица 78. Дозировки иАПФ для лечения ХСН (мг х кратность приёма)

Рекомендации по безопасному началу лечения ХСН иАПФ:
- оценить необходимость применения диуретиков и вазодилататоров и их дозировок;
- не допускать чрезмерного диуреза перед началом лечения; отменить диуретики за 24ч до первого применения иАПФ;
начинать терапию вечером, когда пациент пребывает в горизонтальном положении, чтобы минимизировать риск гипотонии;
начинать с малых доз и увеличивать их до поддерживающих уровней;
при существенном ухудшении функции почек снизить дозу вдвое, а при отсутствии улучшения отменить иАПФ;
избегать назначения калийсберегающих диуретиков в начале лечения, особенно у пациентов с высоким уровнем калия >5,2ммоль/л; однако это не противоречит рекомендациям по совместному применению иАПФ с высокими дозами спиронолактона в период декомпенации и сочетанию иАПФ с малыми дозами антагонистов альдостерона при длительном лечении ХСН;
избегать назначения НПВП;
контролировать АД и содержание электролитов крови через 1-2нд после каждого увеличения дозы.
Б-адреноблокаторы БАБ
Основные положения по применению БАБ в лечении ХСН:
БАБ нужно применять у всех больных с ХСН, не имеющих противопоказаний, обычных для этой группы лекарств.
БАБ нужно применять только «сверху» (т.е. дополнительно к иАПФ).
БАБ в дополнение к иАПФ нужно применять у всех пациентов с бессимптомной дисфункцией ЛЖ после перенесённого инфаркта миокарда.
БАБ нужно применять только у больных, у которых достигнута стабилизация состояния (отсутствуют признаки застоя, нет необходимости во внутривенной терапии).
Для лечения ХСН БАБ рекомендованы только 4 препарата:
бисопролол, карведилол, метопролола сукцинат (с замедленным высвобождением) и небиволол.
Лечение БАБ при ХСН нужно начинать с 1/8 терапевтической дозы. Дозы увеличивают медленно (не чаще 1р в 2нд) до достижения оптимальной (табл. 79).
Таблица 79. Дозы бета-адреноблокаторов для лечения ХСН

При ухудшении СН, развитии гипотонии или брадикардии во время титрации следует придерживаться следующего алгоритма:
тщательный мониторинг состояния (признаков СН, гемодинамики);
при ухудшении СН в первую очередь увеличить дозу диуретиков и иАПФ; при необходимости временно снизить дозу БАБ;
при гипотонии в первую очередь снизить дозу вазодилататоров; при необходимости временно снизить дозу БАБ;
при брадикардии снизить дозу или отменить препараты, урежающие ЧСС; при необходимости снизить дозу БАБ или отменить последние при наличии явных показаний;
- всегда рассматривать возможность повторного назначения БАБ или увеличения их доз после стабилизации состояния.
При необходимости инотропной поддержки во время декомпенсации кровообращения у пациентов, находящихся на постоянной терапии БАБ, препарат выбора — сенситизатор кальция левосимендан, так как его гемодинамический эффект не зависит от степени бета-блокады.
Противопоказания к назначению БАБ при ХСН — бронхиальная астма и/или тяжёлая ХОБЛ и симптомная брадикардия или гипотония.
Часть пациентов может находиться на лечении нерекомендованными БАБ (чаще всего атенололом или метопрололом тартратом короткого действия). В табл. 80 представлена схема перевода на рекомендуемые БАБ.
Таблица 80. Схема перевода больных с ХСН с атенолола и метопролола тартрата на рекомендованные бета-адреноблокаторы

Следующая категория больных с ХСН при лечении БАБ нуждается в особом наблюдении специалиста-кардиолога:
тяжёлая ХСН (III—IV ФК);
СН неизвестной этиологии;
наличие относительных противопоказаний: брадикардия, гипотония, плохая переносимость низких доз БАБ, сопутствующая ХОБЛ;
сведения об отмене БАБ в прошлом из-за побочных реакций или обострения СН.
Антагонисты алъдостерона (спиронолактон)
Основные положения по применению антагонистов альдостерона в лечении ХСН.
Антагонисты альдостерона назначают дополнительно к иАПФ и БАБ пациентам с ХСН III—IV ФК.
Для постоянного приёма рекомендуемая доза спиронолактона при ХСН 25мг/сут.
Рекомендации по назначению и контролю терапии антагонистами альдостерона.
Показаны только пациентам с III—IV ФК ХСН.
Начинать лечение, только если уровень калия сыворотки <5ммоль/л и креатинина <250ммоль/л.
Рекомендуемая дозировка спиронолактона для длительного приёма 25 мг/сут.
Контроль уровней калия сыворотки и креатинина крови каждые 4—6нд.
Если после начала лечения уровень калия сыворотки превышает 5—5,5ммоль/л, доза спиронолактона должна быть снижена на 50%, а при уровне калия сыворотки >5,5ммоль/л терапия спиронолактоном должна быть прекращена.
Если через месяц терапии симптомы СН всё ещё выражены — увеличить дозу спиронолактона до 50мг/сут (при условии нормокалиемии). После увеличения дозы спиронолактона — контроль уровней калия сыворотки и креатинина через 1нд.
Диуретики
Основные положения по применению диуретиков в лечении ХСН.
Лечение диуретиками начинают лишь при клинических признаках застоя (НА стадия, II ФК по NYHA). Впрок мочегонными не лечат.
Лечение диуретиками начинают с применения слабейшего из эффективных у данного пациента препаратов.
Предпочтение следует отдавать тиазидным диуретикам (гидрохлоротиазид) и лишь при их недостаточной эффективности переходить к назначению мощных петлевых диуретиков (фуросемид, этакриновая кислота, буметанид).
Всегда комбинировать диуретики с иАПФ.
При скорости клубочковой фильтрации <30мл/мин не использовать тиазидные диуретики
Алгоритм назначения диуретиков в зависимости от тяжести ХСН:
I ФК не лечить мочегонными;
II ФК (без застоя) не лечить мочегонными;
II ФК (застой) тиазидные диуретики; только при их неэффективности назначить петлевые диуретики;
III ФК (декомпенсация ) петлевые (тиазидные) + антагонисты альдостерона 100-300мг/сут;
III ФК (поддерживающее лечение) тиазидные (петлевые) + спиронолактон (малые дозы);
IV ФК петлевые + тиазидные (иногда сочетание двух петлевых диуретиков фуросемида и этакриновой кислоты) + антагонисты альдостерона.
Таблица 81. Дозы диуретиков при ХСН

Сердечные гликозиды
Основные положения по применению сердечных гликозидов в лечении ХСН.
Сердечные гликозиды показаны при мерцательной аритмии и симптомной СН безотносительно степени дисфункции сердца.
Сердечные гликозиды не улучшают прогноз, но способствуют снижению количества госпитализаций среди пациентов с ХСН и систолической дисфункцией ЛЖ с синусовым ритмом.
Основной препарат из группы сердечных гликозидов для лечения ХСН —дигоксин.
Доза дигоксина для лечения ХСН не должна превышать 0,25мг/сут.
Предикторами успеха лечения гликозидами больных с ХСН являются низкая ФВЛЖ <25%, кардиомегалия, неишемическая этиология СН.
Антагонисты рецепторов к ангиотензину-II (АРА-II) Основные положения по применению АРА-П в лечении ХСН.
АРА-И и иАПФ обладают одинаковой эффективностью по снижению смертности и заболеваемости при ХСН.
АРА-И должны быть использованы как альтернатива иАПФ при непереносимости последних.
Тройная комбинация (иАПФ + БАБ + АРА-П) не является оптимальной. Только при непереносимости БАБ следует переходить на комбинацию иАПФ + АРА-П. При хорошей переносимости иАПФ + БАБ в качестве 3-го нейрогормонального модулятора следует использовать спиронолактон.
Таблица 82. Доступные АРА-П и рекомендуемые дозы

Эффективность влияния на смертность и заболеваемость доказана в крупных клинических испытаниях.
Рекомендации по безопасному применению АРА-П аналогичны рекомендациям по безопасному применению иАПФ (см. выше).
ДОПОЛНИТЕЛЬНЫЕ СРЕДСТВА В ЛЕЧЕНИИ СН
Антитромботические средства (антикоагулянты)
Основные положения по применению антитромботических средств в лечении ХСН.
Непрямые антикоагулянты (варфарин, аценокумарол) следует назначать всем пациентам с ХСН и мерцательной аритмией.
Независимо от основного сердечного ритма непрямые антикоагулянты должны получать все пациенты с ХСН, перенёсшие тромбоэмболические осложнения и/или с наличием мобильного (флотирующего) тромба в полости ЛЖ.
Непрямые антикоагулянты не могут быть заменены антиагрегантами (ацетилсалициловая кислота, клопидогрел, тиклопидин) для уменьшения риска тромбоэмболических осложнений.
Для вторичной профилактики после перенесённого инфаркта миокарда следует использовать либо ацетилсалициловую кислоту, либо непрямые антикоагулянты (но не вместе).
Следует избегать назначения ацетилсалициловой кислоты больным с частыми повторными госпитализациями по поводу ухудшения ХСН.
Терапия непрямыми антикоагулянтами должна проводиться под контролем 1р в мc международного нормализованного отношения MHO. Безопасным/эффективным диапазоном MHO является 2—3.
Вспомогательные средства в лечении СН
Вазодилататоры
Основные положения по применению вазодилататоров в лечении ХСН.
Нитраты разрешено назначать при наличии доказанной ИБС и стенокардии, которая проходит именно от нитропрепаратов.
Блокаторы кальциевых каналов (дигидроперидинового ряда — амлодипин или фелодипин) разрешают использовать при наличии упорной стенокардии, сопутствующей стойкой АГ, высокой лёгочной гипертензии, выраженной клапанной регургитации.
Антиаритмические средства
Основные положения при лечении желудочковых нарушений ритма сердца у больных с ХСН.
Лечения при ХСН требуют лишь опасные для жизни и симптомные желудочковые нарушения ритма сердца.
Антиаритмики I и IV классов (по классификации Vaughan-Williams) противопоказаны больным с ХСН.
БАБ являются средством выбора для антиаритмического лечения.
При неэффективности БАБ для антиаритмического лечения применяют препараты III класса (амиодарон, соталол).
Средством выбора лечения желудочковых нарушений ритма сердца у больных с умеренной ХСН (I-II ФК) служит амиодарон.
У больных с выраженной ХСН (III—IV ФК) амиодарон не следует применять.
Наиболее оправданным методом профилактики внезапной смерти у больных с ХСН и жизнеугрожающими аритмиями служит постановка имплантируемого кардиовертера-дефибриллятора.
Основные положения при лечении мерцательной аритмии у больных с ХСН.
По влиянию на смертность/заболеваемость разницы между двумя тактиками лечения (удержание синусового ритма или контроль xcc) нет. Целесообразность восстановления и удержания синусового ритма оставляется на усмотрение врача.
Наиболее эффективным антиаритмиком для удержания синусового ритма является амиодарон.
Для контроля xcc при мерцательной аритмии наиболее эффективной комбинацией является БАБ + дигоксин.
Препараты, не рекомендованные к применению при ХСН.
НПВП.
Трициклические антидепрессанты.
Антиаритмики 1 класса.
Блокаторы кальциевых каналов (верапамил, дилтиазем, короткодействующие дигидропиридины).
Глюкокортикоиды. Применение стероидных гормонов имеет чисто симптоматические показания в случаях упорной гипотонии и тяжёлого отёчного синдрома для облегчения начала лечения иАПФ, диуретиками и БАБ.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Хирургическое лечение ХСН
Операции реваскуляризации миокарда (аортокоронарное шунтирование). До получения достоверных данных операция реваскуляризации не может быть рекомендована на рутинной основе.
Коррекция митральной регургитации. Следует направлять больных с ХСН, тяжёлой митральной регургитацйей и дилатацией полостей сердца.
Кардиомиопластика. На сегодняшний день не может быть рекомендована для лечения ХСН.
Пересадка сердца. Пациентов с ХСН и низким пиковым потреблением кислорода (менее 14мл/мин/кг массы тела или менее 50% процентов от возрастного максимума) на максимальной медикаментозной терапии направляют на обследование для включения в программу пересадки сердца.
Противопоказания для трансплантации сердца
Злоупотребление алкоголем и/или наркотиками.
Отсутствие должного понимания со стороны пациента.
Хроническое неконтролируемое психическое заболевание.
Злокачественные новообразования.
Системные заболевания с поражением многих органов.
Неконтролируемая инфекция.
Тяжёлая почечная недостаточность (клиренс креатинина <50мл/мин; креатинин >250ммоль/л).
Высокая лёгочная гипертония (6—8ЕД по Вуду; систолическое лёгочное артериальное давление >60мм рт.ст.).
Недавно перенесённое тромбоэмболическое осложнение
Незаживающая пептическая язва.
Значительное нарушение функции печени.
Наличие другого заболевания с плохим прогнозом.
ЭЛЕКТРОФИЗИОЛОГИЧЕСКИЕ МЕТОДЫ ЛЕЧЕНИЯ
Электрофизиологические методы лечения сводятся к трём процедурам.
Имплантация обычных кардиостимуляторов — при наличии синоатриальных и атриовентрикулярных блокад высокой степени.
Имплантация трёхкамерных кардиостимуляторов (ресинхронизирующая терапия) показана при наличии следующих критериев:
низкая ФВЛЖ <35%;
признаки диссинхронии сокращения желудочков (блокада левой ножки пучка Гиса с QRS >120мс);
рефрактерная к оптимальной медикаментозной терапии СН (NYHA III—IV).
Постановка имплантируемого кардиовертера-дефибриллятора показана при наличии следующих критериев:
перенесённая остановка кровообращения в анамнезе;
перенесённая гемодинамически нестабильная желудочковая тахикардия;
больным после 40дней от перенесённого инфаркта миокарда, имеющих признаки СН на фоне ФВЛЖ <30—35% и находящихся на оптимальной медикаментозной терапии;
пациентам, имеющим показания к имплантации трёхкамерного кардиостимулятора (ресинхронизатора), целесообразна постановка комбинированного устройства (имплантируемый кардиовертер-дефибриллятор+ресинхронизатор).
ОБУЧЕНИЕ ПАЦИЕНТА
Следует информировать пациентов о важности ежедневного контроля массы тела в ходе лечения сердечной недостаточности. Пациент ежедневно должен взвешиваться и записывать массу тела. При увеличении массы тела более чем на 2кг за 1-3дня пациенту следует связаться с врачом. Необходимо привлекать членов семьи и медицинских работников, включая медицинских сестёр, физиотерапевтов, диетологов, к поощрению усилий пациента по контролю массы тела.
Необходимо убеждать пациентов придерживаться низкосолевой диеты и ограничивать приём жидкости. Потребление поваренной соли нужно снизить до 3г/сут. Кроме того, нужно удостовериться, что пациент полностью понимает все детали его режима медикаментозной терапии. Пациент должен:
знать, как и когда принимать лекарства;
иметь понятный перечень рекомендаций, включающий название, дозу и частоту приёма каждого препарата;
знать наиболее частые побочные эффекты принимаемых препаратов и понимать необходимость обращения к врачу в случае их появления.
Следует рекомендовать членам семей больных с сердечной недостаточностью обучиться навыкам сердечно-лёгочной реанимации.
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ
Необходимо регулярно оценивать функциональный класс ХСН и наличие задержки жидкости. Во время каждого посещения следует:
оценивать и регистрировать в медицинской документации наличие признаков задержки жидкости;
определять и регистрировать функциональный статус пациента в соответствии с классификацией ХСН;
определять и регистрировать массу тела пациента.
Контрольные посещения нужно использовать в том числе для обучения пациента. На консультацию к кардиологу больного нужно направить в том случае, если, несмотря на адекватную терапию, наблюдают ухудшение функционального состояния больного или сохраняются признаки задержки жидкости, вопреки ограничению при употреблении поваренной соли и приёме жидкости и неукоснительному соблюдению больным предписанной лекарственной терапии.
Следует проводить перечисленные ниже лабораторные исследования не реже 1р в год (или чаще, в зависимости от клинических показаний).
Содержание электролитов и концентрацию дигоксина в сыворотке крови не реже 1р в год, а также после изменений в терапии.
Состояние функций почек (включая содержание мочевины и креатинина) не реже 1р в год.
Следует внимательно наблюдать за состоянием пациента при назначении препаратов с выраженными побочными эффектами. Контролируют следующие показатели.
Международное нормализованное отношение при применении непрямых антикоагулянтов (варфарин).
Функции печени при применении статинов.
Необходимо осуществлять контроль за применением препаратов, которые могут ухудшить течение ХСН или противопоказаны при этом состоянии.
Больным следует избегать приёма НПВП и ингибиторов ЦОГ-2.
У больных, у которых начата терапия препаратами из группы тиазолидиндионов (пиоглитазон), возможно появление признаков задержки жидкости.
Следует избегать назначения метформина больным со склонностью к быстрому возникновению отёков или с почечной недостаточностью.
ПРОГНОЗ
Однолетняя смертность больных с клинически выраженной СН достигает 30%. Пятилетняя выживаемость больных с ХСН не превышает 50%. Риск внезапной смерти больных с ХСН выше, чем в популяции в целом, в 5 раз.
ИНВАЗИВНЫЕ ВМЕШАТЕЛЬСТВА НА КОРОНАРНЫХ АРТЕРИЯХ
ДИАГНОСТИЧЕСКАЯ АНГИОГРАФИЯ КОРОНАРНЫХ АРТЕРИЙ
Ангиографическое исследование коронарных артерий активно применяют в кардиологической практике. В последнее десятилетие метод стал средством рутинной диагностики в комплексном обследовании больных ишемической болезнью сердца. Тем не менее, в практической работе часто возникают вопросы о показаниях и сроках проведения коронарографии КАГ в различных клинических ситуациях.
ОПИСАНИЕ МЕТОДА
Коронарография — инвазивное диагностическое исследование, проводимое для оценки состояния коронарных артерий и коронарного кровотока, выявления патологических изменений артерий, качественной и количественной характеристики поражённых сегментов. При ангиографическом исследовании в коронарные артерии селективно вводят рентгеноконтрастное вещество и производят многопроекционную съёмку. Исследование производят в типовой лаборатории, оснащённой современными ангиографическими установками, где есть необходимое оборудование и другие условия для борьбы с большими и малыми осложнениями (при постоянном мониторировании ЭКГ и АД). Исследование проводят традиционным бедренным доступом, а в последние годы широко применяют лучевой доступ. Современные тонкие катетеры, использование лучевого доступа и возможность ранней активизации пациента позволяют проводить КАГ амбулаторно.
Амбулаторная КАГ повышает эффективность эксплуатации оборудования, почти вдвое удешевляет процедуру и даёт возможность выполнять диагностическую коронарографию на более ранних этапах обследования больного. Если в клинике число однососудистых поражений диагностируют в 15—20% случаев, то при амбулаторной КАГ однососудистое поражение выявляют у 30-40% больных.
ПОКАЗАНИЯ К ПРОВЕДЕНИЮ КОРОНАРНОЙ АНГИОГРАФИИ
Ишемическая болезнь сердца ИБС — одно из самых распространённых заболеваний среди социально активной группы населения. Как правило, адекватное лечение ИБС требует точной диагностики с помощью коронарной ангиографии и выполнения процедур эндоваскулярной реваскуляризации для облегчения симптомов ишемии миокарда и увеличения продолжительности жизни.
Полученные в результате ангиографического исследования данные позволяют наиболее объективно определить тактику ведения больного и своевременно выбрать оптимальный метод лечения: консервативная терапия или операция реваскуляризации миокарда - эндоваскулярная ангиопластика и стентирование коронарных артерий и аортокоронарных шунтов или аортокоронарное шунтирование.
Рентгеноконтрастную коронарографию в большинстве случаев проводят в трёх клинических ситуациях:
для выявления поражения коронарных артерий, когда диагноз ИБС не удаётся установить по данным неинвазивных тестов;
для определения возможности реваскуляризации миокарда (эндоваскулярного лечения или аортокоронарного шунтирования) у больных с ИБС;
для оценки отдалённых результатов операции реваскуляризации или результатов медикаментозного лечения (прогрессирования/регресса коронарного атеросклероза).
Информация, получаемая при коронарографии:
тип кровоснабжения миокарда и варианты отхождения коронарных артерий;
наличие, локализация, протяжённость, степень и характер атеросклеротического поражения коронарного русла;
признаки осложнённого поражения (тромбоз, изъязвлённость, кальциноз и др.);
спазм коронарной артерии;
миокардиальный мостик;
оценка коллатерального кровотока;
аномальная анатомия коронарных артерий.
Факторами, определяющими показания для проведения коронарографии, в большинстве случаев являются клинические проявления ИБС и объективные признаки ишемии миокарда.
КЛАССИФИКАЦИЯ АНГИОГРАФИИ ПО СРОКАМ ПРОВЕДЕНИЯ
По срокам выполнения КАГ условно можно разделить на экстренную, неотложную и плановую.
Экстренную коронарографию (в течение 6ч) выполняют в случае нестабильной стенокардии высокого и умеренного риска, при рецидивирующем болевом синдроме, рефрактерном к адекватной терапии.
Острый коронарный синдром (острый ИМ; ИМ с подъёмом сегмента ST, ИМ без подъёма сегмента ST; ИМ, диагностируемый по уровню ферментов; ИМ, диагностируемый по уровню биомаркёров; ИМ, диагностируемый по поздним изменениям ЭКГ; нестабильная стенокардия) — показание для выполнения коронарографии и, при необходимости, эндоваскулярной реваскуляризации в экстренном порядке.
Сроки проведения коронарографии при инфаркте миокарда в острейшей стадии
Подозрение на инфаркт миокарда с подъёмом ST
в течение 12ч от начала симптомов или свыше 12ч (при сохранении боли) с целью выполнения чрескожной транслюминальной баллонной коронарной ангиопластики ТБКА в качестве альтернативы тромболитической терапии;
в течение 36ч после начала заболевания при развитии кардиогенного шока, длительность которого не превышает 18ч.
Подозрение на инфаркт миокарда без подъёма ST
продолжающаяся или рецидивирующая ангинальная боль, спонтанная или провоцируемая, независимо от изменений на ЭКГ;
наличие шока, выраженных застойных явлений в лёгких, сохраняющаяся гипотония.
Неотложную коронарографию в течение 6-12ч проводят:
при ухудшении состояния больного, находящегося в стационаре из-за прогрессирования стенокардии напряжения;
при присоединении приступов стенокардии покоя;
при отсутствии эффекта от максимальной антиангинальной терапии;
при ухудшении состояния больного после проведённой эндоваскулярной операции или аортокоронарного шунтирования (наличие ангинального синдрома, отрицательной динамики на ЭКГ, повышение уровня кардиоспецифических ферментов и др.).
Плановую коронарографию проводят в следующих случаях
Объективные признаки ишемии миокарда:
преходящие изменения ишемического характера, зарегистрированные на ЭКГ покоя или по данным суточного мониторирования ЭКГ;
положительный результат нагрузочной пробы (велоэргометрия или тредмил, ЧПЭС, стресс-эхоКГ, сцинтиграфия миокарда).
Приступы стенокардии напряжения и покоя на фоне антиангинальной терапии.
Ранняя постинфарктная стенокардия.
Критерии высокого риска ИБС по результатам неинвазивного обследования.
Наличие в анамнезе опасных желудочковых нарушений ритма с высоким риском клинической смерти, указание на внезапную клиническую смерть.
Перед операциями на клапанном аппарате сердца после 40-летнего возраста.
Дифференциальная диагностика с некоронарогенными заболеваниями миокарда (в том числе атипичный болевой синдром, ДКМП, ГКМП и ДР).
Социальные показания при минимально выраженных и нечётких признаках ишемии миокарда, при условии, что профессия больного связана с риском для жизни других людей (лётчики, водители), боевыми дежурствами.
У больных после трансплантации сердца общепринятый протокол наблюдения включает ежегодное проведение КАГ, часто в сочетании с внутрисосудистым ультразвуковым исследованием.
Нестабильная стенокардия
Показания к проведению КАГ при нестабильной стенокардии (НС):
НС высокого и умеренного риска, при рецидивирующем болевом синдроме, рефрактерном к адекватной терапии, — экстренная коронарография (в течение 6ч);
НС высокого и умеренного риска, стабилизированная медикаментозно — коронарография через 3-4сут;
НС низкого риска при наличии критериев высокого риска по данным неинвазивного тестирования в плановом порядке.
Бессимптомное/малосимптомное течение ИБС
При бессимптомном или малосимптомном течении ИБС решающее значение имеют результаты нагрузочных проб и наличие показателей высокого риска неблагоприятных клинических исходов.
Показатели высокого риска (смертность в течение 1 года >3%) неблагоприятных клинических исходов у больных с ИБС по результатам неинвазивного обследования:
выраженное нарушение сократительной функции левого желудочка (ЛЖ) в покое (ФВ <35%);
выраженное снижение сократительной функции ЛЖ во время нагрузочного теста (ФВ <35%);
нарушение локальной сократимости ЛЖ более чем в 2 сегментах на низкой ступени добутамин-стресс-эхокардиографии (<10 мг/кг/мин) или при низкой ЧСС (<120 в минуту);
выраженные признаки ишемии миокарда во время добутамин-стресс ЭхоКГ;
большой преходящий дефект перфузии миокарда, индуцируемый во время нагрузочного теста (особенно передней локализации) (таллий-201);
множественные преходящие дефекты перфузии миокарда, индуцируемые во время нагрузочной пробы (таллий-201);
распространённый фиксированный дефект перфузии с дилатацией ЛЖ и повышенным накоплением таллия-201 в лёгких;
преходящий дефект перфузии во время нагрузочного теста с дилатацией ЛЖ и повышенным накоплением таллия-201 в лёгких.
Целесообразно плановое проведение коронарографии у больных с бессимптомным или малосимптомным течением ИБС при наличии сопутствующих факторов: перенесённого инфаркта миокарда, сахарного диабета, курения, ожирения, артериальной гипертонии, гиперлипидемии.
Пациенты, перенёсшие клиническую смерть
Взрослые больные,- перенёсшие внезапную клиническую смерть, у которых нет данных, подтверждающих другие причины остановки сердца, как правило, страдают тяжёлым атеросклерозом коронарных артерий. У таких больных сохраняется высокий риск повторной остановки сердца, поэтому для определения причины опасных нарушений ритма и планирования тактики лечения таким больным показана КАГ. По данным литературы, в 50% случаев КАГ выявляла острую коронарную окклюзию у выживших после клинической смерти больных. Экстренная баллонная ангиопластика — независимый прогностический фактор выживаемости. Плановое выполнение АКШ также приводит к уменьшению количества случаев неблагоприятного исхода в группе больных, перенёсших внезапную клиническую смерть.
Стабильная стенокардия напряжения
Коронарографию при стабильной стенокардии напряжения, как правило, проводят в плановом порядке.
При I—II ФК стенокардии больного направляют на КАГ в случае непереносимости антиангинальных препаратов либо резистентности к медикаментозному лечению.
Больным I—II ФК стенокардии напряжения, даже при отсутствии факторов высокого риска неблагоприятного исхода, показано проведение КАГ, если их профессия связана с безопасностью других людей (лётчики, водители, машинисты, пожарные, боевые дежурства и т.д.).
Приступы стенокардии II—IV ФК — показание для выполнения КАГ не столько с диагностической целью, сколько для определения тактики дальнейшего лечения, так как высокий класс стенокардии свидетельствует о тяжёлом поражении коронарного русла.
Не следует рекомендовать проведение КАГ, если больной удовлетворён качеством своей жизни и не согласен на дальнейшее эндоваскулярное или оперативное лечение.
Нетипичные боли в грудной клетке
Ишемия миокарда редко бывает причиной нетипичных болей в грудной клетке: в 14% случаев у мужчин и в 6% у женщин. Болевые приступы могут быть вызваны вариантной стенокардией и коронароспазмом, проявлением синдрома X, кардиалгией при нейроциркуляторных дисфункциях, пролапсом митрального клапана, миокардитом, перикардитом, расслоением аорты и т.д. Возможные причины атипичных болевых приступов в грудной клетке, не связанных с сердечной патологией, — различные интоксикации, корешковый синдром, остеохондроз, некоторые заболевания пищевода, нарушающие желудочно-пищеводную моторику.
При исключении внесердечных причин болей, а также если у больного есть факторы риска сердечно-сосудистых заболеваний, решение о выполнении КАГ принимают по результатам неинвазивного обследования:
если данные свидетельствуют о наличии объективных признаков ишемии миокарда либо о высоком риске неблагоприятного исхода болезни, необходимо выполнение КАГ;
больным, неоднократно поступающим в стационар с атипичными болевыми приступами, при отсутствии факторов риска ИБС, также рекомендована КАГ.
Данные исследований показывают, что при нормальных результатах коронарографии наблюдают снижение частоты болевых приступов и последующих госпитализаций.
Коронарография с целью дифференциальной диагностики при атипичных болевых приступах и при подозрении на ИБС необходима тогда, когда больного нельзя обследовать неинвазивными методами, поскольку его физические возможности ограничены.
Пороки сердца
Наличие гемодинамически значимых стенозов коронарных артерий при всех типах приобретённых пороков сердца осложняет течение заболевания и ухудшает отдалённый прогноз. Поэтому в предоперационное обследоваие больного, имеющего объективные признаки ишемии миокарда и/или боли в грудной клетке, особенно при сопутствующих факторах риска ИБС и пожилом возрасте, рекомендовано включать КАГ. При КАГ выявляют также возможные нераспознанные аномалии развития коронарных артерий, которые могут привести к повреждению сосудов во время операции по коррекции порока сердца.
Систолическая дисфункция левого желудочка
У больных со значительным нарушением систолической функции миокарда левого желудочка и проявлениями стенокардии КАГ целесообразна в случаях, когда, по данным стресс-эхоКГ, в сегментах с нарушенной сократимостью есть гибернирующий жизнеспособный миокард. В таких ситуациях последующая реваскуляризация коронарных артерий может привести к улучшению систолической функции миокарда левого желудочка. КАГ также проводят у больных, имеющих в анамнезе эпизоды отёка лёгких неустановленного генеза для исключения стенозирующего поражения коронарных артерий.
ОСЛОЖНЕНИЯ КОРОНАРОГРАФИИ
Риск осложнений при коронарографии не превышает 2% и в значительной степени зависит от тяжести состояния пациента и сопутствующих заболеваний.
Таблица 84. Осложнения % при КАГ в лаборатории рентгенангиографии РКНПК 1998-2005 гг.(п=6056)

Таблица 83. Риск осложнений во время КАГ, % (по данным 1991 г., США [п=59 792])

Неблагоприятные факторы, увеличивающие риск осложнений:
нестабильность клинического состояния;
у больных с критическим поражением основного ствола левой коронарной артерии риск возникновения серьёзных осложнений в 2р выше.
ПРОТИВОПОКАЗАНИЯ
Считается, что абсолютных противопоказаний к проведению ангиографического исследования нет. К относительным противопоказаниям КАГ относят следующие заболевания и состояния:
острую почечную недостаточность;
хроническую почечную недостаточность (уровень креатинина в крови не более 150ммоль/л);
активное желудочно-кишечное кровотечение, обострение язвенной болезни;
выраженную коагулопатию;,
выраженную анемию;
острое нарушение мозгового кровообращения;
выраженное нарушение психического состояния больного;
серьёзные сопутствующие заболевания, которые значительно укорачивают жизнь больного или резко увеличивают риск последующих лечебных вмешательств;
отказ больного от возможного дальнейшего лечения после исследования (эндоваскулярное лечение, АКШ);
документированный анафилактический шок на контрастное вещество в анамнезе;
выраженное поражение периферических артерий, ограничивающее артериальный доступ;
декомпенсированную сердечную недостаточность или острый отёк лёгких;
злокачественную артериальную гипертонию, плохо поддающуюся медикаментозному лечению;
интоксикацию сердечными гликозидами;
выраженное нарушение электролитного обмена;
лихорадку неизвестной этиологии и острые инфекционные заболевания;
бактериальный эндокардит;
обострение тяжёлого некардиологического хронического заболевания;
поливалентную аллергию, аллергическую реакцию на контрастное вещество.
Независимые предикторы прогрессирования почечной недостаточности после КАГ — исходный уровень креатинина, сахарный диабет и объём использованного контрастного вещества.
ОБСЛЕДОВАНИЕ БОЛЬНОГО ПЕРЕД КОРОНАРНОЙ АНГИОГРАФИЕЙ
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
Определить наличие и характер основных клинических симптомов.
Определить функциональный класс стенокардии.
Выявить наличие сопутствующей патологии (аллергологический анамнез, язвенная болезнь, АГ, СД, недостаточность кровообращения, геморроидальное кровотечение, меноррагия, острый тромбофлебит и др.).
Уточнить анамнез больного (количество перенесённых инфарктов миокарда и др.).
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Маркёры гепатитов, ВИЧ, RW (не позднее 3нд).
Группа крови, резус-фактор.
Общий анализ крови (лейкоциты, эритроциты, тромбоциты, СОЭ).
Биохимический анализ крови (К, Na, глюкоза, креатинин, мочевина, билирубин, AST, ALT) .
Коагулограмма.
ИНСТРУМЕНТАЛЬНОЕ ОБСЛЕДОВАНИЕ
ЭКГ.
ЭхоКГ (размер полостей сердца, размер аорты, сократимость миокарда левого желудочка, клапанный аппарат).
Суточное мониторирование ЭКГ (ЧСС, признаки ишемии миокарда, нарушение ритма и проводимости).
Рентгенография органов грудной клетки.
УЗДГ подключично-сонного и подвздошно-бедренного сегментов артерий.
ПОДГОТОВКА К АНГИОГРАФИЧЕСКОМУ ИССЛЕДОВАНИЮ
Подготовка места пункции (правое запястье, правая паховая складка).
Душ, туалет, смена постельного белья.
Плановый приём лекарств.
Исследование проводят натощак.
Необходимы видеокассета и лазерный диск.
ВЕДЕНИЕ ПОСЛЕ ПРОЦЕДУРЫ
Стационарный этап
После выполнения процедуры и завершения гемостаза накладывают давящую повязку на место пункции и больного переводят в отделение под наблюдение дежурного врача. Решение о переводе больного в палату интенсивного наблюдения принимают в зависимости от состояния гемодинамики и данных коронарографии: при значимом стенозе ствола левой коронарной артерии пациента наблюдают в течение 1-2ч в палате интенсивного наблюдения, так как риск возможных осложнений в таких обстоятельствах, в том числе отсроченных, увеличивается в 2р.
У всех больных, перенёсших инвазивную процедуру, необходимо контролировать эффективность давящей повязки и состояние места пункции артерии, температуру тела, ЭКГ, АД, диурез. При наличии сопутствующей патологии нужен мониторинг соответствующих параметров.
Больной должен выпить 1л негазированной питьевой воды в течение 1ч, на следующий день сдать мочу для общего анализа.
Постельный режим после использования бедренного доступа до 24ч, лучевого доступа 2-3ч.
При выполнении процедуры лучевым доступом больного можно выписать из стационара через 3-4ч после процедуры, при бедренном доступе через 18—24ч.
Амбулаторный этап
Тактику ведения больного на амбулаторном этапе определяют в основном характер и степень поражения коронарных артерий.
ПРИЛОЖЕНИЕ К РАЗДЕЛУ «ДИАГНОСТИЧЕСКАЯ АНГИОГРАФИЯ КОРОНАРНЫХ АРТЕРИЙ»
Информированное согласие на проведение коронарографии
Вам предлагают проведение коронаровентрикулографии — исследования полостей и сосудов сердца под рентгенологическим контролем в специально оборудованной операционной. Коронарография — наиболее точный метод для изучения особенностей анатомии сосудов сердца, локализации и степени их сужения. Это имеет важнейшее значение для правильного выбора тактики лечения Вашего заболевания (баллонная ангиопластика, стентирование или операция аортокоронарного шунтирования коронарных артерий). В неясных случаях проведение коронарографии назначают для точного установления диагноза, течения заболевания, лечения и прогноза.
Исследование проводят через бедренную или лучевую артерию под местной анестезией новокаином или лидокаином. Пункционным методом через артерию в аорту последовательно вводят специальные тонкие катетеры, которые устанавливаются в устье артерии и в различных отделах сердца. Через катетер вводят йодсодержащее рентгеноконтрастное неионное вещество, заполняющее просвет артерии или полость левого желудочка и позволяющее увидеть их с помощью специальной телекамеры. Как правило, контраст вводят несколько раз для визуализации артерии в разных проекциях. Во время исследования регистрируют электрокардиограмму, давление в аорте и в полостях сердца, получают изображение артерий сердца в различных фазах его сокращения.
Во время проведения местного обезболивания Вы можете почувствовать небольшую боль в месте пункции, а во время введения контрастного вещества также небольшое ощущение «жара» и другие ощущения, связанные с особенностями Вашей гемодинамики.
Коронаровентрикулография — относительно безопасный метод, с накоплением опыта её проведения риск серьёзных осложнений снизился: инфаркт миокарда у 0,06—0,1% больных, в 0,07-0,2% случаев острое или преходящее нарушение мозгового кровообращения, смертельные случаи наблюдают у 0,1% больных. Примерно у 0,6% пациентов могут возникнуть осложнения в области пункции артерии (кровотечение, тромбоз или аневризма артерии), что изредка требует хирургического лечения или переливания крови. Очень редко отмечаются такие осложнения, как повреждение стенки сердца, аллергическая реакция на контрастное вещество.
Своей подписью Вы удостоверяете, что с техникой проведения процедуры, возможными осложнениями и способами их лечения ознакомлены, на проведение процедуры согласны.
Ф.И.О. ПОДПИСЬ бОЛЬНОГО
Ф.И.О. ПОДПИСЬ ВРАЧА
ЭНДОВАСКУЛЯРНЫЕ ОПЕРАЦИИ НА КОРОНАРНЫХ АРТЕРИЯХ
Коронарная ангиопластика — быстро развивающаяся на протяжении последних 25лет область кардиологии. За это время пройден путь от баллонной дилатации проксимальных неосложнённых поражений коронарных артерий до имплантации стентов в протяжённые и окклюзионные поражения. По мере совершенствования техники ангиопластики расширились возможности и эффективность операции.
ОБЩИЕ ПОКАЗАНИЯ К ПРОВЕДЕНИЮ ЧРЕСКОЖНЫХ ЭНДОВАСКУЛЯРНЫХ ВМЕШАТЕЛЬСТВ
Разработаны показания к проведению баллонной ангиопластики и стентирования коронарных артерий при различных формах ишемической болезни сердца.
Чрескожные эндоваскулярные вмешательства показаны в следующих клинических ситуациях.
Приступы стенокардии напряжения или покоя и(или) объективные признаки ишемии миокарда по данным нагрузочных проб (велоэргометрия, тредмил, чреспищеводная электрокардиостимуляция ЧПЭС, перфузионная сцинтиграфия миокарда, стресс-эхоКГ, холтеровское мониторирование ЭКГ или ЭКГ покоя во время спонтанного приступа стенокардии).
Недостаточный эффект антиангинальных препаратов.
Наличие на ангиограмме одного или нескольких стенозов размером более 60% по диаметру, расположенных в технически доступном сегменте коронарного русла, пригодных для проведения транслюминальной баллонной коронарной ангиопластики ТБКА, стентирования, атерэктомии или других катетерных методов лечения. Это определяют врачи отдела рентгенангиографии и эндоваскулярных методов лечения.
Отсутствие противопоказаний к назначению антикоагулянтов и антиагрегантов.
ПОКАЗАНИЯ К БАЛЛОННОЙ АНГИОПЛАСТИКЕ
Баллонная дилатация коронарных артерий показана больным с ИБС, которые имеют гемодинамически значимые стенозы более 50% диаметра артерии с низким риском осложнений ангиопластики. Морфологические критерии таких стенозов:
дискретность (длина меньше 10мм);
концентричность;
локализация в проксимальных или средних сегментах;
отсутствие ангуляции сосуда более 45°;
гладкие контуры;
отсутствие или малая выраженность кальциноза;
отсутствие тромбоза, полной окклюзии, устьевой локализации, крупных боковых ветвей в месте стеноза.
Таким критериям отвечает стеноз типа А по классификации АНА/АСС (1985). Наличие стеноза типа В сопряжено с повышением риска осложнений баллонной ангиопластики (протяжённость стеноза 10-20мм, эксцентричность, умеренная извитость проксимального сегмента, ангуляция в пределах 45—90°, неровные контуры, умеренно выраженный или тяжёлый кальциноз, окклюзия артерии давностью меньше 3мс, устьевая или бифуркационная локализация, признаки тромбоза).
Противопоказания к баллонной ангиопластике
Противопоказаниями к баллонной дилатации в настоящее время считают:
длину стеноза более 20мм;
выраженную извитость проксимального сегмента;
ангуляцию более 90°;
окклюзию артерии давностью более 3мс;
высокий риск окклюзии боковых ветвей;
стенозы аутовенозных шунтов с дегенеративными изменениями.
Безопасность и исходы внутрикоронарных вмешательств зависят от размера сосуда, длины стеноза, его локализации и морфологических особенностей. Неблагоприятные факторы — диаметр сосуда в месте стеноза менее 3мм, длина стеноза более 15мм, хроническая окклюзия, устьевая локализация, типы В и С стенозов.
ПОКАЗАНИЯ К ИМПЛАНТАЦИИ СТЕНТА:
плановая (элективная) имплантация;
субоптимальный результат ТБКА (остаточный стеноз более 30%);
рестеноз;
окклюзия коронарных артерий. Ангиографически сосуд считают окклюзированным при наличии кровотока степени TIMI 0 или I. Окклюзию считают острой при диагнозе острого инфаркта миокарда или если она возникла как осложнение ТБКА. Во всех остальных случаях она считается хронической;
обширная диссекция (повреждение внутреннего слоя стенки) коронарной артерии в процессе ТБКА;
стеноз венозного шунта.
ПРОВЕДЕНИЕ ЧРЕСКОЖНЫХ ЭНДОВАСКУЛЯРНЫХ ВМЕШАТЕЛЬСТВ В КОНКРЕТНЫХ КЛИНИЧЕСКИХ СИТУАЦИЯХ
Стабильная стенокардия напряжения
Рассматривая показания к эндоваскулярному лечению у больного со стабильной стенокардией, необходимо учесть возможный риск и пользу эндоваскулярного лечения и альтернативные варианты лечения — продолжение медикаментозной терапии или выполнение операции коронарного шунтирования. Все эти варианты обсуждаются с пациентом и его родственниками, которые получают необходимую информацию о преимуществах и недостатках каждого варианта и стоимости терапии. Преимущества эндоваскулярного лечения:
относительная простота процедуры;
малая травматичность;
нет необходимости наркоза и искусственного кровообращения;
значительно меньшее число возможных осложнений в сравнении с операцией КШ.
Однако больной и его родственники должны полностью представлять недостатки эндоваскулярного лечения коронарного атеросклероза ЭЛКА:
неполная реваскуляризация;
риск рестеноза;
перспектива последующей операции КШ.
Необходимое условие процедуры ЭЛКА — возможность срочной операии коронарного шунтирования и реанимационных мероприятий с гемодинамической поддержкой.
На решение о целесообразности эндоваскулярного лечения влияют:
клиническая картина;
наличие гемодинамически значимых стенозов более 60% в сегментах коронарных артерий диаметром более 2,5мм;
функциональное состояние левого желудочка;
сопутствующие заболевания (например, сахарный диабет увеличивает риск рестеноза коронарных артерий и ухудшает отдалённые результаты).
Коронарная артерия, в которой планируют выполнить эндоваскулярное лечение, должна снабжать кровью значительный объём жизнеспособного миокарда.
Стенокардия напряжения IФК. Большинство больных со стенокардией напряжения IФК должны продолжать медикаментозное лечение, при этом нужно проводить интенсивную гиполипидемическую терапию и устранять факторы риска. Эндоваскулярное лечение желательно, если:
высок риск прогрессирования атеросклероза;
по результатам функциональных тестов выражены признаки ишемии миокарда (велоэргометрия, тредмил, холтеровское мониторирование ЭКГ, стресс-эхоКГ с добутамином, перфузионная сцинтиграфия миокарда);
велико стремление пациента продолжить активный образ жизни, занятия спортом, сохранить трудоспособность (дополнительное показание).
Один из важнейших критериев для решения об эндоваскулярном лечении — врачебная оценка степени ишемии миокарда. Кроме того, должны быть предпосылки хорошего результата реваскуляризации и низкого риска осложнений.
Стенокардия напряжения II, III или IV ФК и нестабильная стенокардия. Многие больные с выраженной стабильной стенокардией или нестабильной стенокардией имеют существенные стенозы коронарных артерий, неподдающиеся лечению медикаментами, и поэтому являются кандидатами на реваскуляризацию миокарда с помощью коронарного шунтирования или эндоваскулярных процедур. Значительная часть таких больных имеют дисфункцию левого желудочка, т.е. дополнительное показание к операции КШ или эндоваскулярному лечению.
У больных с ИБС без сахарного диабета со стенозами одной или двух магистральных коронарных артерий высока вероятность первичного успеха ангиопластики, поэтому предпочтение следует отдавать эндоваскулярному лечению.
Меньшей части таких больных показана операция КШ, особенно если реваскуляризацию передней нисходящей коронарной артерии можно выполнить с помощью внутренней грудной артерии или если атеросклерозом поражён основной ствол левой коронарной артерии.
У больных с нестабильной стенокардией или мелкоочаговым инфарктом миокарда (без патологического зубца Q) лечение надо начинать с интенсивной медикаментозной терапии. После стабилизации состояния больного надо выполнить коронарную ангиографию, после чего решить вопрос о целесообразности процедуры эндоваскулярного лечения или операции КШ. Больные ИБС, перенёсшие операцию коронарного шунтирования
Стенозирование шунтов вызывает нарастание признаков ишемии миокарда различной степени, что может привести к повторным операциям реваскуляризации. Риск повторной операции КШ выше по сравнению с первичной операцией (смертность составляет 7—10%), а её эффективность ниже.
Как правило, своевременное эндоваскулярное лечение стеноза или окклюзии как венозных, так и артериальных шунтов приводит к полному устранению симптомов ишемии миокарда. Баллонную ангиопластику в области швов анастомоза безопасно проводить в течение первых дней после операции. Внутрикоронарное введение тромболитических препаратов при необходимости можно проводить в конце первой недели. Опыт использования ингибиторов Hb/Ша тромбоцитов невелик, но, вероятно, при этом риск геморрагических осложнений ниже по сравнению с тромболизисом.
Показания к эндоваскулярному лечению у больных с ИБС после коронарного шунтирования:
рецидивирование ангинозных болей и признаков ишемии миокарда в течение первых 30дней после операции;
возникновение признаков ишемии миокарда через 1—3года после операции у больных с изолированными стенозами артериальных и венозных шунтов и сохранной сократительной функцией левого желудочка;
прогрессирование атеросклероза в нативных коронарных артериях, сопровождающееся ухудшением клинического состояния;
поражение аутовенозных шунтов позднее чем через 3года после операции КШ.
Рецидивирование ишемии миокарда через 1—12мс после операции КШ. Причина — стенозирование шунта в области анастомоза. Эффективность баллонной ангиопластики стенозов дистального анастомоза как аутовенозных, так и артериальных шунтов в ближайшем и отдалённом периоде после операции выше, чем при стенозировании проксимального анастомоза или средней части шунта. Риск рестеноза ниже при проведении баллонной ангиопластики в течение первых 6мс после операции АКШ по сравнению с более поздними сроками. Ближайшие и отдалённые результаты эндоваскулярного лечения аутовенозных шунтов значительно улучшаются при применении стентов. Рестенозы артериальных шунтов с использованием маммарной, лучевой и желудочно-сальниковой артерии развиваются редко и хорошо поддаются эндоваскулярному лечению баллонной ангиопластикой и стентированию.
Рецидивирование ишемии миокарда позже чем через 12мс после операции КШ. Ишемия миокарда позже чем через 1год после операции возникает вследствие возникновения новых стенозов в нативных коронарных артериях или шунтах. В аутовенозных шунтах, установленных более 3лет назад, атеросклероз наблюдают значительно чаще, бляшки рыхлые и хрупкие, часто содержат значительное количество тромботических масс. При ангиографии диффузно поражённых аутовенозных шунтов кровоток часто замедлен, визуализируются протяжённые поражения с неровными изъязвлёнными контурами, обширными дефектами контрастирования, свидетельствующие о пристеночном тромбозе. Эндоваскулярное лечение при таких поражениях часто осложнено дистальной эмболизацией тромботическими массами, замедлением кровотока и периоперационным инфарком миокарда. При замедлении кровотока во время процедуры введение внутри шунта антагонистов кальция (верапамила или дилтиазема) в ряде случаев может привести к его нормализации.
Эндоваскулярное лечение окклюзии хронических аутовенозных шунтов — отдельная проблема. Проведение баллонной ангиопластики сопряжено с высоким риском осложнений и большой частотой реокклюзии.
Отдалённые результаты эндоваскулярного лечения после КШ зависят от возраста больного, сократительной функции левого желудочка, количества поражённых коронарных артерий. Наиболее хорошие отдалённые результаты наблюдаются при проведении процедуры на дистальных анастомозах венозных и маммарных шунтов в первый год после операции. Выживаемость без неблагоприятных клинических исходов хуже при полной окклюзии венозных шунтов, поражениях устьев венозных шунтов и при их диффузном и мультифокальном поражении.
ОСЛОЖНЕНИЯ ПРИ ПРОВЕДЕНИИ ЭНДОВАСКУЛЯРНЫХ ОПЕРАЦИЙ
После эндоваскулярного лечения коронарных артерий с установкой стентов как в ранний, так в отдалённый периоды, могут возникать осложнения, связанные с нарушением кровотока в оперированном сегменте артерии.
Острая (1—24ч) и подострая окклюзии стента (1—10дней) развиваются в результате тромбоза и клинически проявляются как острый коронарный синдром. В таких ситуациях нужна экстренная КАГ. Частота острой окклюзии стента 2—11%.
Частота подострого тромбоза стента при экстренных ангиопластиках по сравнению с плановыми значительно выше — до 10%. При современных методах стентирования и назначении антиагрегационной и антикоагулянтной терапии частота подострого тромбоза составляет не более 1%.
Рестеноз после баллонной ангиопластики остаётся существенной причиной для возвращения стенокардии. Необходимо различать клинический и ангиографический рестеноз. Клинический рестеноз подозревают при возобновлении стенокардии не позднее чем через 9мес после эндоваскулярной операции. Ангиографически выявленный рестеноз (50% и более) не всегда проявляется клинически, и частота его появления выше, чем клинического. Развитие симптомов стенокардии позднее чем через 9мес после баллонной ангиопластики чаще связано с прогрессированием атеросклероза коронарных артерий, нежели с рестенозом.
После широкого распространения стентов с лекарственным покрытием частота развития рестеноза значительно снизилась (до 1-4%).
Таким образом, при появлении признаков стенокардии и/или объективных симптомов ишемии миокарда следует направить больного на контрольную КАГ для решения вопроса о повторной реваскуляризации, которую можно выполнять сразу после получения результатов ангиографии.
ОБЩИЕ ПРОТИВОПОКАЗАНИЯ К ПРОВЕДЕНИЮ ЧРЕСКОЖНЫХ ЭНДОВАСКУЛЯРНЫХ ОПЕРАЦИЙ
Наличие выраженных нарушений (врождённого или приобретённого характера) в системе гемостаза, которые резко увеличивают риск геморрагических осложнений или тромботической окклюзии дилатированного участка коронарной артерии.
Многососудистое поражение коронарного русла с обширными участками дисфункции миокарда, когда окклюзия коронарной артерии вследствие баллонной ангиопластики может привести к развитию кардиогенного шока.
Гемодинамически значимый стеноз проксимального отдела ствола левой коронарной артерии при отсутствии хотя бы одного проходимого венозного или артериального шунта к передней нисходящей или огибающей артерии.
Расположение стеноза в невовлеченной артерии у больных с острым инфарктом миокарда и многососудистым поражением коронарных артерий.
Отсутствие хирургической поддержки.
ОБСЛЕДОВАНИЕ БОЛЬНОГО ПЕРЕД ЭНДОВАСКУЛЯРНОЙ ОПЕРАЦИЕЙ
Требования к лабораторному и инструментальному обследованию те же, что и перед коронарной ангиографией, однако при указании в анамнезе на эрозивные поражения или язвенную болезнь желудка и двенадцатиперстной кишки рекомендуют обследовать больного с использованием эндоскопических методов, чтобы исключить обострения. Если, по данным ЭГДС, у больного эрозии или язва в острой и подострой стадии, нужна специальная терапия. После контрольного эндоскопического исследования, при условии эпителизации повреждённой слизистой, больной снова начинает приём клопидогрела одновременно с блокаторами Н2-гистаминовых рецепторов. Через 5дней больного можно направить на операцию.
При язвенной болезни целесообразно выполнять эндоваскулярные вмешательства с дополнительным интраоперационным внутривенным введением блокаторов гистаминовых Н2-рецепторов.
ПОДГОТОВКА БОЛЬНОГО К ЭНДОВАСКУЛЯРНОЙ ПРОЦЕДУРЕ
Всем больным за день до процедуры назначают ацетилсалициловую кислоту в дозе 100мг, за 5дней перед плановым стентированием назначают клопидогрел в дозе 75мг/сут.
В день проведения ангиопластики показано также внутривенное введение ингибиторов тромбоцитарных рецепторов IIb/IIIа у больных с острым коронарным синдромом, при сложных коронарных поражениях и после применения процедур атерэктомии. Препарат назначают по схеме: первая доза непосредственно во время эндоваскулярной операции в/в струйно по 0,25мг/кг, затем в течение 18ч в/в капельно по 0,125мкг/кг/мин.
После процедуры продолжают постоянный приём ацетилсалициловой кислоты 100мг в день и клопидогрела 75мг 1р в день (при применении сиролимус-покрытых стентов в течение 12мес, при применении непокрытых стентов в течение 3-6мес).
ВЕДЕНИЕ ПОСЛЕ ЭНДОВАСКУЛЯРНОЙ ПРОЦЕДУРЫ
Стационарный этап
Всех больных после эндоваскулярной процедуры переводят в палату интенсивного наблюдения для контроля за гемодинамикой, ЭКГ, АД, состоянием повязки и места пункции, пульсацией периферических артерий, температурой тела. Выполняют контрольные лабораторные анализы: оценивают уровень кардиоспецифических ферментов, креатинина, мочевины, эритроциты, гемоглобин, гематокрит, лейкоциты, тромбоциты, электролиты, общий анализ мочи.
В ряде случаев больным назначают в послеоперационном периоде низкомолекулярный гепарин в профилактических дозах подкожно в течение 5— 10дней. В этих ситуациях нужен контроль уровня тромбоцитов (3-5-8-й день).
Постельный режим рекомендован в течение суток, повязку снимают через 1—2сут. Нужно следить за местом пункции артерии: при появлении болевых ощущений, признаков подкожной гематомы и систолического шума над местом пункции рекомендовано ультразвуковое дуплексное сканирование, чтобы исключить пульсирующую гематому. Если данное осложнение всё же возникло, необходимо отменить низкомолекулярный гепарин, в неотложном порядке под контролем ультразвука выполнить мануальный гемостаз до полного закрытия соустья ложной аневризмы с последующим наложением давящей повязки на 24ч и дальнейшим УЗИ-контролем. Консервативное ведение в таких ситуациях можно продолжать 7дней, в дальнейшем нужна помощь сосудистых хирургов.
Желательно оставить пациента в стационаре на 7дней после операции, так как в этот период сохраняется риск подострого тромбоза стента и в случае осложнения как можно быстрее необходима повторная эндоваскулярная реваскуляризация.
Амбулаторный этап
При благоприятном течении к концу 2-й недели после операции больной может восстановить физическую активность в полном объёме. Наблюдение за пациентом на поликлиническом этапе предполагает контроль ЭКГ, суточное мониторирование ЭКГ, биохимический анализ крови, эхоКГ, при необходимости пробу с физической нагрузкой (не ранее чем через 2мс).
При отсутствии рецидивов заболевания после успешного эндоваскулярного вмешательства неинвазивное обследование выполняют через 6мс. Особенно внимательно следует относиться к пациентам с тяжёлыми проявлениями ИБС (сниженная фракция выброса ЛЖ, множественное поражение коронарных артерий, сахарный диабет и т.д.). Контрольную коронарографию проводят при появлении объективных признаков ишемии миокарда или при наличии факторов риска неблагоприятного исхода болезни.
ПРИЛОЖЕНИЕ К РАЗДЕЛУ «ЭНДОВАСКУЛЯРНЫЕ ОПЕРАЦИИ НА КОРОНАРНЫХ АРТЕРИЯХ»
Информированное согласие на проведение эндоваскулярной реваскуляризации и стентирования коронарных артерии
Процедура коронарного стентирования — эндоваскулярный хирургический метод лечения ишемической болезни сердца. Коронарный стент (протез) — сложное высокотехнологичное устройство, представляющее собой специально сплетённую из медицинской стали сетку цилиндрической формы. После доставки к месту сужения коронарной артерии посредством специальной системы стент расправляется в соответствии с размерами артерии. Результат стентирования состоит в механической поддержке сосудистой стенки расправленным стентом и сохранении, таким образом, широкого просвета артерии (согласно диаметру стента). Установку стента проводят после проведения баллонной ангиопластики, что позволяет закрепить эффект последней, а также предупредить осложнения в случае значительной микрохирургической травмы стенки коронарной артерии. Кроме того, коронарное стентирование значительно уменьшает риск повторного сужения просвета сосуда по сравнению с баллонной ангиопластикой, особенно при использовании новых моделей стентов со специальным лекарственным покрытием.
Коронарное стентирование сопровождают примерно такие же субъективные ощущения, как и коронарографию.
Возможные осложнения коронарного стентирования: инфаркт миокарда развивается у 0,5-1,5% больных, подострый тромбоз стента у 0,2%, смертность составляет примерно 0,5%, кровотечение в месте пункции 0,5-1%. Ввиду возникновения осложнений примерно у 1% больных становится необходимой операция экстренного коронарного шунтирования.
С целью повысить эффективность операции и предупредить осложнения оперирующий врач может в ходе операции менять её объём и последовательность, количество и характер одноразовых инструментов и тип имплантируемого стента, о чём делают соответствующую запись в операционном журнале, в истории болезни и выписке из истории болезни.
Для уменьшения риска осложнений до, во время и после процедуры коронарного стентирования Вам будут назначать специальные препараты: эноксапарин натрия, гепарин, ацетилсалициловую кислоту, клопидогрел и другие. Применять препараты необходимо строго в соответствии с рекомендациями. В случае прекращения приёма препаратов без согласования с врачом в отдалённом периоде возможно развитие тромботической окклюзии (закрытие) стента.
Примерно в 20% случаев в течение 6мес после проведения баллонной ангиопластики со стентированием может снова возникнуть сужение коронарной артерии в оперированном сегменте (рестеноз). Рестеноз можно устранить повторной баллонной ангиопластикой.
При установке стентов, покрытых лекарственными препаратами, риск рестеноза стента не превышает 5%.
Своей подписью Вы удостоверяете, что с техникой проведения процедуры, возможными осложнениями и способами их лечения ознакомлены, на проведение процедуры согласны.
Ф.И.О. ПОДПИСЬ БОЛЬНОГО ДАТА
Ф.И.О. ПОДПИСЬ ВРАЧА ДАТА
КОРОНАРНОЕ ШУНТИРОВАНИЕ
Коронарное шунтирование КШ — операция по созданию с помощью шунтов обходного пути для тока крови к дистальным отделам стенозированных эпикардиальных коронарных артерий. В большинстве случаев наложение шунтов происходит в условиях остановки сердца и искусственного кровообращения. В качестве шунтов используют венозные и артериальные аутотрансплантаты.
Существует несколько вариантов операции КШ.
За исключением стандартного КШ, для каждого варианта операции есть собственные специфические показания.
СТАНДАРТНОЕ КОРОНАРНОЕ ШУНТИРОВАНИЕ
Выполняют из срединной стернотомии с использованием искусственного кровообращения ИК, на остановленном сердце. В качестве шунтов к стенозированным коронарным артериями используют большую подкожную вену, внутренние грудные артерии (одну или обе), радиальную артерию, желудочно-сальниковую артерию. К преимуществам данной методики относят:
прецизионность выполнения анастомозов;
возможность полной реваскуляризации всех поражённых коронарных артерий;
«комфортность» для хирурга.
Недостатки методики — возможное неблагоприятное воздействие ИК на функцию ЦНС, печени, почек, лёгких.
КОРОНАРНОЕ ШУНТИРОВАНИЕ БЕЗ ИСПОЛЬЗОВАНИЯ ИСКУССТВЕННОГО КРОВООБРАЩЕНИЯ
Выполняют из срединной стернотомии или переднебоковой торакотомии на работающем сердце. Временная стабилизация участка миокарда с шунтируемой коронарной артерией обеспечивается специальным устройством — стабилизатором миокарда. Преимущества методики:
возможность реваскуляризации нескольких артерий (до 5);
отсутствие негативных последствий ИК;
меньшее повреждение миокарда, меньшая потребность в препаратах крови;
меньшая продолжительность лечения и срок пребывания в палате интенсивной терапии;
смертность и частота инсультов после операции без ИК несколько меньше, чем при классическом КШС.
Недостатки методики:
методика технически сложнее, чем стандартное КШ;
эндартерэктомия из коронарных артерий невозможна;
шунтирование при ожирении сердца или внутримиокардиальном ходе артерии невозможно;
шунтирование вторичных ветвей невозможно.
Особые показания:
возраст старше 75лет;
выраженная патология головного мозга, лёгких, почек;
выраженное атеросклеротическое поражение восходящей аорты;
систолическая дисфункция левого желудочка.
МИНИМАЛЬНО-ИНВАЗИВНОЕ КОРОНАРНОЕ ШУНТИРОВАНИЕ
Выполняют, как правило, из левосторонней переднебоковой торакотомии без использования ИК на работающем сердце. Торакотомию длиной около 10-15см выполняют в четвёртом, реже в пятом или третьем межреберьях. Выделяют левую внутреннюю грудную артерию (ЛВГА) под прямым контролем зрения или с помощью торакоскопической техники. С использованием стабилизаторов миокарда накладывают анастомоз между ЛВГА и передней нисходящей ветвью левой коронарной артерии конец в бок. Преимущества методики:
отсутствие рисков ИК;
меньшее повреждение миокарда;
минимальные гемотрансфузии;
меньшая продолжительность лечения и срок пребывания в палате интенсивной терапии;
лучшие отдалённые результаты в сравнении с ангиопластикой.
Недостатки методики:
проводить множественную реваскуляризацию из-за недоступности бассейнов правой коронарной и огибающей артерии невозможно;
длительная болезненность в области операции.
Особые показания:
значимое поражение передней нисходящей артерии и высокий риск эндоваскулярного лечения.
КОРОНАРНОЕ ШУНТИРОВАНИЕ «ОКОННЫМ» ДОСТУПОМ
Проводят через несколько небольших разрезов под эндоскопическим контролем, с искусственным кровообращением через бедренные сосуды и в условиях кардиоплегии. Для доставки кардиоплегических растворов, окклюзии аорты и декомпрессии левого желудочка используют систему катетеров.
Преимущества методики:
возможности полной реваскуляризации;
выполнение анастомозов на неподвижном сердце;
отказ от выполнения срединной стернотомии;
уменьшение травматичности вмешательства;
сокращение восстановительного периода.
Недостатки методики:
необходима периферическая канюляция через дополнительные разрезы на бедре, что приводит к соответствующим осложнениям;
удлинение времени операции, ИК и ишемии миокарда по сравнению с другими вариантами коронарного шунтирования;
высокая стоимость процедуры;
высокая частота рестенозов и рецидивов стенокардии.
Безопасность и эффективность данной методики, а также отдалённые результаты изучены недостаточно.
КОРОНАРНАЯ ЭНДАРТЕРЭКТОМИЯ С ПОСЛЕДУЮЩИМ КШ
Удаление всей атеросклеротически изменённой интимы сосуда с его последующим шунтированием как в условиях ИК, так и на работающем сердце.
Преимущества данной методики — высокая проходимость шунтов к эндартерэктомированным артериям. К недостаткам данной методики относят повышение риска послеоперационного инфаркта миокарда и летальности примерно в 2р.
Специфические показания: выраженное поражение коронарного русла и невозможность выполнения анастомоза с артерией.
Осложнения коронарного шунтирования
Операционная летальность при плановом КШ не превышает 2—3%. Риск летального исхода и эффективность операции увеличивают следующие факторы:
пожилой и старческий возраст;
число поражённых коронарных артерий;
женский пол;
тяжесть стенокардии;
курение;
сопутствующее поражение других сосудистых бассейнов;
сахарный диабет;
ожирение;
дисфункция левого желудочка;
почечная недостаточность;
цереброваскулярная болезнь или поражение периферических сосудов;
недавний инфаркт миокарда или нестабильная стенокардия;
артериальная гипертензия;
хроническая обструктивная болезнь лёгких.
На постгоспитальную смертность также влияет ряд факторов.
Возраст — важный предиктор госпитальной смертности после КШ. Риск смерти в возрасте 75лет в 2р выше, а в возрасте 80лет в 5р выше, чем у пациентов 50лет.
У женщин летальность в 1,5р выше, чем у мужчин.
У курильщиков долгосрочная выживаемость после КШ ниже, чем у некурящих. Отказ от курения обеспечивает снижение риска инфаркта миокарда и повторной реваскуляризации в течение 10л на 50%.
У пациентов с систолической дисфункцией левого желудочка эффект от КШ выше. Через 10л после КШ выживаемость пациентов с систолической дисфункцией левого желудочка в 5р выше, чем пациентов с исходно нормальной функцией левого желудочка.
Для оценки риска смерти во время операции у пациентов со стабильной стенокардией используйте шкалу риска EuroSCORE (табл. 85).
 Таблица
85. Шкала расчета риска смерти при КШ пациентов со стабильной стенокардией
Таблица
85. Шкала расчета риска смерти при КШ пациентов со стабильной стенокардией

ДИСФУНКЦИЯ ШУНТОВ
Атеросклеротическое повреждение венозных кондуитов становится значимым уже через 5лет.
Артериальные кондуиты (внутренняя грудная, радиальная, желудочно-сальниковая артерии) обеспечивают больший срок службы шунтов.
Через 10лет остаются проходимыми 83% артериальных кондуитов и только 41% венозных.
10-летняя смертность после КШ у пациентов с венозными кондуитами выше в 1,6р, чем у пациентов с артериальными кондуитами.
ПОКАЗАНИЯ К ПРОВЕДЕНИЮ КШ
Показания к проведению КШ основаны на комплексной оценке состояния пациента, включающей клиническую картину болезни, данные неинвазивного тестирования, коронарной ангиографии и исследования функции левого желудочка.
Пациенты без симптомов или со стенокардией напряжения I ФК
Выраженный стеноз ствола левой коронарной артерии.
Эквивалент стеноза ствола левой коронарной артерии: стеноз >70% проксимального отдела передней межжелудочковой ветви левой коронарной артерии или проксимального отдела огибающей артерии.
Трёхсосудистое поражение коронарного русла (большее возрастание выживаемости отмечают у больных с дисфункцией левого желудочка фракция выброса <50%).
Стеноз проксимального отдела передней межжелудочковой ветви левой коронарной артерии при одно- или двухсосудистом поражении коронарного русла в сочетании с выраженной ишемией по данным неинвазивного тестирования или в сочетании со снижением фракции выброса левого желудочка <50%.
Одно- или двухсосудистое поражение коронарного русла без вовлечения проксимального отдела передней межжелудочковой ветви левой коронарной артерии в сочетании с обширной зоной жизнеспособного («спящего») миокарда или в сочетании с критериями высокого риска по данным неинвазивного тестирования.
Стабильная стенокардия напряжения II—IV ФК
Выраженный стеноз ствола левой коронарной артерии.
Эквивалент стеноза ствола левой коронарной артерии: стеноз >70% проксимального отдела передней межжелудочковой ветви левой коронарной артерии или проксимального отдела огибающей артерии.
Трёхсосудистое поражение коронарного русла (большее возрастание выживаемости отмечают у больных с дисфункцией левого желудочка фракция выброса <50%).
Стеноз проксимального отдела передней межжелудочковой ветви левой коронарной артерии при одно- или двухсосудистом поражении коронарного русла в сочетании с выраженной ишемией по данным неинвазивного тестирования или в сочетании со снижением фракции выброса левого желудочка <50%.
Одно- или двухсосудистое поражение коронарного русла без вовлечения проксимального отдела передней межжелудочковой ветви левой коронарной артерии в сочетании с обширной зоной жизнеспособного («спящего») миокарда или в сочетании с критериями высокого риска по данным неинвазивного тестирования.
Выраженное нарушение качества жизни из-за стенокардии, не поддающейся медикаментозному лечению в максимальных дозах. Если стенокардия нетипична, необходимо объективное подтверждение наличия ишемии.
Проксимальный стеноз передней межжелудочковой ветви левой коронарной артерии при однососудистом поражении коронарного русла в сочетании с выраженной ишемией при неинвазивном тестировании или в сочетании со снижением фракции выброса левого желудочка <50%.
Одно- или двухсосудистое поражение коронарного русла без вовлечения проксимального отдела передней межжелудочковой ветви левой коронарной артерии в сочетании со значительной зоной жизнеспособного («спящего») миокарда и наличием ишемии по данным неинвазивного тестирования.
Нестабильная стенокардия/инфаркт миокарда без подъёма сегмента ST.
Выраженный стеноз ствола левой коронарной артерии.
Эквивалент стеноза ствола левой коронарной артерии: стеноз >70% проксимального отдела передней межжелудочковой ветви левой коронарной артерии или проксимального отдела огибающей артерии.
Невозможность проведения чрескожного эндоваскулярного вмешательства и наличие ишемии, не поддающейся медикаментозному лечению в максимальных дозах.
Стеноз проксимального отдела передней межжелудочковой ветви левой коронарной артерии при одно- или двухсосудистом поражении коронарного русла.
Инфаркт миокарда с подъёмом сегмента ST
Неотложное (ургентное) КШ следует проводить в ряде случаев.
Сохранение боли или гемодинамическая нестабильность после неудачной ангиопластики, если коронарная анатомия позволяет выполнить КШ.
Персистирующая или возобновляющаяся ишемия, рефрактерная к медикаментозной терапии, у пациентов с коронарной анатомией, позволяющей выполнить КШ, имеющих значительный объём миокарда в зоне риска и не являющихся кандидатами на чрескожное эндоваскулярное вмешательство.
Во время хирургического вмешательства по поводу постинфарктного разрыва межжелудочковой перегородки или недостаточности митрального клапана.
Жизнеугрожающие желудочковые нарушения ритма сердца при наличии 50% и более стеноза ствола левой коронарной артерии и/или трёхсосудистом поражении коронарного русла.
В качестве первичной реперфузии в первые 6-12ч после инфаркта миокарда у пациентов с подходящей коронарной анатомией, которых нельзя подвергнуть тромболизису/ТБКА или при неудаче последних.
У пациентов с ИМ с подъёмом сегмента ST или ИМ без подъёма сегмента ST операционная летальность в течение первых 3—7дней инфаркта повышена. Преимущества реваскуляризации следует оценивать с учётом этого повышения риска. Через 7дней применимы критерии, описанные в предыдущих разделах.
Дисфункция левого желудочка
Сниженная систолическая функция левого желудочка при выраженном стенозе ствола левой коронарной артерии.
Сниженная систолическая функция левого желудочка при наличии эквивалента стеноза ствола левой коронарной артерии: стеноз >70% проксимального отдела передней межжелудочковой ветви левой коронарной артерии или проксимального отдела огибающей артерии.
Сниженная систолическая функция левого желудочка при наличии стеноза проксимального отдела передней межжелудочковой ветви левой коронарной артерии в сочетании с двух- или трехсосудистым поражением коронарного русла.
Сниженная систолическая функция левого желудочка при наличии значительного количества жизнеспособного («спящего») миокарда в зоне предполагаемой реваскуляризации даже при отсутствии описанных выше типов поражений коронарных артерий.
Жизнеугрожающие желудочковые аритмии
Стеноз ствола левой коронарной артерии.
Трёхсосудистое поражение коронарного русла.
Одно- или двухсосудистое поражение коронарного русла, вызывающее жизнеугрожающие желудочковые аритмии (особенно если это устойчивая желудочковая тахикардия или аритмия, вызвавшая внезапную сердечную смерть с последующей успешной реанимацией).
Проксимальный стеноз передней нисходящей ветви левой коронарной артерии в сочетании с одно- или двухсосудистым поражением коронарного русла (особенно если аритмия вызвала внезапную сердечную смерть с последующей успешной реанимацией)
Коронарное шунтирование после неудачной чрескожной коронарной ангиопластики
Сохраняющаяся ишемия или окклюзия при наличии значительного количества миокарда в зоне риска.
Нестабильность гемодинамики.
Инородное тело (стент) в опасной анатомической позиции.
Нестабильность гемодинамики у пациентов с нарушениями гемокоагуляции без предшествующей стернотомии.
Перенесённое ранее коронарное шунтирование
Выраженное нарушение качества жизни из-за стенокардии, не поддающейся медикаментозному лечению в максимальных дозах. Если стенокардия нетипична, необходимо объективное подтверждение наличия ишемии.
Непроходимость шунтов при наличии показаний к КШ для пациентов с нативными коронарными артериями (выраженный стеноз ствола левой коронарной артерии, эквивалент стеноза ствола левой коронарной артерии, трехсосудистое поражение коронарного русла).
Подходящие для шунтирования дистальные отделы коронарного русла при большом объёме ишемизированного миокарда по данным неинвазивного тестирования.
Атеросклероз венозных шунтов, если шунты со стенозами более 50% снабжают левую коронарную артерию или большие участки миокарда.
ПРОТИВОПОКАЗАНИЯ К КОРОНАРНОМУ ШУНТИРОВАНИЮ
Стабильная стенокардия напряжения
Пациенты с одно- или двухсосудистым поражением коронарного русла без значимого стеноза проксимального отдела передней нисходящей ветви левой коронарной артерии, или кардиалгией, не связанной с ишемией миокарда, или пациенты, не получавшие адекватной медикаментозной терапии с незначительной зоной ишемии или отсутствием ишемии по данным неинвазивного тестирования.
Стенозы 50-60% (за исключением ствола левой коронарной артерии) и отсутствие ишемии по данным неинвазивного тестирования.
Незначимые стенозы (<50%) коронарных артерий.
Инфаркт миокарда с подъёмом сегмента ST
Экстренное КШ не следует выполнять гемодинамически стабильным пациентам с персистирующей стенокардией и небольшим количеством миокарда в зоне риска.
Экстренное КШ не следует выполнять пациентам с успешной реперфузией в эпикардиальных артериях и отсутствием реперфузии в микроциркуляторном русле.
Дисфункция левого желудочка
Отсутствие ишемии и значительного количества жизнеспособного («спящего») миокарда, который может быть реваскуляризирован.
Жизнеугрожающие нарушения сердечного ритма
Желудочковая тахикардия при наличии рубца и отсутствии признаков ишемии.
ТАКТИКА ВРАЧА НА АМБУЛАТОРНОМ ЭТАПЕ
Ацетилсалициловая кислота в дозе 75-325мг/сут всем больным после КШ для пожизненного приема.
Статины всем больным после КШ при отсутствии у них противопоказаний.
Следует добиться полного отказа пациента от курения с помощью консультаций и назначения терапии.
Никотинзаместительная терапия пациентам с высокой мотивацией к отказу от курения.
Пациентам старше 50лет с факторами риска ИБС необходимо проходить амбулаторное обследование не реже 1р в год.
ПРЕДОПЕРАЦИОННОЕ ОБСЛЕДОВАНИЕ И ПОДГОТОВКА К НЕКАРДИОЛОГИЧЕСКИМ ОПЕРАЦИЯМ ПАЦИЕНТОВ С СЕРДЕЧНО-СОСУДИСТЫМИ ЗАБОЛЕВАНИЯМИ
Ежегодно в мире около 100 млн взрослого населения подвергают различным хирургическим операциям, при этом у 500 000-900 000 человек в периоперационном периоде развиваются сердечно-сосудистые осложнения.
Цель предоперационного обследования состоит в определении риска при проведении предполагаемого оперативного пособия и минимизации имеющихся факторов риска.
Выявление ранее не известных сопутствующих заболеваний и факторов риска развития осложнений при проведении планируемого оперативного пособия.
Оптимизация предоперационного ведения пациента.
Профилактика потенциальных осложнений.
Анестезиологическое пособие
Источники анестезиологического риска
Стрессовая реакция на введение анестетика или на вмешательство (например, ишемия миокарда).
Побочные эффекты средств для анестезии (например, злокачественная гипотермия или индуцированный галотаном гепатит).
Технические ошибки при оказании анестезиологического пособия (например, интубация пищевода).
КАРДИАЛЫНЫЕ ЭФФЕКТЫ АНЕСТЕЗИИ
Общая анестезия
Ингаляционные средства для анестезии снижают системное АД на 20-30%, интубация трахеи сопровождается увеличением АД на 20-30мм рт.ст. Ингаляционные агенты угнетают сократительную способность миокарда и приводят к зависимости от преднагрузки. Вследствие этого у пациентов с дефицитом ОЦК, избыточным диурезом, сниженной сократительной способностью миокарда или автономной нейропатией при введении ингаляционных средств для наркоза возможно развитие избыточной гипотонической реакции. Кроме того, при применении ингаляционных агентов увеличивается чувствительность миокарда к эффектам катехоламинов.
У пациентов с высоким риском сердечно-сосудистых осложнений следует избегать применения оксида азота в качестве анестетика.
Региональная анестезия
Спинномозговая анестезия сопровождается дилатацией артерий и вен, уменьшением преднагрузки и снижением сердечного выброса.
Спинномозговая анестезия в целом не имеет преимуществ перед общим наркозом в отношении частоты развития кардиальных осложнений, однако пациентам с высоким риском развития сердечно-сосудистых осложнений рекомендовано проведение региональной (спинальной или эпидуральной) анестезии.
ОПРЕДЕЛЕНИЕ АНЕСТЕЗИОЛОГИЧЕСКОГО РИСКА
Анестезиологический риск определяют в соответствии с классификацией Американского общества анестезиологов (ASA, табл. 86).
Таблица 86. Классификация анестезиологического риска

В клинической практике наиболее часто оперативное лечение проводят пациентам со 2-м и 3-м классами анестезиологического риска. Клинические корреляты анестезиологического риска у пациентов с сердечно-сосудистыми заболеваниями представлены в табл. 87.
Таблица 87. Взаимосвязь анестезиологического риска с клиническими параметрами у пациентов с сердечно-сосудистыми заболеваниями

ОПРЕДЕЛЕНИЕ РИСКА, СВЯЗАННОГО С ПРОВЕДЕНИЕМ ХИРУРГИЧЕСКОГО ВМЕШАТЕЛЬСТВА
Само по себе оперативное лечение, независимо от состояния пациента, также сопровождается определенным риском сердечно-сосудистых осложнений (табл. 88)
Таблица 88. Риск осложнений в зависимости от вида оперативного вмешательства

В соответствии с риском развития сердечно-сосудистых осложнений выделяют несколько категорий операций.
Операции 1-й категории риска (низкий риск)
Минимальный риск независимо от вида анестезии.
Минимально инвазивные процедуры с отсутствием или небольшой кровопотерей.
Возможно выполнение в амбулаторных условиях.
Биопсия молочной железы.
Фибробронхоскопия.
Операции на коже и подкожной клетчатке.
Миринготомия.
Гистероскопия.
Цистоскопия.
Вазэктомия.
Циркумцизия.
Операции 2-й категории риска (промежуточный риск)
Минимально и умеренно инвазивные вмешательства.
Объём кровопотери менее 500мл.
Низкий риск, связанный с вмешательством, независимо от анестезии.
Диагностическая лапароскопия.
Дилатация и кюретаж.
Лигирование фаллопиевых труб.
Артроскопия.
Пластика паховой грыжи.
Лапароскопическое рассечение спаек.
Тонзиллэктомия/Аденотомия.
Пластика пупочной грыжи.
Септопластика/Ринопластика.
Чрескожная биопсия лёгких.
Лапароскопическая холецистэктомия.
Поверхностные операции большого объёма.
Операции 3-й категории риска (высокий риск)
Умеренные и значительные инвазивные вмешательства.
Объём кровопотери от 500 до 1500мл.
Умеренный риск, связанный с вмешательством, независимо от анестезии.
Тиреоидэктомия.
Гистерэктомия.
Миомэктомия.
Цистэктомия.
Холецистэктомия.
Резекция или реконструктивные операции на ЖКТ.
Ламинэктомия.
Протезирование тазобедренного/коленного сустава.
Нефрэктомия.
Большие лапароскопические процедуры.
Операции 4-й категории риска (очень высокий риск)
Высокоинвазивные вмешательства.
Объём кровопотери превышает 1500мл.
Высокий, риск, связанный с вмешательством, независимо от анестезии.
Большие ортопедические реконструктивные операции.
Большие реконструктивные операции на ЖКТ.
Большие операции на мочеполовых органах.
Операции на крупных сосудах.
Операции 5-й категории риска (кардиоторакальные и нейрохирургические операции)
ОПРЕДЕЛЕНИЕ СЕРДЕЧНО-СОСУДИСТОГО РИСКА
Для определения сердечно-сосудистого риска в периоперационном периоде широко используют индексы, основанные на клинической оценке состояния пациентов.
I этап определения исходного профиля риска представлен в табл. 89.
 Таблица
89. Определение исходного профиля кардиального риска (индекс Lee)
Таблица
89. Определение исходного профиля кардиального риска (индекс Lee)

Оценку риска осуществляют путём подсчёта баллов, при этом каждому из перечисленных выше факторов присваивается 1 балл. II этап. Стратификация пациентов по степени риска
0—1 баллов (низкий риск): необходимости в дальнейшем обследовании нет. Пациенту возможно проведение оперативного лечения.
2 балла (промежуточный риск): в большинстве случаев необходимости в дальнейших исследованиях нет и пациенту может быть произведена операция. При планирующейся операции на крупных сосудах пациенту показано проведение нагрузочного теста (предпочтительнее перфузионной сцинтиграфии миокарда или стресс-эхокардиографии с добутамином). При положительном результате пробы дальнейшая тактика такая же, как у пациентов с высоким риском.
3-6 баллов (высокий риск): необходимо дальнейшее обследование и коррекция факторов риска.
ПРЕДОПЕРАЦИОННОЕ ОБСЛЕДОВАНИЕ ПАЦИЕНТОВ С СЕРДЕЧНО-СОСУДИСТЫМИ ЗАБОЛЕВАНИЯМИ
ЖАЛОБЫ И АНАМНЕЗ
При сборе жалоб и анамнеза особое внимание следует уделять выявлению стенокардии, анамнестических указаний на перенесённый инфаркт миокарда, клинических проявлений ХСН и нарушений сердечного ритма, а также клинически выраженного атеросклероза периферических артерий, сахарного диабета, нарушений функции почек и хронических заболеваний лёгких. Необходимо уточнить характер и дозу постоянно принимаемых пациентом лекарственных препаратов, в том числе и препаратов для безрецептурного отпуска. Большое значение имеет информация о курении и употреблении алкоголя, а также аллергологический анамнез. Всем курящим пациентам рекомендуют прекратить курение не менее, чем за 3нд до даты операции. На основании расспроса необходимо уточнить функциональный статус пациента. Низким считается функциональный статус, соответствующий менее 4 метаболическим эквивалентам (МЕТ, см. раздел «Функциональные пробы с дозированной физической нагрузкой»). Уровень активности, соответствующий 4 МЕТ, эквивалентен ходьбе в ускоренном темпе (6км/ч) или подъёму на один пролёт лестницы.
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
Пациенту необходимо провести полноценное физикальное исследование сердечно-сосудистой системы, включающее определение чсс и АД на обеих руках в клиностазе и ортостазе, пальпацию и аускультацию сонных артерий, визуальный анализ и неинвазивное определение давления в ярёмных венах при их набухании, аускультацию лёгких, пальпацию и аускультацию прекардиальной области, пальпацию живота и исследование нижних конечностей (отёки, пульсация периферических артерий, состояние вен).
ЛАБОРАТОРНО-ИНСТРУМЕНТАЛЬНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Объём лабораторных и инструментальных исследований определяется исходным профилем сердечно-сосудистых факторов риска и объёмом оперативного вмешательства. Необходимый минимум исследований включает полный общий анализ крови (исходный уровень гемоглобина перед оперативным пособием 3-й категории и выше не должен быть ниже 10г/л), определение концентрации глюкозы плазмы крови (пациенты с сахарным диабетом нуждаются в жёстком контроле гликемии), показателей функции почек (почечная недостаточность — независимый фактор риска развития сердечно-сосудистых осложнений в периоперационном периоде), коагулограмму и ЭКГ.
ОБСЛЕДОВАНИЕ БОЛЬНЫХ С ПОВЫШЕННЫМ РИСКОМ РАЗВИТИЯ СЕРДЕЧНО-СОСУДИСТЫХ ОСЛОЖНЕНИЙ
Проведение тестов рекомендуют только в том случае, если от результатов зависит изменение хирургической тактики или плана предоперационной подготовки.
Проведение тестов осуществляют по тем же показаниям, что и в обычном контингенте больных (за исключением пациентов с промежуточными клиническими предикторами риска).
Нагрузочные пробы
Проведение нагрузочных тестов показано пациентам с промежуточным риском, низким функциональным статусом и при планирующихся операциях на крупных сосудах или сопровождающихся большими гемодинамическими сдвигами.
В зависимости от результатов нагрузочного тестирования выделяют три категории пациентов — с высоким, промежуточным и низким риском развития сердечно-сосудистых осложнений в периоперационном периоде.
Высокий риск развития осложнений — ишемия при низкой нагрузке (<4 МЕТ, чсс <100 в минуту или <70% от должной):
депрессия ST >0,1мм;
элевация SТ >0,1мм (в «неинфарктных» отведениях);
изменения в 5 и более отведениях;
длительность ишемии >3мин восстановительного периода;
типичная стенокардия.
Промежуточный риск развития осложнений — ишемия при умеренной нагрузке (4-6 МЕТ, чсс 100-130 в минуту или 70-85% от должной):
депрессия ST >0,1мм;
изменения в 3-4 отведениях;
длительность ишемии 1—3мин восстановительного периода;
типичная стенокардия.
Низкий риск развития осложнений
Отрицательная проба.
Ишемия при высокой нагрузке (>7 МЕТ, чсс > 130 в минуту или >85% от должной):
депрессия SТ >0,1мм;
типичная стенокардия;
изменения в 2 отведениях.
Большинство пациентов, имеющих исходно высокий риск осложнений, не способны достигнуть 85% от должной максимальной чсс, поэтому рутинное проведение нагрузочных проб не рекомендуют. В случаях, когда существует необходимость проведения неинвазивных тестов для определения выраженности ишемии и прогноза, рекомендуют проведение перфузионной сцинтиграфии миокарда или стресс-эхокардиографии с добутамином.
Холтеровское мониторирование ЭКГ
Рутинное применение холтеровского мониторирования ЭКГ для оценки сердечно-сосудистого риска в периоперационном периоде не рекомендуют.
Трансторакальная эхокардиография
Несмотря на то что трансторакальная эхоКГ предоставляет возможность неинвазивной оценки сократительной способности миокарда, её рутинное применение у пациентов для определения сердечно-сосудистого риска в периоперационном периоде не рекомендуют. Единственным исключением могут служить пациенты с пороками сердца или клинически выраженной сердечной недостаточностью.
Коронароангиография
Проведение коронароангиографии в предоперационном периоде показано в том случае, если имеются показания к её проведению независимо от планирующегося оперативного лечения.
ТАКТИКА ВЕДЕНИЯ БОЛЬНЫХ С СЕРДЕЧНО-СОСУДИСТЫМИ ЗАБОЛЕВАНИЯМИ
ИБС
Частота развития периоперационных сердечно-сосудистых осложнений при внесердечных хирургических вмешательствах у больных без ИБС составляет менее 1%.
Всем пациентам с ИБС при отсутствии противопоказаний перед операцией рекомендовано назначение б-адреноблокаторов (табл. 90).
Таблица 90. Показания к назначению б-адреноблокаторов в периоперационном периоде

Все пациенты с повышенным риском осложнений нуждаются в мониторировании ЭКГ в течении 72ч после операции, причём, как правило, изменения на ЭКГ предшествуют клиническому ухудшению. Пациентам с высоким риском следует продолжать приём ацетилсалициловой кислоты вплоть до кануна операции, кроме особых случаев (см. ниже).
Пациентам с высоким риском показано назначение статинов.
Вопрос о проведении коронароангиографии с последующей реваскуляризацией до проведения операции решают индивидуально.
Профилактическая реваскуляризация показана в следующих случаях:
стандартные показания к реваскуляризации миокарда;
риск, связанный с внесердечной операцией >5%;
риск, связанный с реваскуляризацией <3%;
существует возможность отложить проведение внесердечной операции на срок от 6 нед и более.
Артериальная гипертензия
Сама по себе АГ сопровождается низким риском развития сердечно-сосудистых осложнений в периоперационном периоде. Пациенты с тяжёлой АГ (АД более 180 и 110мм рт.ст.) имеют более высокий риск развития ишемических осложнений. Для этой группы больных характерна большая лабильность АД во время операции, чаще наблюдаются аритмии, инфаркт миокарда, почечная недостаточность, недостаточность кровообращения и послеоперационная АГ. Таким пациентам следует отложить операцию до стабилизации АД на более низком уровне. У пациентов пожилого возраста с выраженным поражением сосудистого русла очень важно контролировать АД во время операции и не допускать его снижения более 30% от исходного уровня.
Хроническая сердечная недостаточность
Сердечная недостаточность служит определяющим фактором периоперационного риска вне зависимости от причины её развития. Больные с ХСН нуждаются в тщательной предоперационной подготовке с применением стандартной терапии ХСН. У пациентов с III—IV ФК (NYHA), при возможности, следует отложить плановую операцию и модифицировать лечение с целью улучшения функционального класса ХСН. При наличии сердечной недостаточности и инфаркта миокарда в анамнезе во время операции рекомендуют использование инвазивного мониторирования гемодинамики для поддержания давления заполнения левого желудочка на оптимальном уровне. Однако показано, что катетеризация лёгочной артерии сама по себе способна увеличивать летальность, поэтому катетер в лёгочной артерии необходимо использовать только в ситуациях с высоким риском гемодинамических осложнений.
Нарушения сердечного ритма и проводимости
Бессимптомные предсердные или редкие желудочковые экстрасистолы (1-2-я градация по Лауну и Вольфу) при отсутствии ишемии миокарда и недостаточности левого желудочка не следует рассматривать как фактор риска, поэтому назначение антиаритмических препаратов для их коррекции в периоперационном периоде не требуется. Постоянная форма фибрилляции предсердий не сопровождается значительным увеличением сердечно-сосудистого риска в периоперационном периоде при условии поддержания нормосистолии. Частые (более 5 в мин) желудочковые экстрасистолы служат фактором риска и нуждаются в терапии б-адреноблокаторами или амиодароном. Синусовая брадикардия без клинических проявлений не требует каких-либо вмешательств. Пациентам с синдромом слабости синусового узла (синдром тахикардии-брадикардии) или брадикардией с клиническими проявлениями показана имплантация временного ЭКС. Пациентам с атриовентрикулярной блокадой III степени следует использовать искусственный водитель ритма, даже когда симптомы отсутствуют. У больных с бифасцикулярной блокадой атриовентрикулярная блокада высокой степени развивается редко (если ранее не было эпизодов возникновения полной поперечной блокады), поэтому искусственный водитель ритма следует устанавливать лишь у пациентов с бифасцикулярной блокадой в сочетании с нарушением атриовентрикулярной проводимости до операции или эпизодами потери сознания в анамнезе.
Постоянный искусственный водитель ритма
Наличие постоянного ЭКС не увеличивает риск сердечно-сосудистых осложнений. В то же время электромагнитная интерференция, возникающая при использовании диатермии и электрокоагуляции (а иногда и при простом мониторном наблюдении), может вызвать дисфункцию ЭКС. Таким образом, с целью предотвращения развития осложнений, связанных с дисфункцией ЭКС, рекомендованы:
оценка нормального функционирования ЭКС и состояния батареи;
сведение к минимуму использования электрокоагуляции;
использование биполярной электрокоагуляции;
расположение пластины заземления электрокоагулятора как можно дальше от места имплантации ЭКС;
у пациентов, зависимых от функции ЭКС, при проведении больших операций рекомендовано предоперационное перепрограммирование ЭКС с включением асинхронного или триггерного режима.
Клапанные пороки сердца
Митральная и аортальная недостаточность не сопровождаются значительным увеличением частоты развития осложнений в периоперационном периоде. Прогноз определяется состоянием сократительной функции левого желудочка. Тяжёлый аортальный и митральный стенозы (площадь отверстия клапана менее 1см2) представляют собой мощный фактор риска развития осложнений в периоперационном периоде.
Вопрос о переносе плановой операции и протезировании клапана решается в индивидуальном порядке, так как показания к протезированию клапана не зависят от предполагаемого оперативного лечения.
Пациенты с протезированными клапанами сердца
Если нет дисфункции клапана и признаков сердечной недостаточности, то основная задача подготовки пациента в периоперационном периоде заключается в адекватной антикоагулянтной терапии нефракционированным или низкомолекулярным гепарином после операции и профилактике инфекционного эндокардита.
ПРОФИЛАКТИКА ИНФЕКЦИОННОГО ЭНДОКАРДИТА
Инфекционный эндокардит нативного клапана
Высокий риск инфекционного эндокардита:
эпизоды ИЭ в анамнезе;
имплантированный клапанный протез;
врождённые пороки сердца «синего» типа;
открытый артериальный проток;
пороки митрального и аортального клапанов с регургитацией;
дефект межжелудочковой перегородки;
коарктация аорты;
ятрогенный аортопульмональный шунт;
пороки сердца с оставшимися после хирургической коррекции резидуальными нарушениями.
Умеренный риск развития инфекционного эндокардита:
пролапс митрального клапана с регургитацней;
«чистый» митральный стеноз;
трикуспидальный порок сердца;
пульмональный стеноз;
асимметричная гипертрофия межжелудочковой перегородки;
дегенеративные болезни клапанов в молодом возрасте;
бикуспидальный аортальный клапан или комбинированный аортальный порок с минимальными гемодинамическими нарушениями;
минимальные резидуальные нарушения в первые 6мс после хирургической коррекции порока сердца.
Низкий риск инфекционного эндокардита:
пролапс митрального клапана без регургитации;
пролапс митрального клапана с регургитацией, определяемой только инструментальными методами;
высокие изолированные дефекты межпредсердной перегородки;
ревматическое поражение сердца без клапанной дисфункции;
аортокоронарное шунтирование в анамнезе;
хирургическая коррекция пороков сердца с минимальными резидуальными поражениями (спустя 6мс после операции).
Профилактика ИЭ рекомендована при:
стоматологических вмешательствах, осложнённых кровотечением;
тонзиллэктомии, аденоидэктомии;
хирургическом удалении участка слизистой оболочки желудочно-кишечного или респираторного тракта;
склеротерапии варикозно расширенных вен пищевода и его дилатации;
дилатации мочеточника;
хирургическом лечении патологии мочевыводящих путей (включая простатэктомию);
длительной катетеризации мочевого пузыря, осложнённой инфекцией;
вагинальной гистерэктомии;
инфицированных родах;
рассечении и дренировании инфицированных тканей.
Профилактику ИЭ обычно не проводят у больных с малым и умеренным риском ИЭ после процедур и манипуляций, осложнённых малой и кратковременной бактериемией:
не осложнённых кровотечением стоматологических манипуляций;
инъекции локальных анестетиков;
введения тимпаностомической трубки;
введения эндотрахеальной трубки;
бронхоскопии мягким эндоскопом (с биопсией слизистой или без неё);
пункции мочевого пузыря.
Профилактику ИЭ обычно не рекомендуют больным с любой степенью риска ИЭ после:
неинфицированной катетеризации уретры;
работы кюреткой во влагалище;
неосложнённых родов и абортов, проводимых в лечебно-профилактическом учреждении;
удаления внутриматочных спиралей;
стерилизационных процедур;
лапароскопии;
удаления молочных зубов.
Инфекционный эндокардит протезированного клапана
Высокий риск:
наличие клинико-бактериологической симптоматики интраоперационной бактериемии — с гектической лихорадкой в 1-е сутки после операции, сопровождающейся ознобами и проливными потами, положительной гемокультурой;
операция по поводу активного ревматического вальвулита или инфекционного эндокардита;
длительность искусственного кровообращения свыше 130мин;
концентрация С-реактивного белка в крови свыше 190мг/л.
Умеренный риск:
после имплантации двух клапанов;
при концентрации С-реактивного белка 120—190 мг/л.
Минимальный риск:
после имплантации одного клапана;
отсутствие признаков интраоперационной бактериемии;
концентрация С-реактивного белка менее 120 мг/л.
Оптимальными препаратами для профилактики ИЭ протезированного клапана признаны цефалоспорины IV поколения в течение 7дней.
ПРОФИЛАКТИКА ТРОМБОЭМБОЛИЧЕСКИХ ОСЛОЖНЕНИЙ
Факторы риска тромбоэмболических осложнений:
большие операции на брюшной полости и органах малого таза;
возраст старше 40 лет;
анамнестические указания на эпизоды тромбоэмболии;
врождённые нарушения коагуляции (тромбофилия);
злокачественные новообразования;
морбидное ожирение (ИМТ >40кг/м2);
воспалительные заболевания кишечника;
инсульт (с параличом);
длительная иммобилизация;
гепарин-индуцированная тромбоцитопения;
хроническая сердечная недостаточность;
инфаркт миокарда;
использование пероральных контрацептивов;
приём тамоксифена;
венозный застой.
Таблица 91. Профилактика тромбоэмболических осложнений


ТАКТИКА В ОТНОШЕНИИ ПРИЁМА ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ В ПЕРИОПЕРАЦИОННОМ ПЕРИОДЕ
Около четверти всех пациентов, которым планируется хирургическое вмешательство, находятся на длительном приёме лекарственных препаратов.
Б-адреноблокаторы
Препараты данного класса уменьшают риск сердечно-сосудистых осложнений в послеоперационном периоде, поэтому они должны приниматься пациентом без коррекции дозы вплоть до кануна дня операции. Риск развития синдрома «отмены» в послеоперационном периоде невелик, так как симптомы начинают появляться не ранее, чем через 72ч после последнего приёма препарата, и своевременное возобновление приема б-адреноблокаторов в послеоперационном периоде позволяет избежать развития синдрома «отмены».
Блокаторы кальциевых каналов
Применение блокаторов кальциевых каналов в периоперационном периоде потенциально опасно из-за их сосудистых и кардиальных эффектов. Кроме того, есть данные, что на фоне их применения увеличивается риск кровотечения. В то же время отсутствие убедительных клинических данных о неблагоприятном эффекте блокаторов кальциевых каналов в периоперационном периоде, а также их способность уменьшать риск сердечно-сосудистых осложнений (ишемия, эпизоды наджелудочковой тахикардии, смерть/инфаркт миокарда) позволяют безопасно применять препараты данной группы (дилтиазем) в периоперационном периоде у пациентов с фракцией выброса больше 40%.
Ингибиторы АПФ/Блокаторы рецепторов ангиотензина II
Данные о применении препаратов данного класса противоречивы, поэтому во избежание постиндукционной гипотензии рекомендуют отменить препараты данных групп не менее, чем за 10ч до операции.
Амиодарон
В связи с длительным периодом полувыведения (58дней) отмена препарата нецелесообразна. Амиодарон можно безопасно применять в периоперационном периоде.
Варфарин
При проведении процедур с низким риском кровотечения (эндоскопия, колоноскопия) терапию варфарином можно не прекращать при условии поддержания MHO менее 3 на момент операции. Также возможно продолжение приёма варфарина при необширных поверхностных операциях, при которых кровотечение легко контролировать с помощью местных средств (при этом рекомендовано поддерживать уровень MHO на уровне 1,5—1,8). Во всех остальных случаях варфарин следует отменять за 5дней до операции, при этом MHO на момент операции не должно превышать 1,5. Тактика в отношении пациентов, находящихся на постоянном приёме варфарина, зависит от степени риска эмболических осложнений (табл. 92).
Таблица 92. Тактика ведения пациентов, получающих варфарин

Низкий риск
Отсутствие анамнестических указаний на тромбоэмболические эпизоды.
Давность последнего эпизода тромбоэмболии в венозной системе >3мс.
Давность последнего эпизода тромбоэмболии в артериальной системе >1мс.
Наличие биологического протеза клапана сердца без указаний на тромбоэмболические эпизоды.
Отсутствие постоянных факторов риска (злокачественные новообразования, тромбофилия, иммобилизация и т.д.).
Высокий риск
Давность последнего эпизода тромбоэмболии в венозной системе <3мс.
Давность последнего эпизода тромбоэмболии в артериальной системе <1мс.
Наличие механического протеза клапана сердца (риск при митральном пороке выше, чем при аортальном).
Фибрилляция предсердий.
Наличие постоянных факторов риска (злокачественные новообразования, тромбофилия, иммобилизация и т.д.).
Нефракционированный гепарин
Гепарин в виде внутривенного введения является препаратом выбора у пациентов, которым необходимо поддерживать гипокоагуляцию во время периоперационного периода. Преимущество такой тактики заключается в коротком периоде полувыведения гепарина (1-2ч). Недостаток — необходимость госпитализации и мониторирования АЧТВ. При достижении целевого значения АЧТВ инфузию гепарина прекращают за 6ч до операции. При подкожном введении гепарина последнее введение препарата осуществляют за 12ч до операции. Возобновление терапии гепарином начинают через 12ч после операции или позже в случаях продолжающегося кровотечения.
Низкомолекулярные гепарины
Последнее введение препарата осуществляют за 12ч до операции. Возобновление терапии в те же сроки, что и НФГ.
Антитромбоцитарные препараты и НПВП
Ацетилсалициловая кислота
Отмена за 7-10сут при хирургических вмешательствах:
тазобедренный и коленный сустав;
нёбные миндалины
сетчатка;
предстательная железа;
интракраниальные операции.
Во всех остальных случаях применение низких доз ацетилсалициловой кислоты допускается и даже необходимо у пациентов с высоким риском развития сердечно-сосудистых осложнений.
Тиклопидин и клопидогрел отменяют за 5-7дней до операции.
Короткодействующие НПВП следует отменить не менее чем за сутки до операции, препараты пролонгированного действия за 2-3дня. Селективные ингибиторы циклооксигеназы 2 типа (целекоксиб) также требуют отмены за 2-3дня до операции, но не из-за влияния на агрегацию тромбоцитов, а из-за почечных эффектов.
Препараты растительного происхождения, содержащие эфедру, женьшень, чеснок, имбирь, лакричник, пиретрум девичий, желтокорень канадский, обладают эффектами в отношении сердечно-сосудистой и свёртывающей системы, поэтому во избежание развития неблагоприятных эффектов в периоперационном периоде их следует отменять за 2нд до операции.
ПАЛЛИАТИВНАЯ ПОМОЩЬ В КАРДИОЛОГИИ
Паллиативная помощь palliative care — активная всесторонняя помощь пациентам, страдающим далеко зашедшим прогрессирующим заболеванием, основными задачами которой служат купирование боли и других симптомов, решение психологических, социальных и духовных проблем. Цель паллиативной помощи — достижение, насколько возможно, лучшего качества жизни больных и членов их семей.
Паллиативная медицина palliative medicine — особый вид медицинской помощи пациентам с активными проявлениями прогрессирующих заболеваний в терминальных стадиях развития с неблагоприятным прогнозом для жизни, целью которой служит обеспечение качества жизни. Это составляющая часть паллиативной помощи.
В кардиологической практике основными претендентами на получение паллиативной помощи являются пациенты с терминальной стадией хронической сердечной недостаточности.
Основные проблемы оказания помощи пациентам с ХСН
50% пациентов с тяжёлой ХСН умирают в течение 1года с момента установления диагноза.
Почти в 20% случаев смерти пациентов с сердечно-сосудистыми заболеваниями предшествует «терминальная фаза» продолжительностью от нескольких недель до нескольких месяцев.
В 90% случаев тяжесть состояния определяет наличие нескольких заболеваний.
Более 1/3 пациентов умирают дома в условиях амбулаторного наблюдения.
Клиническая картина болезни у пациентов с терминальной стадией ХСН
Современная терапия ХСН ориентирована на улучшение выживаемости и практически не оказывает влияния на симптоматику.
Стационарное лечение практически не облегчает или облегчает в минимальной степени клиническую симптоматику у 2/3 госпитализированных больных.
В общей картине болезни наибольшие страдания приносят симптомы, напрямую не связанные с основным заболеванием, и психологические проблемы.
Данные о частоте симптомов, наиболее часто наблюдающихся у больных с терминальной ХСН, представлены в табл. 93 (для сравнения представлены данные о частоте симптомов при терминальной стадии онкологических заболеваний).
Таблица 93. Частота симптомов у пациентов с терминальной стадией ХСН в сравнении с онкологическими больными

Рис. 33. Различные модели оказания паллиативной помощи.
А - активное лечение (направлено на излечение или увеличение продолжительности жизни);
Б — паллиативная помощь (направлена на контроль симптомов и сохранение качества жизни);
В - помощь семье при тяжёлой утрате.



Цели паллиативной помощи больным с ХСН
Облегчение страданий за счёт адекватного контроля симптомов.
Психологическая и духовная поддержка.
Сохранение качества жизни.
Сохранение автономии и уважение прав пациента.
Облегчение (но не ускорение и не пролонгирование) процесса умирания.
Поддержка семьи.
Определение показаний к паллиативному лечению больных с ХСН
 Таблица
94. Определение показаний к паллиативному лечению больных с ХСН
Таблица
94. Определение показаний к паллиативному лечению больных с ХСН

Контроль симптомов у больных с терминальной ХСН
Оцените адекватность получаемой пациентом схемы лечения сердечной недостаточности.
Оцените весь спектр получаемых пациентом препаратов на предмет возможной кардиотоксичности и неблагоприятных лекарственных взаимодействий.
Оцените выраженность всех имеющихся у пациента симптомов с целью проведения их коррекции.
Боль. Лечение хронической боли проводят в соответствии со ступенчатой схемой («анальгетическая лестница ВОЗ»),
Одышка. Нелекарственные меры: коррекция водного режима, оптимизация физической активности и расхода энергии, удобное позиционирование в кровати, применение направленной вентиляции (веер), психологическое консультирование. Лекарственная терапия: оптимизация лечения диуретиками и дигоксином, коррекция анемии при её наличии, кислород, опиоиды. При пароксизмальной ночной одышке — нитраты на ночь.
Отёки. Оптимизация водно-солевого режима, коррекция терапии диуретиками и дигоксином, контроль электролитов.
Потеря мышечной массы. Оптимизация диеты, физиотерапия, дополнительное питание энергетическими смесями.
Слабость. Коррекция анемии, оптимизация лекарственной терапии.
Тошнота/рвота. Оптимизация лекарственной терапии и режима питания, метоклопрамид (при нарушении моторики желудка) или галоперидол (при метаболических причинах тошноты и рвоты).
Головокружение. Исключение постуральной гипотензии, оптимизация лекарственной терапии (коррекция доз диуретиков и вазодилататоров).
Тревога и депрессия. Тщательная оценка симптомов, психотерапия, специфическая лекарственная терапия.
Последние дни жизни
Прогнозирование летального исхода у пациентов с терминальной стадией ХСН вызывает определённые затруднения, так как ухудшение состояния и значительное снижение функционального статуса может быть вызвано потенциально обратимыми причинами. Предикторы неблагоприятного ближайшего прогноза у больных с терминальной ХСН: отсутствие положительной динамики после предшествующей госпитализации, несмотря на адекватную терапию; ухудшение функции почек, отсутствие эффекта от коррекции дозы диуретиков и вазодилататоров, отсутствие видимой причины ухудшения состояния.
Существуют общие признаки приближающейся смерти.
Выраженная слабость.
«Прикованность» к постели.
Периодические нарушения сознания.
Сонливость.
Уменьшение потребности в пище и воде.
Невозможность перорального приёма лекарственных препаратов.
Признаки периферической гипоперфузии.
При появлении этих признаков необходимо оценить наличие обратимых причин ухудшения состояния (инфекция, гипоксия, метаболические расстройства, интоксикация, кровотечение) и при возможности их устранить. В остальных случаях необходимо обеспечить физический и психологический комфорт умирающему пациенту. Как правило, из лекарственных средств в последние несколько часов жизни применяют анальгетики, противорвотные средства, седативные средства и нейролептики, а также антисекреторные агенты (гиосцина бутилбромид) для подавления терминальной бронхиальной гиперсекреции.